生物制品物料质量标准的动态建立策略
生物制品物料作为生物制药生产的核心基础,其质量直接决定最终产品的安全性、有效性与质量稳定性。生物制品物料具有来源复杂、结构多变、对环境敏感等特性,使得其质量控制面临独特挑战。本文围绕生物制品物料质量标准的研究与建立展开系统探讨,阐述质量标准建立的原则与依据,构建临床前、临床阶段及商业化阶段的阶段性质控策略,结合具体案例分析质控项目设置与实施效果,深入讨论质量标准与工艺的协同关系。研究表明,生物制品物料质量标准的建立应遵循阶段推进、风险导向、工艺相关原则,科学合理的质量标准是保障生物制品全生命周期质量可控的关键。本文提供的标准建立策略与实施路径,可为生物制品企业提供实践参考,助力行业质量体系的完善与国际化发展。
Part.01 前言
1.1 生物制品物料质量控制的特殊性与重要性
生物制品是通过基因工程、细胞工程等现代生物技术制备的无菌制剂,以微生物细胞、动物细胞、重组细胞株及天然生物提取物为起始原料,广泛应用于传染病预防、肿瘤治疗、免疫调节等疾病防治领域 [1-4]。其生产涉及的物料体系复杂,涵盖源头原材料、生产辅料及中间产品三大类,来源分散于植物、动物、微生物等多个生物谱系。这些物料的纯度、活性、稳定性等关键质量属性,直接决定了最终产品的临床安全性与治疗有效性,任一环节的质量瑕疵都可能传导至成品,引发安全风险。
与结构明确、性质稳定的化学药品物料相比,生物物料特性差异显著。其活性成分多为蛋白质、多肽、核酸等生物大分子,含多个活泼功能基团,化学稳定性较弱,在生产或储存中易发生水解、酶解、氧化等化学降解,以及变性、聚集、沉淀等物理变化。生物物料对环境因素高度敏感,温度、pH 值、光照、氧气等微小波动,均可能引发活性成分不可逆改变。同时,其质量受种属差异、产地环境、采收季节、加工工艺等多重因素影响,导致质量均一性控制难度较大,凸显了生物物料质量控制的特殊性与复杂性。
近年来,全球药品安全事件频发,人畜共患疾病传播风险上升,生物制品物料的质量与安全性备受行业及监管机构关注。健全的生物物料质量控制系统是研发、生产、流通全链条的基本保障,可为产品有效期确定、工艺优化、配方调整等提供科学依据,也是建立和提升产品质量标准的基础。生物物料按风险等级分为四级,高危物料需经过严格的病毒灭活、杂质去除及质量检定 [5]。若缺乏科学的原料质量标准,可能导致生产污染风险失控、产品批次质量波动,甚至出现宿主细胞蛋白、DNA 残留等问题,危及患者用药安全。因此,建立生物物料专门质量标准,实施全生命周期质量控制,是生物制品行业可持续发展的核心支撑。
1.2 国内外相关法规与指导原则概述
世界各国高度重视生物制品物料质量监管,已构建多层次、全覆盖的法规与指导原则体系,为质量标准制定提供明确依据。
在国际层面,《美国药典》(USP)制定了全球公认的药用生物原材料质量标准,采用先进检测技术提升精准度 [8]。《欧洲药典》(EP)拓展了生物材料质量规范,补充了相关检测参考数据。《英国药典》(BP)涵盖生物原材料检测标准、成品规格等,是英国药品标准化的核心依据。国际人用药品注册技术协调会(ICH)发布的系列指 南, 如 ICH Q5C、Q1B、Q5D 等,明确了稳定性研究、光稳定性控制、细胞基质质量控制等要求,提供了全球统一技术标准[2-3,5-9]。此外,世界卫生组织(WHO)的 GMP 指南设有生物制品专项附件,为全球生物物料质量控制提供基础遵循 [4]。
在中国,《中华人民共和国药典》是药品质量管理的基础性法规,强制规定药品质量标准和分析方法,覆盖生产、流通、使用及监管全环节。2025 年版《中国药典》分为四部,第三部专门收载生物制品相关标准,新增细胞基质质量控制规范及 NGS 等替代检测技术要求 [6-7]。国家药品监督管理局(NMPA)颁布的《生物制品稳定性研究技术指导原则(试行)》等文件,进一步明确了生物材料各阶段质量控制要求。同时,《药品生产质量管理规范》(GMP)对生物物料的接收、储存、检验、追溯作出具体规定,要求建立供应商审计和物料追溯系统。这些法规与指导原则相互衔接,构建了科学合规的质量标准体系,保障了质量控制工作的合规性与科学性 [10-13]。
Part.02 质量标准建立的原则与依据
2.1 执行原则
生物制品物料质量标准的建立需遵循三大核心原则。第一是风险导向原则,针对物料在生产过程中可能引入的污染风险、工艺影响风险及质量波动风险,确定关键质控项目与限度。生物制品物料的污染源主要包括微生物污染、化学物质残留及寄生虫感染,需通过针对性的质控项目降低安全风险。第二是阶段适配原则,根据生物制品研发与生产的不同阶段,制定与之匹配的质量标准。临床前阶段侧重安全性筛查,临床阶段逐步完善质控指标,商业化阶段建立全面系统的质量控制体系。第三是工艺相关性原则,质量标准需与物料的生产工艺、制备流程紧密结合,充分考虑工艺对物料质量的影响,确保质控项目能够有效反映工艺稳定性与物料适用性 [14-16]。
2.2 法规依据
质量标准的建立必须严格遵循国内外相关法规与指导原则。在国际层面,需符合 USP、EP、BP 等权威药典的相关要求,参考 ICH 系列指导原则的技术规范。USP 制定的质量标准涵盖 3700 多篇专论,提供 1600 多个主要化学参考标准,其微生物限度检查项目已从第 19 版的 35 种增至第 24 版的 217 种,其中包含 13 种动物来源的生物原料标准。EP 第 4 版收录 1750 种生物原材料的质量标准,部分生物原料还列出可能存在的杂质及化合物结构式与图谱,欧洲药品质量管理局通过出具适用性证书,确保生物原材料符合 EP 要求。BP(1998 版)和 EP(1997版)收录 43 种微生物限度检查项目,其中 4 种为动物源性品种。
在国内层面,需严格遵循《中国药典》的强制要求,《中国药典》四部对生物制品物料的质量控制方法、限度标准等作出明确规定。国家药品监督管理局发布的相关指导原则,如《已上市生物制品药学变更研究技术指导原则(试行)》《已上市疫苗药学变更研究技术指导原则(试行)》,对物料变更后的质量标准调整提出具体要求。此外,《药品生产质量管理规范》(GMP)对生物制品物料的储存、运输、检验等环节的质量控制作出系统性规定,是质量标准建立的重要法规依据 [17-21]。
2.3 物料用途与工艺特性的影响
生物制品物料的用途直接决定质量标准的核心质控方向。用于生产疫苗的生物原材料,需重点控制微生物污染与生物活性指标;用于制备单克隆抗体的细胞原料,需严格检测细胞纯度、活力及外源因子污染情况;用于制剂的辅料,需关注与主药的相容性及化学稳定性。不同用途的物料,其质控项目与限度要求存在显著差异。
工艺特性对质量标准的建立具有重要影响。生物制品物料的生产工艺复杂,涵盖培养、分离、纯化、冻干等多个环节,每个环节均可能影响物料质量。例如,细胞培养过程中可能引入支原体污染,纯化工艺可能导致目标成分损失或杂质残留,冻干过程可能影响物料的生物活性。因此,质量标准需针对工艺关键控制点设置相应质控项目,如针对纯化工艺设置杂质含量检测指标,针对冻干工艺设置水分含量与生物活性检测项目。
生物制品物料的物理化学特性也需纳入质量标准考量。多数生物制品物料对温度、湿度、光照等环境因素高度敏感,易发生降解、聚集或活性丧失。因此,质量标准中需明确物料的储存条件、运输要求及有效期,同时设置相应的稳定性检测项目,如加速稳定性试验和长期稳定性试验相关指标,以确保物料在规定条件下的质量稳定性。
Part.03 阶段性质控策略的构建
3.1 临床前阶段
临床前阶段的质控策略以安全性筛查为核心目标,兼顾可行性与探索性。该阶段物料的质量标准侧重于排除重大安全风险,为临床前研究提供可靠的物料基础。质控项目设置以基础安全性指标为主,包括微生物污染物检测、化学残留检测及主要活性成分的定性与初步定量。微生物污染物检测涵盖大肠埃希菌、大肠菌群、沙门氏菌、金黄色葡萄球菌等致病性微生物,检测方法参考 USP、EP 及《中国药典》规定的标准方法 [22]。化学残留检测重点关注生产过程中可能引入的有机溶剂残留、重金属等有害物质。主要活性成分检测采用适宜的定性方法确认物料身份,同时建立初步的定量方法,为临床前药效学研究提供数据支持。
3.2 临床阶段(I–III 期)
临床阶段的质控策略逐步从安全性导向转向安全性与有效性并重,质量标准随着临床试验的推进不断完善。I 期临床试验阶段,物料质量标准在临床前基础上进一步优化,重点完善主要活性成分的定量检测方法性。
II 期临床试验阶段,质量标准开始关注物料的一致性与稳定性。通过扩大样品批次,验证质控方法的适用性与可靠性。同时可参考供应商提供的稳定性研究数据,确认物料在模拟运输与短期储存条件下的质量变化,为临床试验用物料的运输与储存提供支持。
III 期临床试验阶段,质量标准已基本接近商业化阶段要求,具备全面性与系统性。质控项目涵盖身份鉴别、纯度、活性、杂质含量、微生物限度、稳定性等多个方面。身份鉴别采用特异性强的检测方法,如肽图分析、核酸分子鉴定技术等;纯度检测采用十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳(SDS-PAGE)、分子排阻色谱(SEC)等方法,控制分子大小变异体与电荷变异体含量;活性检测采用生物学活性测定方法,确保物料的临床有效性;杂质含量检测涵盖工艺相关杂质、产品相关杂质及外源污染物;微生物限度检测严格遵循各国药典要求,控制致病性微生物污染风险。
3.3 商业化阶段
生物制品物料的预定用途决定了质控标准的核心。疫苗原料以微生物污染防控和生物活性保障为关键,需筛查细菌、真菌、支原体等,重点防控病毒及未知微生物污染,同时通过效价测定确保免疫原性达标。单抗生产用细胞基质聚焦于纯度、活力及外源因子,保证细胞增殖率,并覆盖多类污染物检测。制剂辅料的质控核心是与原料药的相容性及稳定性,同时需评估环境因素影响。
工艺特性对质量标准起关键导向作用。细胞培养过程中易引入污染物,细菌污染会导致培养液混浊,而支原体可穿透常规滤膜,风险较为隐蔽。分离纯化过程中可能破坏目标分子或残留杂质,需进行杂质谱分析与纯度验证。冻干工艺需严格控制预冻温度、真空度等参数,以及水分含量等相关指标,以避免物料变质或活性丧失,质量标准需嵌入全流程参数控制。
生物材料的理化特性是质控的重要考量因素。此类材料多为生物大分子,对温度、pH 等条件敏感,温度每升高 10℃,降解速率可加快 2 ~ 3 倍;pH 偏离 0.5 个单位可能导致构象发生不可逆变化。因此,需明确存储、运输条件及有效期,并建立加速和长期定性试验方案,以验证质量保持能力。
Part.04 案例分析
4.1 案例背景
临床前阶段的质控策略以安全性评价为核心导向,同时兼顾方法学的可行性和研究的探索性。其核心目标是建立能有效排除微生物污染、化学残留超标等重大安全风险的物料质量标准,为临床前药效学研究、毒理学评价提供质量均一、安全可靠的物料基础,避免因物料质量问题导致研究数据失真或试验失败。
质控检测重点聚焦三大类基本安全参数,包括微生物污染物全面评估、化学残留精准检测以及关键组分的鉴定和初步定量。微生物检测采用 USP、EP 和中国药典收载的已验证方法,涵盖大肠埃希菌、大肠菌群、沙门氏菌、金黄色葡萄球菌等致病菌。同时需要筛查支原体、真菌及潜在病毒,通过无菌检查、PCR 检测等多种方法组合确保无遗漏。化学残留分析针对生产过程中可能引入的有害物质,因此需要重点检测残留溶剂和重金属污染物,避免残留物质引发毒性反应。活性组分鉴定采用免疫印迹、质谱等定性方法确认结构完整性,同时建立 ELISA、HPLC 等初步定量分析方法,精准测定活性组分含量范围,为临床前药效学评价提供标准化的剂量参考数据,确保试验结果的科学性和可比性。
4.2 质控项目设置
依据临床前、临床试验和商业化生产等不同产品研发进展,对组氨酸的质量标准进行分阶段设置,涵盖性状、鉴别、重金属、干燥失重、微生物限度等关键项目。各阶段质控项目如表 1 所示。
表 1 不同阶段组氨酸质量控制项目
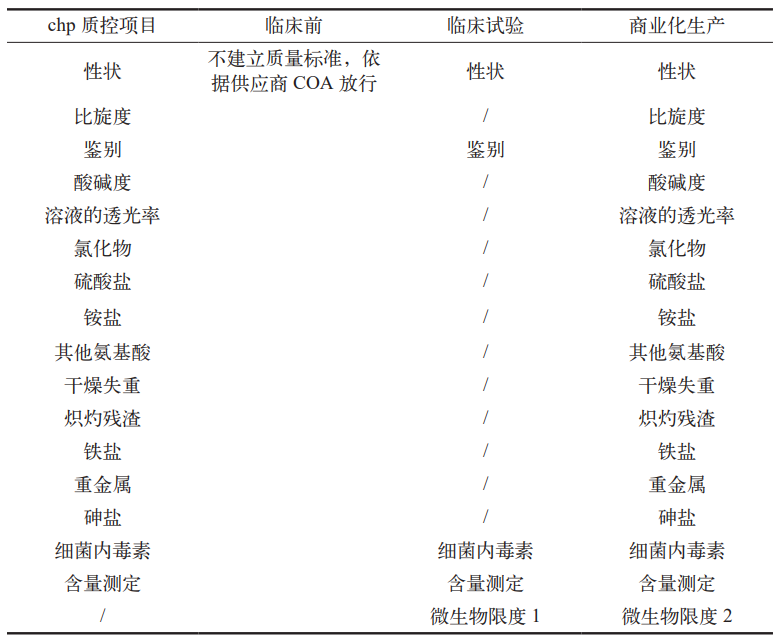
4.3 实施效果
临床前阶段通过阶梯式质控策略完成重组蛋白疫苗用组氨酸筛查,依供应商出厂检测报告放行,重点核查安全性与有效性指标,同步核查杂质数据及来源追溯信息。从检测结果来看,12 批次物料均未检出致病菌,微生物限度≤ 100 CFU/g,含量为98.5% ~ 101.5%,为动物药效学、毒性试验提供质量均一的物料基础。
临床阶段质控逐步完善。I 期优化含量测定方法,确立 HPLC 法,批次含量稳定在 99.0% ~ 101.0%。II 期新增细菌内毒素检测,用 rFC 法控制限度< 6.0 EU/g,符合药典要求。III 期升级质控体系:红外与拉曼光谱联合鉴别,微生物限度零检出致病菌,整合供应商的稳定性数据,结合冷链运输温度监控,保障多中心试验物料的稳定性。
在商业化阶段形成全链条管控体系,质控项目涵盖性状、比旋度等全项指标,符合 2025 年版中国药典要求:物料为白色结晶性粉末,比旋度为+12.0°至 +12.8°,pH 值为 7.0 ~ 8.5,氯化物、硫酸盐含量≤ 0.02%,重金属含量≤ 10 ppm,细菌内毒素< 6.0 EU/g。连续 50 批次关键属性波动≤ 2%,方法学验证合格,确保规模化生产质量稳定。
工艺变更需按 NMPA 指导原则进行分级研究:II 类变更需进行 3 批质量对比,I 类变更需补充安全有效性数据,变更报告经审核后报监管机构审批备案。
该策略实施成效显著:3 年累计检测 120 余批次,质量全部达标;临床试验1200 余例,无物料相关安全问题;商业化生产合格率为 100%。组氨酸作为关键辅料,为疫苗效价及安全提供保障。
Part.05 讨论
生物制品物料质量标准与生产工艺具有密切的协同关系。生产工艺的优化会影响物料的质量属性,进而要求质量标准进行相应调整;而质量标准的完善又能为工艺优化提供数据支持,促进工艺的稳定与改进。
标准建立需兼顾国际化与本地化:国际化需符合 ICHQ9、USP/EP 规范;本地化要适配国内生产与监管,制定可行的杂质限度。平衡需依托风险评估,共性指标采纳多方药典要求,国际特殊要求结合上市规划一并纳入,国内要求按NMPA 执行,并建立法规跟踪机制,确保标准的科学性和合规性。
Part.06 结论
生物制品物料质量标准的建立是保障生物制品安全、有效与质量可控的关键环节,其建立过程应遵循阶段推进、风险导向、工艺相关原则。临床前阶段以安全性筛查为核心,临床阶段逐步完善质控项目与限度要求,商业化阶段建立全面系统的质量控制体系,形成覆盖生物制品全生命周期的质控策略。
质量标准的建立需充分考虑国内外相关法规与指导原则要求,结合物料用途与工艺特性,确保标准的合规性、科学性与可操作性。案例分析表明,科学合理的质量标准能够有效保障生物制品物料的质量稳定性与一致性,为临床试验与商业化生产提供可靠支撑。
质量标准与生产工艺的协同优化、国际化与本地化的有机平衡,是生物制品物料质量标准建立的重要考量因素。未来,随着全过程质量控制体系的完善、检测技术的创新应用及质量标准个性化与精准化的发展,生物制品物料质量控制水平将不断提升。
本研究构建的生物制品物料质量标准建立策略与实施路径,为生物制品企业提供了可操作的实践参考。科学合理的质量标准不仅能够保障生物制品的质量安全,还能促进生物制品行业的健康发展与国际化进程,为我国生物制药产业的高质量发展提供有力支撑。
参考文献
[1] 李文庆,温宝庆,谭国英,等.真菌类中药质量标准及检测技术研究进展[J]. 药物分析杂志,2025,45(07):1137-1156.
[2] 马瑾,骆永明,胡清,等. 中国土壤环境基准与标准研究五十年:发展历程与未来展望[J]. 环境科学研究,2025,38(08):1649-1667.
[3] 杨晨,郑玉霄,彭艳梅,等. 蕲蛇毒质量标准及其稳定性研究[J]. 中国现代应用药学,2025,42(20):3577-3585.
[4] 龙佳,李楠,田晋茹,等. 大蜜丸炼蜜单元5-HMF的中药制造测量技术进展[J]. 中国中药杂志,2025,50(21):5987-5998.
[5] 王华伟,隋鑫,吴秀君,等. 泊沙康唑肠溶片的质量评价与生物等效性研究[J]. 中国新药杂志,2025,34(08):843-849.
[6] 李龙杰,王小凤,杨鸿溢,等.基于生理药动学模型的华法林钠片临床相关质量标准的研究[J].中国药学杂志,2025,60(11):1187-1196.
[7] 阚红金,韦薇,程速远. 治疗用重组蛋白类生物制品沟通交流常见问题探讨及评价考虑[J]. 中国新药杂志,2025,34(06):590-595.
[8] 胡昌勤,姚尚辰,冯艳春. 抗生素质量标准的发展及关注点[J]. 中国抗生素杂志,2025,50(03):241-255.
[9] 杨英,饶春明. 干细胞产品质量控制分析方法研究进展[J]. 药物分析杂志,2025,45(01):4-11.
[10] 吴颉,周炜清,赵岚,等. 微球核心技术赋能生物制药全链条创新[J]. 中国科学院院刊,2025,40(01):79-90.
[11] 李怡君,魏开坤. 探讨“以患者为中心的质量标准”在治疗用生物制品中的应用[J]. 中国新药杂志,2024,33(23):2438-2445.
[12] 顾杰,汪祺,赵宇新,等. 基于中药监管科学的中药制剂质量标准研究策略与方法[J]. 中国药学杂志,2025,60(02):121-129.
[13] 刘荣,冯巧巧,董方,等. 生物制品稳定性研究考虑因素及常见缺陷分析[J]. 中国现代应用药学,2024,41(18):2460-2465.
[14] 吕昀,程文倩,牛可敬,等. 基于多维整合策略的中药复方制剂质量评价研究[J]. 中草药,2024,55(22):7847-7856.
[15] 李怡君,寇雅真,魏开坤,等.生物制品生命周期管理中分析方法变更的审评考虑和案例研究[J].中国新药杂志,2024,33(11):1102-1108.
[16] 贾纪元,姜大成,张震,等. 哈蟆油抗衰老活力生物效价检测方法的研究[J]. 世界科学技术-中医药现代化,2024,26(04):1008-1016.
[17] 赵靖,邱晓,韦薇. 已上市重组治疗用生物制品注册标准变更的审评考虑[J]. 中国新药杂志,2024,33(09):868-873.
[18] 郭愿生,左甜甜,陈安珍,等.海洋中药中重金属及有害元素质量控制进展及未来发展方向[J].中国新药杂志,2024,33(09):877-884.
[19] 聂黎行,吴炎培,刘静,等. 中成药质量标准研究有关问题思考[J]. 药学学报,2023,58(08):2260-2270.
[20] 宋丽娜,徐刚领,葛玉梅,等.生物类似药质量相似性评价和技术要求[J]. 中国药学杂志,2022,57(23):1954-1961.
[21] 谭德讲,韩璐,段丽,等. 生物效价限度标准的确立要点探讨[J].药物分析杂志,2022,42(06):956-961.
[22] 王鑫格,李娜,许宜平,等. 基于有机污染物生物有效性的土壤环境质量基准的探讨[J]. 生态毒理学报,2022,17(01):32-46.
邵丽竹
何发
相关推荐
-
人工智能在生物医药领域的应用前景分析及对策建议
以人工智能为代表的新一代信息技术辅助新药研发,显著提升了新药研发效率和成功率,大幅降低了研发成本,初步证实了人工智能在辅助新药研发中的实用性和巨大潜力。
2025-11-14 张琦 刘中全
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多