制药分离技术在生物制药中的应用与探究
本文围绕生物制药产业的发展需求,系统探讨了制药分离技术的应用现状与优化路径。首先,对沉淀分离、超临界流体萃取、膜分离和层析等四大主流分离技术的原理、特点及适用场景进行了分类解析。其次,结合血液制品、生物发酵药物、疫苗及抗体药物等典型实例,深入阐述各类技术在实际生产中的应用成效与关键挑战。随后,从加强基础设施建设、提升过程控制与自动化水平、践行绿色低碳与可持续发展理念三个方面,提出分离纯化过程的核心注意事项与实施要点。最后,文章总结指出,技术选择应紧密结合产品特性,技术创新是推动产业升级的核心驱动力,而质量保障与环境保护则是实现可持续发展的根本基石。展望未来,亟需针对新型生物制品开发专用分离技术,并加快产学研协同创新,促进科技成果转化,全面提升我国生物制药产业的技术竞争力,为行业技术选型与质量管理体系优化提供有力支撑。
生物制药产业作为生物医药领域的重要分支 [1],凭借其靶向性强、疗效显著、副作用低的优势,已成为治疗恶性肿瘤、自身免疫疾病、罕见病等重大疾病的关键支撑。产品体系从疫苗、血液制品拓展至单克隆抗体、重组蛋白等前沿品类,生物制药的产品结构不断丰富,但生产过程面临复杂度高、纯度要求高、产量低的核心挑战。随着生物制药向规模化、精细化、智能化的方向发展,制药分离技术迎来创新升级,传统沉淀法不断优化,膜分离、层析、超临界流体萃取等新型分离技术持续涌现,这些技术迭代成为产业升级的核心动力。本文将系统梳理生物制药的产业特征,剖析主流制药分离技术的原理与优势,结合具体应用场景探讨技术落地路径,并提出分离纯化过程中的关键注意事项,为生物制药企业的技术选型与质量管控提供参考。
Part1 生物制药概述
生物制药是指利用生物体(如微生物、动物细胞、植物细胞等)、生物组织或其代谢产物,结合生物学、分子生物学、生物工程学、免疫学、微生物学等学科原理与技术,研发和生产用于预防、诊断、治疗人类疾病的药物[2-3]。其核心特征主要体现以下三个方面:一是原料的特殊性,生物原料多为活体细胞或复杂的生物大分子混合物,对温度、pH值、渗透压等环境因素非常敏感,易发生变性、降解或团聚;二是产品的高纯度要求,生物制品中宿主细胞蛋白(HCP)需控制在 10 ng/mg 以下,内毒素需低于 0.1 EU/mL,核酸残留需<10 pg/ 剂量,它的纯度标准远高于化学药物;三是生产过程的复杂性,分离纯化工艺复杂,每一步均需严格控制,且工艺放大过程中易出现规模效应偏差。目前,主要产品类别包括疫苗、血液制品、重组蛋白药物、单克隆抗体、基因治疗药物等。由于不同产品的分子结构、理化性质存在差异,对制药分离技术的适应性和针对性提出了更高要求。
Part2 制药分离技术的类型及原理
制药分离技术的核心原理是利用目标成分与杂质在物理性质、化学性质、生物性质上的差异,通过压力、温度、浓度梯度等外力驱动实现分离。根据分离机制的不同,主流技术可分为沉淀分离、超临界流体萃取、膜分离、层析四大类。
2.1沉淀分离技术
沉淀分离技术是最经典的生物大分子分离方法,通过改变溶液环境,破坏目标蛋白质的水化层或表面电荷平衡,使它从溶液中析出,再通过离心或过滤实现固液分离。该技术操作简单、成本低、处理量大,适用于发酵液预处理、血浆初步提纯等粗分离阶段,常见类型包括:
(1)等电点沉淀法:蛋白质的等电点(pI)是指其表面净电荷为零时所对应的 pH 值,该点反映了蛋白质分子中氨基酸残基的酸碱性 [4]。在等电点时,蛋白质分子间的静电斥力最小,分子间易于聚集,导致溶解度降至最低,易发生沉淀或絮凝。通过向溶液中添加酸或碱调节 pH 至目标蛋白的 pI,可实现选择性沉淀。例如,血浆中的人纤维蛋白原(pI=5.5)在 pH=5.5 的醋酸缓冲液中沉淀,可与白蛋白(pI=4.7)有效分离 [5-6]。
(2)盐析法:高浓度中性盐会与蛋白质竞争溶液中的水分子,破坏蛋白质表面的水化层,同时中和部分表面电荷,导致蛋白质分子聚集沉淀。该方法的关键在于盐浓度的分级控制,不同蛋白质的盐析饱和度不同,通过逐步提高盐浓度,可实现多组分的分步分离。
(3)有机沉淀剂沉淀法:向溶液中添加甲醇、乙醇、丙酮等水溶性有机溶剂,可降低溶液的介电常数,增强蛋白质分子间的疏水相互作用,促使其沉淀。该方法沉淀速度快、分辨率高,但有机溶剂易导致蛋白质变性,需在低温下操作,且需严格控制溶剂浓度。
2.2超临界流体萃取技术
超 临 界 流 体 萃 取(Supercritical Fluid Extraction,SFE)是一种利用超临界流体(其温度和压力高于临界点 [7])从生物原料中选择性萃取目标成分的技术。其核心原理在于超临界流体的溶解度会随着压力和温度的变化而发生显著变化。通过调节压力,可以使超临界流体对极性不同的成分产生差异化溶解。随后,通过降低压力或升高温度,使超临界流体恢复为气态,从而实现溶剂与萃取物的无残留分离 [8]。此外,SFE 技术在环境友好、低温操作保护热敏成分以及选择性强等方面具有显著优势 [9]。
2.3膜分离技术
膜分离技术是利用具有选择性透过性的膜材料,在压力差、浓度差、电位差等驱动力作用下,实现混合物中不同组分分离的技术 [10]。其核心特征为物理筛分与化学选择性,即膜的孔径大小决定了分子大小的截留,而膜表面的化学基团则决定了化学性质截留。在生物制药领域,根据膜对物质的截留分子量从大到小排序,常用的膜分离技术主要分为微滤、超滤、纳滤与反渗透四类(如图 1 所示),各类技术的参数特性及应用场景如下:
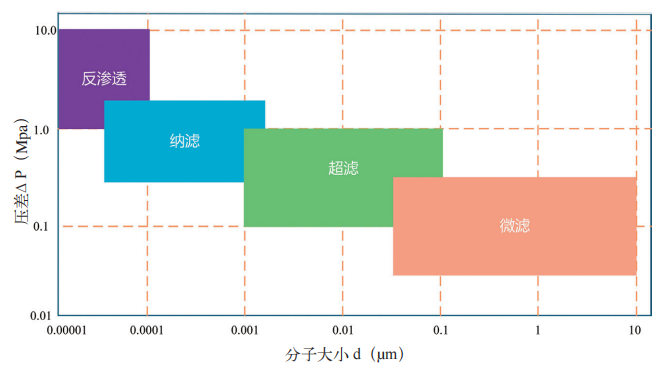
图 1 膜工艺的分类及对应的被分离分子的大小
(1) 微 滤(MF): 膜 孔 径 为0.05 ~ 10 μm,驱动力为压力差(通常在 0.05 ~ 0.5 MPa 之间),主要用于去除发酵液中的微生物、细胞碎片及大颗粒杂质。例如,CHO 细胞培养液经微滤处理后,可去除 99% 以上的宿主细胞碎片,为后续层析纯化提供澄清料液。
(2) 超 滤(UF): 膜 孔 径 为1 ~ 100 nm,驱动力为压力差(通常在0.1 ~ 1 MPa 之间),基于分子大小筛分原理,用于浓缩目标蛋白或去除小分子杂质。例如,在重组人干扰素(分子量 20 KD)的纯化过程中,采用 30 KD超滤膜可截留干扰素,同时去除小分子杂质(如培养基残留、核酸片段)。
(3) 纳 滤(NF): 膜 孔 径 为0.5 ~ 2 nm,驱动力为压力差(通常在0.5 ~ 2.0 MPa 之间),兼具筛分效应和电荷效应,可截留 Ca2+、SO42- 等二价或多价离子、抗生素、多糖等小分子有机物,允许单价离子和水分子透过。例如,在青霉素纯化中,纳滤膜可浓缩抗生素溶液,同时脱盐,降低后续结晶工艺的杂质含量。
(4)反渗透(RO):膜孔径< 0.1 nm,驱动力为高压(通常在 1.0 ~ 10 MPa之间),基于溶解、扩散原理,仅允许水分子透过,几乎截留所有溶质(如无机盐、有机物、微生物),主要用于生物制药用水制备或发酵液的脱水浓缩。
2.4层析技术
层析技术(又称色谱技术)是生物制药中实现高精度纯化的核心技术 [11],尤其适用于单克隆抗体、重组蛋白等高端生物制品的精制阶段,可将产品纯度从 90% 提升至 99.9% 以上。其原理是利用目标成分与杂质在固定相(如树脂、凝胶等)和流动相(如缓冲液)之间的分配系数差异。当混合物随流动相流经固定相时,各组分与固定相发生差异化的相互作用,导致迁移速度不同,最终实现分离。根据分离机制的不同,生物制药中常用的层析技术包括:
(1)离子交换层析(IEC):固定相为表面键合带电基团的树脂,基于电荷相互作用进行分离。目标蛋白在特定 pH 下带电荷,与固定相发生静电结合,再通过提高流动相盐浓度竞争结合位点,实现解吸洗脱。例如,单克隆抗体在 pH=5.0 的醋酸缓冲液中带正电,可与阳离子交换树脂结合,而宿主细胞蛋白带负电或电中性,随流穿液去除,再用 0.5 M NaCl 洗脱抗体,纯度可达95% 以上。
(2)亲和层析(AC):固定相为表面键合特异性配体的树脂,基于生物特异性结合进行分离,选择性极高。例如,Protein A 亲和层析与抗体的 Fc 段特异性结合,发酵液流经树脂时,抗体被截留,杂质随流穿液去除,再用酸性缓冲液洗脱抗体,一步纯化回收率可达90%,纯度超 98%。
(3)疏水相互作用层析(HIC):固定相为表面键合疏水基团的树脂,流动相为高盐缓冲液,基于疏水相互作用进行分离。在高盐环境下,蛋白质表面疏水区域暴露,与固定相结合,再通过降低流动相盐浓度减弱疏水作用实现洗脱,该技术常用于去除抗体的聚集体。
(4)凝胶过滤层析(GFC):固定相为多孔凝胶颗粒,基于分子大小筛分原理进行分离。小分子可进入凝胶孔隙,迁移路径长、洗脱时间长;大分子无法进入孔隙,迁移路径短、洗脱时间短。主要用于去除目标蛋白中的小分子杂质或控制聚集体含量,如疫苗纯化中,GFC 可分离病毒颗粒(大分子)与宿主细胞蛋白片段(小分子)。
Part3 制药分离技术在生物制品中的应用
3.1沉淀分离技术在血液制品中的应用
血液制品是以人体血浆为原料,生产人白蛋白、人免疫球蛋白、人凝血因子Ⅷ、人纤维蛋白原等产品的生物制品。其原料血浆中成分复杂,且易受乙肝病毒、丙肝病毒、HIV 等病毒污染,沉淀分离技术是其粗分离阶段的核心手段。例如,人血白蛋白纯化,传统工艺采用低温乙醇分级沉淀法(Cohn 6 法),通过精准控制乙醇浓度、pH、温度、离子强度、蛋白浓度,实现多步沉淀:
● 第一步(乙醇浓度 8%、pH=7.2、温度 -2℃、蛋白浓度 5.1 g/dl、离子强度 γ/2=0.14):沉淀纤维蛋白原和冷不溶球蛋白,去除大部分大分子杂质;
● 第 二 步( 乙 醇 浓 度 25%、pH=6.9、温度 -5℃、蛋白浓度 3.0 g/dl、离子强度 γ/2=0.09):沉淀 γ- 球蛋白(免疫球蛋白原料)与白蛋白分离;
● 第 三 步( 乙 醇 浓 度 40%、pH=5.2、温度 -5℃、蛋白浓度 2.5 g/dl、离子强度 γ/2=0.01):沉淀白蛋白,离心收集沉淀后,再经溶解、脱盐、灭菌,得到纯度 95% 以上的白蛋白成品。该技术的优势是处理量大、成本低、乙醇可灭活部分病毒,但存在操作周期长、乙醇用量大、产品回收率较低的问题。目前,企业多通过优化工艺参数或结合膜过滤,将回收率提升至70% 以上,同时缩短生产周期。
3.2超临界流体萃取技术在生物发酵制药中的应用
生物发酵制药是指利用微生物发酵生产抗生素、维生素、酶制剂等产品。其中,红霉素、青霉素 G、维生素E 等脂溶性发酵产物的分离常面临有机溶剂残留高、热敏性损失大的问题。超临界流体萃取技术可有效解决这些行业痛点。以红霉素纯化为例,传统工艺采用乙酸丁酯萃取法 [12],不仅存在乙酸丁酯易残留的问题,且高温蒸馏会导致红霉素降解,影响产品质量与收率。为此,可采用超临界 CO2 萃取技术对工艺进行优化,如图 2 所示。
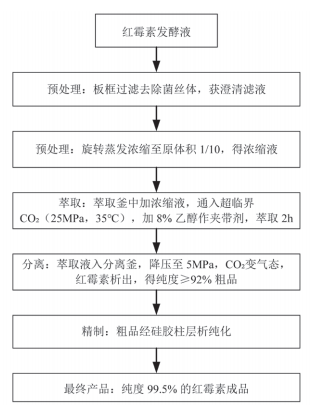
图 2 超临界 CO2 萃取法红霉素制备工艺优化流程
该工艺具备多重显著优势:红霉素回收率提升至 90%,有机溶剂残留<0.1 ppm,远低于药典标准;且萃取温度低,避免了红霉素的热降解;同时,CO2 可循环使用,进一步降低了生产过程中的环保成本。
3.3膜分离技术在疫苗制备中的应用
疫苗是预防传染病的核心生物制品,其生产过程需经历病毒培养、病毒收获、纯化、灭活等环节。其中,纯化阶段需去除宿主细胞碎片、核酸、内毒素等杂质,同时保留病毒颗粒的免疫原性。膜分离技术凭借其温和操作和高效截留的优势,已成为疫苗纯化的关键技术 [13],以冻干甲型肝炎减毒活疫苗为例,在冻干甲型肝炎减毒活疫苗纯化中,甲型肝炎病毒(HAV)需从人胚肺二倍体细胞(2BS 株)培养收获物中分离,去除宿主细胞碎片、杂蛋白及三氯甲烷残留。采用超滤工艺进行浓缩与病毒截留,使用截留相对分子质量为 300 KD 的膜包,对经 4 次三氯甲烷抽提后的抽提液进行超滤浓缩,同时用 Hank's液洗滤。最终收集的膜上液(疫苗原液)病毒滴度达 8.33 ~ 8.50 lgCCID50/mL,符合《中国药典》三部(2020 版)“不低于 8.00 lgCCID50/mL”的标准,保障疫苗有效性 [14]。
3.4层析技术在抗体药物中的应用
单克隆抗体(mAb)药物是生物制药领域规模最大的品类,生产以 CHO细胞为表达系统,培养液中抗体含量约 5 ~ 10 g/L,但含有宿主细胞蛋白(HCP)、核酸、内毒素、抗体聚集体等杂质,需通过层析技术纯化。典型工艺为“亲和层析→离子交换层析→疏水相互作用层析”三步法,以曲妥珠单抗(抗HER2 抗体)为例具体如下:
(1)Protein A亲和层析(捕获阶段)。作为抗体纯化的第一道防线,核心是利用 Protein A 与抗体 Fc 段的特异性结合,从复杂培养液中高效捕获目标抗体。杂质因无法结合而随流穿液排出,此步骤抗体回收率> 90%,纯度从 5% 提升至95% 以 上,HCP 残留从 10000 ng/mg降至 100 ng/mg 以下,为后续精制奠定基础。
(2)离子交换层析(精制阶段)。针对捕获后残留的 HCP、抗体聚集体和核酸,采用阳离子交换层析,基于抗体与杂质的电荷差异实现分离。抗体结合树脂,杂质随洗脱液去除,此步骤HCP 残留可降至 10 ng/mg 以下,聚集体含量< 1%,进一步提升抗体纯度与稳定性。
(3)疏水相互作用层析(抛光阶段)。作为最终纯化步骤,聚焦去除微量内毒素和顽固杂蛋白。采用苯基琼脂糖树脂,在高盐环境下抗体表面疏水区域暴露并结合树脂,杂质随流穿液排出。最终产品内毒素含量< 0.01 EU/mL,HCP 残留< 1 ng/mg,完全满足临床用药标准。
Part4 生物制药分离纯化过程的关键注意事项与实施要点
4.1加强制药基础设施建设
基础设施是分离纯化的硬件基础,直接影响工艺稳定性和产品质量,需重点关注以下方面:
(1)设备选型与维护。根据产品特性选择适配的分离设备,例如处理热敏性蛋白时,选用可制冷至 4℃的低温离心机组和带柱温控制系统的低温层析柱;处理高粘度发酵液时,选用高剪切力的板框过滤机。同时,需建立设备全生命周期管理制度。日常维护方面,每日清洁层析柱柱头、检查泵的密封性;每周校准紫外检测器的波长准确性、验证超滤膜的截留效率;定期检修时,每6 个月更换微滤膜滤芯、检查层析柱床层稳定性,每年对高压泵进行拆解维护、对发酵罐的搅拌系统进行平衡校准;建立设备故障台账,记录故障原因、处理方案及效果,避免同类问题重复发生。
(2)信息化与智能化升级。利用大数据与物联网技术构建数字化生产体系,通过传感器实时采集层析柱的压力、流速、温度,超滤过程的通量、截留率等关键参数,传输至 SCADA 系统进行实时监控;利用历史数据建立工艺模型,预测膜污染趋势,优化操作参数。
4.2加强过程控制和自动化水平
在生物制药分离纯化中,人为操作误差是导致产品质量波动的重要因素,加强过程控制和自动化水平可显著提升工艺稳定性:
(1)关键参数的精准控制。在生产过程中,通过采用自动化设备替代人工操作以提升精准性与稳定性:一方面,引入自动缓冲液配制系统,利用蠕动泵精准控制酸、碱、盐溶液的添加量,将缓冲液 pH 值偏差严格控制在< ±0.05,浓度偏差控制在< ±1%,从源头规避人工配制可能产生的操作误差;另一方面,采用连续层析系统,借助软件自动调控上样、洗涤、洗脱的流速与时间,有效避免人工切换步骤导致的参数波动,同时该系统还可同步自动完成紫外监测、洗脱液收集、峰值记录及洗脱程序控制,全方位保障层析过程的连续性与数据准确性 [15]。
(2)实时监测与反馈调节。在关键工艺节点安装在线检测设备,在层析洗脱过程中,在线紫外检测器实时监测抗体浓度,当检测到浓度达到设定阈值时,自动切换至收集阀;在超滤过程中,在线折光仪实时监测溶液浓度,当浓度达到目标值时,自动停止浓缩。
(3)智能化技术的应用。随着人工智能(AI)技术的发展,AI 在分离纯化过程控制中的应用逐渐增多 [16],利用机器学习算法分析历史纯化数据,优化层析洗脱的盐浓度梯度,使抗体回收率提升 5% ~ 10% ;利用数字孪生技术构建分离纯化过程的虚拟模型,模拟不同操作参数对产品质量的影响,提前预测工艺风险,减少试错成本。
4.3注重环保和可持续发展理念的应用
生物制药分离纯化过程会产生一定的废弃物(废层析树脂、废膜、废水),若处理不当会对环境造成污染。因此,需将环保理念融入工艺设计和生产全过程:
(1)绿色分离技术的开发与应用。在生产过程中,可通过资源循环利用与环保材料、试剂的选用,双管齐下推进绿色化转型。在超临界流体萃取环节,对所用 CO2 采用压缩回收工艺实现重复使用,减少原料消耗;层析过程中,将使用后的洗涤缓冲液经前期过滤除杂与后续脱盐处理后,重新用于层析柱平衡操作,进一步降低缓冲液用量。同时,在材料选择上,以可降解超滤膜材料替代传统不可降解聚合物膜,减少固体废弃物对环境的长期影响;在试剂使用上,则选用无磷清洗剂清洗设备,有效避免含磷废水排放引发的水体富营养化问题,全方位降低生产过程对环境的负担。
(2)废弃物的减量化与资源化处理。在分离纯化过程的废弃物与废水处理中,可通过资源化利用与分阶段处理实现环保目标。对于固体废弃物,废层析树脂经高温焚烧处理后,产生的热量可回收用于车间供暖,实现能量再利用;废膜则经破碎处理后,作为塑料再生原料用于制作非药用包装材料,减少固体废弃物的环境占用。对于产生的废水,先通过预处理去除水中的悬浮物和部分有机物,再进入生物处理系统降解化学需氧量(COD),最终使出水 COD 控制在< 50 mg/L,达到国家排放标准后再进行排放,全方位降低生产过程对环境的影响。
(3)能源节约。在降低生产能耗方面,可通过针对性优化设备运行参数实现。如在超滤过程中,采用错流过滤方式替代传统的死端过滤,能有效提高过滤效率,从而降低设备运行能耗 [17] ;而在层析柱操作中,为维持稳定柱温,通过为层析柱配备保温夹套,利用车间余热替代额外加热,进一步减少了加热环节的能耗消耗,从不同生产环节共同推动整体能耗下降。
Part5 总结
生物制药产业的快速发展对制药分离技术提出了更高纯度、更高效率、更低成本、更环保的要求。本文通过对主流分离技术的原理剖析和应用案例分析,得出以下核心结论:
(1)技术选型需匹配产品特性。血液制品因处理量大、成本敏感,适合采用“沉淀分离 + 膜过滤”的组合工艺;抗体药物因纯度要求极高,需依赖“亲和层析 + 多步精制层析”的高精度工艺;疫苗因需保留生物活性,优先选择“微滤 + 超滤 / 纳滤”的温和分离技术。企业需根据产品的分子量、电荷、溶解度等特性,结合生产规模和成本预算,制定个性化的分离方案。
(2)技术创新是产业升级的核心动力。新型分离技术凭借高效、环保、自动化的优势,逐渐替代传统技术,连续层析技术可将抗体纯化的生产效率提升 3 倍,且减少了缓冲液消耗;膜色谱技术结合了膜分离的高通量和层析的高选择性,为大分子生物制品的纯化提供了新方向。
(3)质量与环保是可持续发展的基石。生物制药分离纯化需始终以“质量为核心”,通过完善基础设施、加强过程监督、提升自动化水平,实现产品质量的稳定可控;同时,需践行环保理念,通过溶剂循环、废弃物资源化、能源节约,降低生产过程对环境的影响。
展望未来,随着基因治疗、细胞治疗等新兴生物制品的涌现,分离技术将面临新的挑战 [18],需进一步突破技术瓶颈,开发针对新兴产品的专用分离技术。同时,加强产学研合作,推动实验室阶段的技术创新向工业化转化,将是提升我国生物制药产业竞争力的关键路径。
参考文献
[1] 张里斌,龚跃鹏,丁甜,等 . 基于专利视角的江苏省生物医药产业创新发展现状研究 [J]. 江苏科技信息,2024,41(13):38-43.
[2] 张佳睿,位治国 . 生物制药在农业领域中的应用回顾与展望 [J]. 乡村科技,2025,16(16):147-152.
[3] RASMUSSEN A S B, HAMMOUA,POULSEN T F,et al. Definition,categorization, and environmental riskassessment of biopharmaceuticals[J].Science of The Total Environment,2021,789:147884.
[4] 张晓申,张珍华,曹辉,等 . 转录因子 TCP 家族在金银花叶片和花中的鉴定及表达模式分析 [J/OL].北方园艺,1-11.
[5] 王皓南 . 人纤维蛋白原中蛋白组分研究 [D]. 湖北中医药大学,2022.
[6] 张剑涛,潘若文,张学成,等 . 不同静注人免疫球蛋白制备工艺杂质去除效果的对比研究 [J]. 中国输血杂志,2020,33(05):459-462.
[7] 张慧,沈才洪,曹晓念,等 . 富含黄酮类化合物的食药同源植物及其潜在应用进展 [J/OL]. 精细化工,1-15.
[8] 杨泽荣,刘淑琼,钟月彤,等 . 指纹图谱技术在生物样品内效应组分分析中的研究与应用进展 [J]. 药学学报,2025,60(09):2710-2723.
[9] 钟威豪,魏超,罗鸿峰,等 . 关于再造烟叶生产工艺的探讨 [J]. 中国食品工业,2025,(11):132-134.
[10] 王梓豪,闫军营,王报英,等 . 离子膜分离技术在过程工业减排和流程再造中的应用进展[J]. 中国科学:化学,2025,55(09):2782-2796.
[11] 李小莉 . 以大孔树脂 AB-8 解吸绿原酸、VB12 为例构建柱色谱数字孪生 [D]. 天津:天津中医药大学,2024.
[12] 陈东,王维兴,白海龙,等 . 硫氰酸红霉素精制母液回收工艺研究[J]. 化 工 管 理,2023,(25):117-119.
[13] 贾一博 . 论生物化工领域膜分离技术的创新应用方向 [C]// 江西省工程师联合会 . 工程技术与新能源经济学术研讨会论文集(一).2025:193-198.
[14] 李秋睿,康远航,张慧影,等 . 冻干甲型肝炎减毒活疫苗纯化工艺的优化 [J]. 中国生物制品学杂志,2025,38(09):1101-1104+1110.
[15] 张能 . 杏鲍茹中 SOD 的分离纯化、脂质体制备及其抑制肿瘤细胞活性研究 [D]. 杭州:浙江大学,2010.
[16] 郭园园,李慧婷,杨明,等 . 中药挥发油分离纯化技术的研究进展[J]. 中 草 药,2025,56(14):5311-5323.
[17] 艾文瑄,屈撑囤,周世俊 . 膜处理技术在油田水处理中的应用 [J].石 油 化 工 应 用,2025,44(08):6-12+32.
[18] 交叉融合引领创新,贯通产业链共谋未来——细胞与基因治疗多学科协同临床转化及产业发展大会暨 2025 年生物制药技术分会年会圆满落幕 [J]. 中国医药生物技术,2025,20(05):600.
邵丽竹
何发
相关推荐
-
炒莱菔子配方颗粒提取工艺优化
本研究旨在以炒莱菔子为原料,通过对比动态提取和多功能煎煮提取参数,确定最佳提取工艺,优化炒莱菔子配方颗粒提取工艺,提高产品质量、收率和生产效率。
2025-12-03 李彦飞 史修强 张强
-
特别专题 | 连续制造技术应用现状与挑战
随着连续制造技术在全球制药领域的深入应用,菲特(中国)制药科技有限公司能力中心技术经理朱正辉在接受本刊专访时,从技术优势、行业接受度、实施挑战及 FE CPS 系统创新等维度,深入解析了该技术为固体制剂生产带来的变革与未来前景。
2025-12-03 崔芳菲
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多