中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
药品包装作为保障药品质量与安全的重要屏障,其标准化与规范化程度直接影响药品的有效性和患者用药安全。中国药典 2025 年版对药品包装材料与容器的质量标准进行了全面升级,其中通则 9624“ 药品包装用塑料材料和容器指导原则”作为塑料类药包材的核心技术规范,为制药行业和药包材生产企业提供了科学、系统的质量控制标准。本文对药品包装用塑料材料和容器指导原则的框架体系及核心内容进行系统解析,为药品包装材料的生产、使用和质量控制提供参考依据。
药品包装作为保障药品质量与安全的重要屏障,其标准化与规范化程度直接影响药品的有效性和患者用药安全。中国国家药包材标准经历了国家标准和行业标准、国家药包材标准以及药典标准等不同发展阶段[1],中国药典 (以下简称 ChP)2025 年版 9624“药品包装用塑料材料和容器指导原则”(以下简称指导原则) 在国家药包材标准相关内容基础上,构建了系统、科学的药品包装用塑料材料和容器标准体系[2],其框架结构体现了从原材料控制到成品评价的全过程质量管理理念。深入解析这一框架体系及其核心内容,对于正确理解和实施指导原则具有重要意义。
指导原则的架构可分为适用范围界定、材料与组件基本要求、关键性能指标体系、特殊功能评价和检测方法规范 5 个主要部分,各部分相互关联,形成有机整体。本文系统梳理了 9624 指导原则的框架体系与核心内容,深入分析了其在材料控制、性能评价、功能验证等方面的技术革新,探讨了实施过程中可能面临的挑战与应对策略,并对未来发展方向进行了展望,旨在为药品包装行业的质量提升和技术进步提供参考[3]。
Part1 适用范围
本指导原则适用范围具有全面性和前瞻性,体现了科学监管与风险管理相结合的理念。明确规定其适用于“直接接触药品的塑料包装材料和容器 (含包装系统及组件) 的生产、使用和质量控制”。同时规定,“不与药品直接接触但提供额外保护的塑料组件可参照执行”,这意味着适用范围覆盖了从原材料供应商到制药企业的整个供应链,包括药包材的生产、药品包装过程以及最终产品的质量控制全流程。
Part2 材料与组件基本要求
2.1常用塑料材料
指导原则列举了常见药品包装用塑料材料,通用塑料:聚乙烯 (polyethylene,PE)、聚丙烯(polypropylene, PP)、 聚 对 苯 二 甲 酸 乙 二 醇 酯(polyethylene terephthalate,PET),其综合性能平衡,加工工艺成熟,成本相对较低,是应用最广泛 的 药 包 材 材 料 ; 工 程 塑 料 : 聚 碳 酸 酯(polycarbonate, PC)、 环 状 聚 烯 烃 (cyclic olefincopolymer/cyclic olefin polymer,COC/COP)、聚酰胺 (polyamide,PA),通常具有更优异的机械性能、耐热性能或特殊的阻隔性能,常用于对包装有更高要求的药品,如某些注射剂、高阻隔要求的口服制剂等[4-5];复合材料:共挤膜、多层复合结构 (如含铝箔的复合膜),通过将不同材料的优势相结合,实现单一材料无法达到的保护性能,以满足特殊药品的包装需求,如对氧气、水蒸气、光线极为敏感的药品[6-7]。
2.1.1注射液用塑料包装系统及组件
注射液用塑料包装系统及组件系指用于盛装注射液、注射用浓溶液等高风险制剂,以塑料粒料为主要原料 , 采 用 吹 塑 、 注 塑 或 吹 灌 封 (blow-fill-seal,BFS) 等工艺制成的包装系统,如塑料安瓿、塑料瓶、塑料袋及其配套的密封盖、接口等。材料需具备极高的化学惰性、生物安全性和机械性能,首 选 低 密 度 聚 乙 烯 (low-density polyethylene,LDPE)、PP 及其共混改性料,其中 PP 因其优异的耐热性可耐受湿热灭菌。对于透明度要求极高的特殊药品,也会采用 COC/COP,其具有高透明、低蛋白吸附和优良的阻隔性能。
2.1.2滴眼剂用塑料瓶系统及组件
滴眼剂用塑料瓶系统及组件系指以 LDPE 或 PP 为主要原料,通过挤出吹塑成型,用于盛装滴眼剂的塑料瓶系统。LDPE 因其柔韧性好、易于挤压出液而被广泛用于瓶身;而 PP 则因其刚性和优异的耐应力开裂性,常用于制造瓶盖、颈环等组件。
2.1.3外用软膏剂用塑料复合管系统及组件
用软膏剂用塑料复合管系统及组件系指管身为复合材料,管肩、管帽盖以 PP、PE 等为主要原料,用于盛装软膏剂、乳膏剂、凝胶剂的外用包装系统。管身通常采用多层共挤复合膜,典型结构如PP/粘合剂/铝箔/粘合剂/PP(或 PE),利用铝箔的高阻隔性防止药物成分挥发、氧化或光解。PE 或PP 内层则提供了良好的内容物相容性和热封性能。
2.1.4外用液体药用塑料瓶系统及组件
外用液体 药 用 塑 料 瓶 系 统 及 组 件 系 指 以 PET、 PE(LDPE 仅适用于特殊药品)、PP 等为主要原料制成的瓶体,配合 PE/PP 瓶盖,用于包装搽剂、涂膜剂等外用液体制剂的塑料包装系统。PET 因其优异的透明度、刚度和对多种化学物质的耐受性而被广泛应用;PE 和 PP 则提供了良好的耐冲击性和化学稳定性。
2.1.5口服液体药用塑料瓶系统及组件
口服液体药用塑料瓶系统及组件系指以 PET、高密度聚乙烯 (high-density polyethylene,HDPE)、PP 等为主要原料,用于包装多剂量口服溶液、混悬液等液体制剂的塑料瓶系统。HDPE 和 PP 具有成本低、耐冲击、阻湿性好的特点,是糖浆等制剂的常用包装。PET 则因其高透明、高强度和良好的阻隔性,更常用于需高档次外观或对氧气敏感的口服液。
2.1.6口服固体药用塑料瓶系统及组件
口服固体药用塑料瓶系统及组件系指以 HDPE、PP、PET 等为主要原料,用于包装片剂、胶囊等多剂量口服固体制剂的塑料瓶系统。HDPE 和 PP 是主流材料,它们能提供良好的防潮性能、足够的刚度和经济性。系统设计的核心在于防潮和防止儿童开启。瓶盖常设计有热封封口垫片 (铝塑复合膜) 或内置干燥剂仓,需严格控制其热合强度、开启力及干燥剂的吸湿率。对于不同瓶盖组合方式(如螺旋式、揿压式) 及其附加功能 (如防篡改、防儿童开启) 需进行专项考察。PET 材质的瓶子还需控制乙醛残留,以避免对药品气味产生影响。
2.1.7口服固体药用复合膜及袋
口服固体药用复合膜及袋系指由不同基材 (PP、PE、PET、镀铝膜、铝箔、纸等) 与油墨、胶黏剂通过干式或无溶剂复合工艺制成,厚度一般≤0.25 mm,再经热合制袋用于包装口服固体制剂的包装形式。
2.1.8口服固体药用硬片
口服固体药用硬片系指用于口服固体制剂泡罩包装的硬片,根据泡罩成 型 工 艺 可 分 为 热 成 型 硬 片 和 冷 成 型 硬 片(铝 塑 )。 热 成 型 硬 片 常 用 材 质 包 括 聚 氯 乙 烯(polyvinyl chloride, PVC)、 聚 三 氟 氯 乙 烯(polychlorotrifluoroethylene,PCTFE) 以及聚偏二氯乙烯 (polyvinylidene chloride,PVDC) 等,或它们的复合材料。
2.2材料安全性
塑料包装材料不得影响药品质量,需评估添加剂、单体残留、元素杂质及可提取物等风险[8-9]。材料安全性的全面提升是本次指导原则修订的核心内容之一,指导原则对塑料原材料中的潜在风险物质管控更加严格。在材料选择上,指导原则明确推荐使用惰性材料,如 HDPE、PP 等迁移风险较低的材料,对于可能影响药品稳定性的材料 (如某些含酯基聚合物) 则限制使用。这就要求药包材生产企业需要重新评估现有配方,优化材料选择,确保符合新的安全标准[10]。
2.3包装系统与药品相容性
指导原则不再满足于简单的溶出物测试,而是建立了系统的可提取物与可浸出物 (extractables and leachables,E&L) 研究框架,药品包装用材料应避免吸附、迁移或化学反应。药品生产企业须根据药品特性、包装材料和临床使用条件,设计科学的提取研究方案,全面识别潜在的浸出物风险。提取条件应采用最差情况原则 (最严苛的条件),考虑温度、时间、溶剂极性等因素的放大效应[11]。对于高风险制剂,还需进行实际的浸出物研究,监测药品在整个货架期内可能引入的包装相关杂质。这种基于风险的分层研究策略,既保证了评估的全面性,又避免了不必要的测试负担。
2.4全生命周期管理
基于风险管理理念,从原材料选择到产品使用全过程控制质量。药品包装用塑料材料和容器的全生命周期风险管理是基于 ICH Q9 原则构建的系统化质量保障体系[12],其核心在于通过前瞻性风险识别和控制,确保包装系统从设计到废弃全过程的安全性和功能性。
Part3 关键性能指标体系
3.1原材料控制
3.1.1聚合物纯度
聚合物纯度是药品包装材料安全性的基石,必须提供符合全球药用级标准的树脂 (如 PE、PP、PET 等)。严格控制低聚物、催化剂残留等杂质,是因为这些物质在药品储存过程中可能迁移至药液中,引发药品变色、沉淀或效价降低,甚至产生不良反应 (如催化剂残留铝、钛可能导致神经毒性或细胞损伤)。控制原则基于全生命周期管理和风险溯源,要求遵循美国药典(United States Pharmacopeia,USP)<661>、欧洲药典 (European Pharmacopoeia,EP) 3.1 章等国际规范[13-16],通过聚合工艺优化和洁净化生产确保树脂窄分布、低迁移特性,从而满足高风险制剂 (如输液瓶) 的生物学安全性要求。
3.1.2添加剂
添加剂 (抗氧化剂、增塑剂、着色剂等) 的限制需严格符合 ChP、国际人用药品注册技 术 协 调 会 (The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH) Q3D 元素杂质限度及美国食品药品监督管理局 (Food and Drug Administration, FDA) 21 CFR 174-186 的阈值原则[17-22]。控制原因在于添加剂可能通过迁移引入遗传毒性杂质 (如亚磷酸酯类抗氧剂分解产物) 或元素杂质 (如镉、铅等),直接影响药品安全性和患者健康。控制原则强调全球协调一致性:优先选择列入 FDA、欧洲食品安全局 (European Food Safety Authority,EFSA) 正面清单的品种[18-25],并提 供 毒 理 学 数 据 支 持 [ 如 每 日 允 许 暴 露 量(permissible daily exposure,PDE) 计算和 ICH M7遗传毒性评估 ][26],同时要求供应商提供全成分披露和符合性声明,确保添加剂用量低于毒理学关注阈值。
3.1.3单体残留
单体残留指高分子聚合物原材料或生产工艺造成的残留单体 (如 PET 材料中的乙醛、PVC 材料中的氯乙烯等)。残留单体不仅影响药品稳定性 (如乙醛导致药液 pH 变化),还具有强致癌性 (如氯乙烯为Ⅰ类致癌物),其控制需通过HS-GC、GC-MS 等灵敏方法严格检测 (参照通则4208、4210)。
3.1.4元素杂质
元素杂质有多种来源,生产过程中使用的原料、生产设备等均可能引入;此外,在储存过程中,包装材料中的元素杂质也可能发生迁移而被引入药品中。这些有意添加或无意引入的元素杂质 (铅、镉、砷等),其评估需根据通则 0862 和 ICH Q3D[17],尤其关注注射剂包装 (通则 4214)。这些元素杂质具有累积毒性和器官损伤风险 (如砷致癌、铅神经毒性),且注射剂直接进入血液循环,暴露风险最高。控制原则遵循来源控制与加和性评估,要求原生料生产 (禁止使用回收料),并对包装系统所有组件 (瓶盖、油墨等) 进行加和评估。对于持续符合 USP<661>标准的材料[13-15],可申请检测豁免 (迁移量低于 PDE30%),但需提供供应链质量协议。
3.1.5溶剂残留
药品中的残留溶剂系指在原料药、辅料或制剂生产过程中使用或产生的,并在实际工艺过程中不能完全除去的有机挥发性化合物。苯类溶剂 (苯、甲苯等) 因其具有强遗传毒性和致癌性,且易通过吸入或皮肤吸收造成暴露风险,已被严禁使用。控制原则采用 ICH Q3C 分类管理[27]:一类溶剂 (苯等) 严禁使用;二类溶剂 (甲苯、二甲苯) 限制至 PDE 以下;三类溶剂 (乙酸乙酯、丙酮) 残留总量需≤0.5%(对应 PDE≤0.5%)。复合材料 (黏合剂、油墨等) 的溶剂残留 (如乙酸乙酯、丙酮) 需通过 HS/GC 检测,复合层和印刷界面可能成为迁移源,导致溶剂渗透至药品中 (如乙酸乙酯引起药液异味或变质),残留总量≤5.0 mg·m−2(苯类溶剂不得检出)[28]。
3.2生产工艺控制
3.2.1BFS
BFS 技术是指通过一体化设备将塑料粒料加热挤出、吹塑成型、药品灌装及容器封口的自动化生产技术,主要用于注射剂、吸入制剂、滴眼剂、冲洗剂包装系统的制造[29]。它通过将塑料容器的成型、灌装与密封 3 大工序整合至单一设备中,并在无菌环境下流畅完成,显著提升了药品的无菌保障水平。该技术的核心优势在于其独特且高效的无菌生产流程。在 BFS 一体化无菌生产工艺中,塑料粒料的熔融指数和热稳定性等流变学参数须与设备挤出温度、螺杆转速及模具设计高度匹配,以避免聚合物热氧化降解产生醛类、酮类等迁移物,确保药液稳定性和安全性。
3.2.2复合材料工艺
复合材料工艺是药品包装领域的关键技术,通过将不同性能的材料 (如塑料、铝箔、纸张) 进行干式复合、无溶剂复合、共挤复合等工艺,将 2 层或多层基材 (如双向拉伸聚丙烯、PET、铝箔、PE 等) 结合成一个整体的加工过程。其根本目的是满足药品对光线、氧气、水蒸气的苛刻阻隔要求,并确保包装的机械性能和稳定性。
3.3功能性要求
药品包装系统的功能性要求是其设计的核心,直接关系到药品在有效期内的质量、安全性和有效性[25]。指导原则、USP<661>、USP<671>以及EP 3.2 章节均对此类性能有系统性要求[13-15,30-32]。这些要求并非孤立存在,而是基于药品的剂型特性、给药途径、处方组成及储存运输条件,通过风险评估后确定的关键质量属性。一个合格的药品包装必须在整个生命周期内,始终保持其保护功能,防止因外界环境因素 (如光线、氧气、水蒸气) 或机械外力导致的药品失效、变质或污染。因此,对阻隔性能、密封性和机械性能的考察,构成了包装功能性评价的 3 大支柱。
3.3.1阻隔性能
阻隔性能是药用包装,尤其是塑料和复合材料包装最重要的功能之一,旨在隔绝环境中的水蒸气、氧气、二氧化碳等气体以及光线[33-35],以维持药品的化学和物理稳定性。USP<661>和 EP 3.2 均 对 包 装 材 料 的 阻 透 性 有 明 确规定,其测试方法与 ChP 通则相互补充和印证。
3.3.2密封性
包装密封性的完好是维持其阻隔功能和无菌屏障作用的根本前提[36-37]。密封不良会导致药品受潮、氧化、泄漏甚至微生物污染,后果严重。密封性测试分为静态和动态 2 大类。静态密封测试:通常在出厂检验时进行,用于检测包装是否存在先天性的密封缺陷。ChP 收载了负压法 (真空泄漏法) 和染色渗透法[38]。负压法适用于瓶、袋、安瓿等,通过观察在负压环境下是否产生连续气泡来判断泄漏;染色渗透法则将包装浸入有色液体中,施加负压后观察有色液体是否渗入内部,适用于软袋、瓶等。USP<1207>系列[39-42] 通则对包装完整性测试有更为详尽的指导,提供了多种确定性测试方法和概率性测试方法的比较与选择依据。动态密封验证:药品在运输、仓储过程中会经历振动、撞击、温度波动等应力,可能对密封处造成累积性损伤。因此,动态测试更能模拟真实风险。通常参考 ASTM D3078(软包装气泡法泄漏测试) 等标准方法[43],在模拟运输振动、高低温循环试验后,再次检测其泄漏率。这种验证方式对于大输液软袋、无菌粉针瓶等尤为重要。对于特殊剂型要求,如多剂量滴眼剂瓶,其密封性挑战在于,需在多次开启和关闭后仍能有效防止内容物污染和蒸发。除初始密封性外,必须验证多次使用后的密封保持性,模拟患者使用习惯进行按压开启次数测试,并评估其密封力衰减情况和微生物挑战性。
3.3.3机械性能
机械性能确保包装在生产、运输、储存和使用过程中能够承受外力,保持物理形态完整,防止因破损导致药品失效或使用障碍[44-45]。抗跌落性主要针对口服液体制剂瓶、固体塑料瓶等硬质包装,参考 ChP 通则 4025(抗跌落测定法),要求容器从一定高度 (如 1.2 m,代表货架高度或意外跌落高度) 以特定姿态 (通常为瓶底朝下、瓶身平躺、瓶肩朝下) 自由跌落到硬质地面(如大理石或钢板) 上数次 (如 3 次) 后,无破裂、无泄漏,且瓶盖无松脱。
3.4风险管理的延伸控制
E&L 研究是药品包装材料安全性评价的核心环节,尤其针对高风险制剂 (如注射剂、吸入剂、生物制品等)。根据指导原则及 USP<1664>系列标准[46],E&L 研究须基于风险分级策略和最差条件原则设计提取实验。提取条件需模拟极端环境 (如高温、强酸/碱、高极性溶剂),以加速材料中潜在可迁移物质的溶出,计算分析评估阈值,并采用LC-MS/MS、GC-MS 等高灵敏度技术鉴定未知物。可提取物研究需覆盖材料中的所有组分 (如单体、抗氧化剂、塑化剂、催化剂残留),并通过毒理学风险评估 (toxicological risk assessment,TRA)判 定 其 安 全 性 阈 值 (如 特 定 化 学 物 质 阈 值 ≤1.5 μg·d–1)。浸出物研究则需在真实药品稳定性考察条件下进行,监测实际迁移至药品中的物质,尤其关注有机浸出物 (如邻苯二甲酸酯类) 和无机元素杂质[47-52]。
生命周期稳定性考察 (稳定性考察),是确保其在整个有效期内功能性与安全性的关键。指导原则及 ICH Q1A(R2) 要求采用加速老化试验 (如(40±2)℃/(75±5)% RH,6 个月) 模拟长期储存条件,预测材料在应力环境下的性能变化 (如机械强度衰减、阻隔性能下降、迁移物增加等)。具体要求包括:材料自身稳定性,塑料需评估氧化诱导期、分子量分布变化及添加剂迁移趋势,复合材料需监测层间剥离强度及热合强度;实时老化验证,通过实际储存条件 [ 如 (25±2)℃、(60±5)% RH]下长达 36 个月的长期数据,验证加速老化模型的可靠性,并支持有效期延长[11];功能性持续监测,针对特殊剂型包装 (如多剂量滴眼剂瓶、输液袋),需考察多次开启后的密封保持性、悬挂力学性能及穿刺落屑稳定性 (通则 4206)。
Part4 特殊功能评价
4.1特殊剂型专项要求
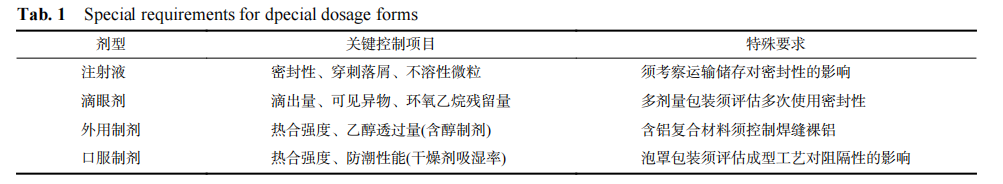
指导原则根据不同剂型的给药途径、使用特性及潜在风险,为其量身定制了关键质量属性和控制策略,项目见表 1。对于注射液这类高风险制剂,其要求远超常规,聚焦在使用环节的安全性,将“密封性”(包括动态运输后的完整性)、“穿刺落屑”和“不溶性微粒”列为生命线,严防微生物污染和微粒的侵入[53]。对于滴眼剂,则重点关注给药剂量准确性与眼部刺激风险,控制“滴出量”和“可见异物”,并对多剂量包装提出“多次使用密封性”的苛刻要求,以防开封后污染。对于外用软膏剂 (尤其是含醇配方),其控制重点在于包装本身的结构完整性 (热合强度) 和阻隔性能 (乙醇透过量),并对含铝复合材料提出了“控制焊缝裸铝”的独特要求,防止内容物腐蚀和泄漏。而对于口服固体制剂,核心是保障在整个有效期内免受环境因素 (尤其是湿度) 影响,因此“热合强度”和“防潮性能”(如干燥剂吸湿率) 是重中之重,同时敏锐地指出泡罩包装的“成型工艺”会改变材料特性,从而影响最终产品的阻隔性能,必须进行前瞻性评估。该指导原则通过这种精细化、差异化的规定,构建了一个多层级的科学防御体系,确保从注射到口服,每一种剂型都能得到其所需级别的保护,最终守护患者的用药安全。
表 1 特殊剂型专项要求
4.21创新技术与特殊考量
指导原则在创新技术与特殊考量方面强调了多项前沿包装技术及其风险管控要求。BFS 技术作为无菌制剂生产的先进工艺,可最大限度减少人为和环境干预,有效控制微生物和微粒污染。功能性包装组件涵盖防篡改设计 (如儿童安全瓶盖)、智能包装 (如集成近场通信芯片和篡改证据密封以实现真伪验证和供应链追溯),以及环保型可降解材料 (如二氧化碳基塑料、聚乳酸等),但这些新材料必须通过系统的生物学安全评价 (包括急性毒性、致突变性、遗传毒性试验) 和可提取物/浸出物研究,以验证其安全性。在风险管理上,要求根据制剂特定性质 (如乙醇含量、光敏感性) 定制检测方案,并对复杂包装系统 (如多腔室输液袋) 增加腔室间隔离性能 (如分腔密封性) 的评价,构建全生命周期的质量管控体系[53-56]。
Part5 检测方法规范
5.1理化性能检测
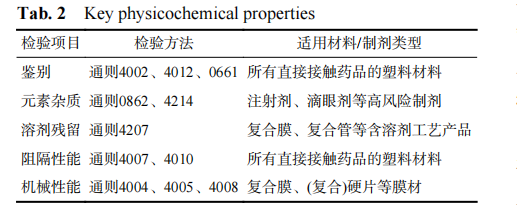
指导原则对药品包装用塑料材料和容器的理化性能检测建立了系统化、基于风险的控制策略。其核心在于根据不同材料的特性、生产工艺及所包装药品的剂型风险,实施差异化且具针对性的检测,关键理化性能项目见表 2。如指导原则所示,针对高风险制剂 (如注射剂、滴眼剂),必须严格进行溶出物试验 (通则 4204),以评估可提取物对药品安全性的潜在影响;对所有直接接触药品的材料,均需依据通则 0862 和 4214 评估元素杂质,控制其毒理学风险;对于采用复合工艺的产品,溶剂残留 (通则 4207) 是强制性的关键监控指标,严禁苯类溶剂的使用;而阻隔性能 (通则4007、4010) 的考察则直接关系到药品的稳定性,需根据药品对水蒸气、氧气的敏感程度量身定制检测方案。这套检测体系体现了从“通用型”向“精准化”的转变,确保了包装材料与药品的相容性,最终为药品的全生命周期安全提供了坚实保障。
表 2 关键理化性能项目
5.2生物学评价
生物学评价是确保药品包装材料安全性的核心环节,其要求已与国际标准全面接轨。指导原则明确规定,所有直接或间接接触药品的塑料材料都必须进行系统的生物学评价,其核心是依据ISO 10993 系列标准 (医疗器械的生物学评价) 进行[57-67]。评价起始于材料的化学成分和接触性质(如接触时间、体液类型),据此选择必要的测试项目[47]。基础评价至少包括细胞毒性、致敏性和刺激试验,这些是材料生物安全性的底线要求。对于高风险制剂 (如注射剂、吸入制剂、眼用制剂及生物制品),指导原则要求必须进行全面且深入的化学表征与 E&L 研究。可提取物研究是在加速条件下 (如极端溶剂、高温) 对材料进行测试,识别所有可能溶出的化合物,并建立其“化学指纹图谱”。浸出物研究则是在真实的药品稳定性考察条件下,检测实际迁移到药品中的物质及其含量。这些化学数据必须通过 TRA 来判定其安全性阈值,确保即使微量的浸出物也不会对患者产生不良反应[50-51]。整个生物学评价过程强调生命周期管理,任何原材料、配方或工艺的变更都可能触发重新评价的必要性。
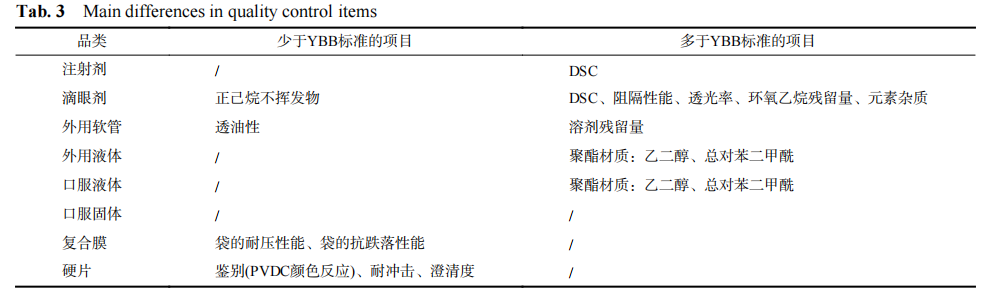
5.3质控项目的主要差异
与国家药包材标准 (简称 YBB 标准) 中相关塑料类药包材相比,指导原则质控项目的主要差异见表 3。
表 3 质控项目的主要差异
Part6 结论与展望
ChP 2025“药品包装用塑料材料和容器指导原则”是中国药品包装领域的重要技术规范,其发布实施是中国药品包装标准化进程中的重要里程碑,对保障药品质量安全、促进行业技术进步、提升监管效能具有重要意义[68-69]。其重要性和实用性体现在 3 个方面:首先,通过系统化的标准体系 (如材料选择、性能测试、功能验证等) 提升了药品包装的质量可控性,确保包装材料与药品的相容性、阻隔性和安全性符合国际先进水平;其次,指导原则强化了风险管控理念,要求企业基于质量源于设计 (quality by design,QbD)原则建立全生命周期质量管理体系,从原材料筛选到生产工艺、检测方法均需科学验证,减少药品因包装问题导致的质量风险;最后,该标准为药品包装的关联审评提供了技术依据,推动行业从经验型管理向数据驱动型管理转变。
未来的药品包装评价不再局限于出厂时的性能检测,而是涵盖从原材料获取到废弃处理的完整生命周期[29-32]。包装的长期稳定性和使用可靠性将受到更多关注,指导原则可能会引入更系统的老化评价要求,推动行业开发更加稳定、耐用的包装方案。企业需要建立长期性能数据库,积累不同材料和设计在各种条件下的老化数据,为产品开发和质量控制提供支持。指导原则已借鉴了USP、EP 等国际标准的有益经验,未来将进一步推动标准互认和技术协调,在 ICH 的框架下,药品包装标准的国际协调工作将逐步展开,这有助于减少国际贸易中的技术壁垒。中国药包材行业应积极参与国际标准制定,将中国的技术要求和实践经验转化为国际共识,提升在全球标准体系中的话语权。
参考文献
[1]王丹丹, 金宏, 蔡荣, 等. 中国国家药包材标准体系的沿革与启示[J]. 医药导报, 2023, 42(8): 1123-1129. WANG D D, JIN H, CAI R, et al. Evolution and enlightenment of the Chinese national standards system for pharmaceutical packaging materials[J]. Her Med, 2023, 42(8): 1123-1129.
[2]陈蕾, 康笑博, 宋宗华, 等. 中国药典 2020 年版第四部药用辅料和药包材标准体系概述[J]. 中国药品标准, 2020, 21(4): 307-312. CHEN L, KANG X B, SONG Z H, et al. Standard system of the pharmaceutical excipients and packaging materials in the Chinese pharmacopoeia 2020[J]. Drug Stand China, 2020, 21(4): 307-312.
[3]陆维怡, 吕杨格格, 姚琳, 等. 2025 年版《中华人民共和国药典》药品包装用塑料材料和容器指导原则解读[J]. 医药导报, 2025, 44(7): 1049-1054. LU W Y, LYU Y G G, YAO L, et al. Interpretation of the guideline for plastic materials and containers for pharmaceutical packaging in the 2025 edition of the pharmacopoeia of the people’s republic of China[J]. Her Med, 2025, 44(7): 1049-1054.
[4]孟坤, 许江菱, 刘朝艳, 等. 2023—2024 年世界塑料工业进展(Ⅱ): 工程塑料和特种工程塑料[J]. 塑料工业, 2025, 53(4): 1- 13, 96. MENG K, XU J L, LIU C Y, et al. Progress of the world’s plastics industry in 20232024(Ⅱ): Engineering plastics and special engineering plastics[J]. China Plast Ind, 2025, 53(4): 1- 13, 96.
[5]许江菱, 孟坤, 唐茂株, 等. 2023—2024 年世界塑料工业进展 (I): 通用塑料[J]. 塑料工业, 2025, 53(3): 10-24. XU J L, MENG K, TANG M Z, et al. Progress of the world’s plastics industry in 2023-2024(I): General purposed plastics[J]. China Plast Ind, 2025, 53(3): 10-24.
[6]许凯, 陈蕾, 俞辉, 等. 2025 年版中国药典药包材通用要求指导原则解析[J]. 中国药品标准, 2025, 26(4): 349-354. XU K, CHEN L, YU H, et al. Analysis of guideline for general requirements for pharmaceutical packaging materials and containers in the Chinese Pharmacopoeia 2025 Edition[J]. Drug Stand China, 2025, 26(4): 349-354.
[7]徐春燕, 孙宾, 李文伶, 等. PVC/PVDC 固体药用复合硬片与肾衰宁胶囊的相容性[J]. 中成药, 2020, 42(7): 1878-1880.
[8]刘璐, 孙会利. 食品包装用塑料材料的安全性探析[J]. 中国包装工业, 2013(8): 8, 12.
[9]王铮. 药品包装材料相容性对药品质量影响的研究与评价[J]. 实验室检测, 2025(12): 230-232.
[10]朱嘉亮, 庄珊珊, 陆爽, 等. 国家药品抽检滴眼剂质量状况研究[J]. 中国现代应用药学, 2024, 41(23): 3408-3414. ZHU J L, ZHUANG S S, LU S, et al. Quality research on eye drops for national drug sampling inspection[J]. Chin J Mod Appl Pharm, 2024, 41(23): 3408-3414.
[11]李文丽, 张静, 刘莉莉, 等. 塑料和橡胶类药包材自身稳定性研究技术要点解析[J]. 医药导报, 2024, 43(11): 750-1753. LI W L, ZHANG J, LIU L L, et al. Technical points analysis of self-stability study on plastic and rubber pharmaceutical packaging[J]. Her Med, 2024, 43(11): 1750-1753.
[12]ICH. ICH Q9(R1): Quality Risk Management[S]. Geneva: ICH, 2023.
[13]USP. USP<661>: Plastic Packaging Systems and Their Materials of Construction[S]. Rockville: United States Pharmacopeia, 2023.
[14]USP. USP<661.1>: Polyethylene Materials of Construction[S]. Rockville: United States Pharmacopeia, 2023.
[15]USP. USP<661.2>: Polypropylene Materials of Construction[S]. Rockville: United States Pharmacopeia, 2023.
[16]EP. EP 3.1: Materials Used for the Manufacture of Containers(Polyethylene)[S]. Strasbourg: European Pharmacopoeia, 2022.
[17]ICH. ICH Q3D(R2): Guideline for Elemental Impurities[S].Geneva: ICH, 2022.
[18]FDA. 21 CFR Parts 174-186: Indirect Food Additives: Adjuvants, Production Aids, and Sanitizers[S]. Silver Spring: FDA, 2023.
[19] FDA. 21 CFR Part 170-190. Food Additives, Indirect Food Additives: Food Contact Substances[S]. Silver Spring: FDA, 2023.
[20]FDA. Guidance for Industry: Preparation of Premarket Submissions for Food Contact Substances: Chemistry Recommendations[G]. Silver Spring: FDA, 2007.
[21]FDA. Guidance for Industry: Use of Recycled Plastics in Food Packaging(Chemistry Considerations)[G]. Silver Spring: FDA, 2006.
[22]FDA. Inventory of Effective Food Contact Substance(FCS) Notifications[EB/OL]. Silver Spring: FDA, 2023.
[23]European Commission. Commission Regulation(EU) No 10/2011 of 14 January 2011 on plastic materials and articles intended to come into contact with food[S]. Brussels: European Union, 2011.
[24]EFSA. Scientific opinion on the criteria to be used for safety evaluation of a mechanical recycling process to produce recycled PET intended for food contact applications[J]. EFSA Journal, 2011, 9(7): 2184.
[25]EFSA. Guidance on the data required for the risk assessment of substance migration from food contact materials[J]. EFSA Journal, 2021, 19(11): 6889.
[26]ICH. ICH M7(R2): Assessment and Control of DNA Reactive(Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk[S]. Geneva: ICH, 2022.
[27]ICH. ICH Q3C(R8): Impurities: Guideline for Residual Solvents[S]. Geneva: ICH, 2023.
[28]中国食品药品检定研究院. 国家药包材标准[M]. 北京: 中国医药科技出版社, 2015.
[29]韩小旭, 贾菲菲, 杨梦雨, 等. 吹灌封技术在制药行业的监管现状及发展前景[J]. 医药导报, 2025, 44(7): 1079-1082.HAN X X, JIA F F, YANG M Y, et al. Current regulatory status and development prospects of the blow-fill-seal(BFS) technology in the pharmaceutical industry[J]. Her Med, 2025, 44(7): 1079-1082.
[30]EP. EP 3.2: Containers Made of Thermoplastic Materials[S]. Strasbourg: European Pharmacopoeia, 2022.
[31]EP. EP 3.2.2.1: Plastic Containers and Closures for Parenteral Preparations[S]. Strasbourg: European Pharmacopoeia, 2022.
[32]USP. USP<671>: Containers—Performance Testing[S]. Rockville: United States Pharmacopeia, 2023.
[33]冯靖, 张文华, 刘言. 药包材水蒸气透过量测定方法的标准现状及展望[J]. 天津药学, 2023, 35(4): 58-63. FENG J, ZHANG W H, LIU Y. Current status and prospect of standards for the determination of water vapor ransmission rate of pharmaceutical packaging materials[J]. Tianjin Pharm, 2023, 35(4): 58-63.
[34]周亚菊, 姜骏, 朱燕, 等. 药包材气体透过量测定方法标准现状及展望[J]. 中国药品标准, 2022, 23(1): 1-4. ZHOU Y J, JIANG J, ZHU Y, et al. Current status and prospect of standards for the determination of gas permeance of pharmaceutical packaging materials[J]. Drug Stand China, 2022, 23(1): 1-4.
[35] 吕杨格格, 陆维怡, 陈蕾. 2025 年版《中华人民共和国药典》口服液体药用塑料瓶系统及组件质量控制要点解析[J]. 医药导报, 2025, 44(7): 1045-1049. LYU Y G G, LU W Y, CHEN L. Analysis of quality control points of oral liquid pharmaceutical plastic bottle system and components in the 2025 Edition of the Pharmacopoeia of the People’s Republic of China[J]. Her Med, 2025, 44(7): 1045- 1049.
[36]汤云, 许珍煕, 陆维怡. 2025 年版《中华人民共和国药典》外用软膏剂用塑料复合管系统及组件标准解读[J]. 医药导报, 2025, 44(7): 1073-1078. TANG Y, XU Z X, LU W Y. Interpretation of the standards for plastic composite tube system and components for external ointment in the pharmacopoeia of the People’s Republic of China(2025 Edition)[J]. Her Med, 2025, 44(7): 1073-1078.
[37]沈永, 薄晓文, 刘雪婷, 等. 2025 年版《中华人民共和国药典》滴眼剂用塑料瓶系统及组件标准解读[J]. 医药导报, 2025, 44(7): 1040-1044. SHEN Y, BO X W, LIU X T, et al. Interpretation of the standard for plastic bottle systems and components for eye drops in the 2025 Edition of the Pharmacopoeia of the People’s Republic of China[J]. Her Med, 2025, 44(7): 1040-1044.
[38]王悦雯, 刘言. 塑料包装材料与药用注射剂的相容性研究进展[J]. 天津药学, 2023, 35(1): 66-71.
[39]USP. USP<1207>: Package Integrity Evaluation—Sterile Products[S]. Rockville: United States Pharmacopeia, 2023.
[40]USP. USP<1207.1>: Product Package Integrity Testing: Deterministic Methods[S]. Rockville: United States Pharmacopeia, 2023.
[41]USP. USP<1207.2>: Product Package Integrity Testing: Probabilistic Methods[S]. Rockville: United States Pharmacopeia, 2023.
[42]USP. USP<1207.3>: Package Seal Quality Test Methods for Porous Barrier Packages[S]. Rockville: United States Pharmacopeia, 2023.
[43]ASTM. ASTM D3078: Standard Test Method for Determination of Leaks in Flexible Packaging by Bubble Emission[S]. West Conshohocken: ASTM International, 2022.
[44]常亮, 汪元亮, 熊马剑, 等. 2025 年版《中华人民共和国药典》药用复合膜及袋相关内容解析[J]. 医药导报, 2025, 44(7): 1061-1065. CHANG L, WANG Y L, XIONG M J, et al. Analysis of the content related to the medicinal composite films and bags in the 2025 Edition of the Pharmacopoeia of the People’s Republic of China[J]. Her Med, 2025, 44(7): 1061-1065.
[45]于晓慧, 熊巍, 刘斌, 等. 2025 年版《中华人民共和国药典》口服固体药用硬片关键质量控制项目及测试要点[J]. 医药导报, 2025, 44(7): 1065-1069. YU X H, XIONG W, LIU B, et al. Key quality control items and testing points of sheet for oral solid preparation in the 2025 Edition of the Pharmacopoeia of the People’s Republic of China[J]. Her Med, 2025, 44(7): 1065-1069.
[46]USP. USP<1664>: Assessment of Drug Product Leachables Associated with Pharmaceutical Packaging/Delivery Systems[S]. Rockville: United States Pharmacopeia, 2023.
[47]周雅欣, 丁浩, 王敏, 等. 现行法规下化学药品稳定性研究与有效期管理分析[J]. 中国医药导刊, 2025, 27(3): 301-307. ZHOU Y X, DING H, WANG M, et al. Analysis of stability studies and expiration date management of chemical medicines under current regulations[J]. Chin J Med Guide, 2025, 27(3): 301-307.
[48]王粟明, 宋郁, 陈蕾. 基于 ICH 指导原则的药用辅料元素杂质风险管理与评估[J]. 药学进展, 2025, 49(2): 91-99. WANG S M, SONG Y, CHEN L. Risk management and assessment of elemental impurities for pharmaceutical excipients based on ICH guidelines[J]. Prog Pharm Sci, 2025, 49(2): 91-99.
[49]丁豪, 张芳芳, 陈蕾. 2025 年版《中华人民共和国药典》药 品包装用金属材料和容器质量控制与应用分析[J/OL]. 医药导报, 2025: 1-13.(2025-07-22). https://kns.cnki.net/KCMS/ detail/detail.aspx?filename=YYDB2025072200M&dbname=CJFD&dbcode=CJFQ.
[50]刘成虎, 施燕平, 孙晓霞, 等. 药品包装生物学评价进展[J]. 药物分析杂志, 2022, 42(11): 1877-1883. LIU C H, SHI Y P, SUN X X, et al. Progress in biological evaluation for pharmaceutical packaging[J]. Chin J Pharm Anal, 2022, 42(11): 1877-1883.
[51]杨敏, 曾涛, 黄成超, 等. 输液药包材的急性全身毒性检查法和细胞毒性检查法测试结果的分析与探讨[J]. 中国医药工业杂志, 2024, 55(11): 1578-1582. YANG M, ZENG T, HUANG C C, et al. Analysis and discussion on the results of acute systemic toxicity test and cytotoxicity test for infusion pharmaceutical packaging materials[J]. Chin J Pharm, 2024, 55(11): 1578-1582.
[52]张文华, 吉丽娜, 冯靖, 等. 药包材相容性研究中邻苯二甲酸酯类增塑剂的安全性评估[J]. 中国药学杂志, 2023, 8(6): 533-536. ZHANG W H, JI L N, FENG J, et al. Assessing safety of phthalate in the compatibility study between pharmaceutical packing materials and drugs[J]. Chin Pharm J, 2023, 58(6): 533-536.
[53]陈蕾, 俞辉, 王彦, 等. 2025 年版中国药典药包材标准体系概述[J]. 中国药品标准, 2025, 26(1): 67-76. CHEN L, YU H, WANG Y, et al. The introduction on standards system of the pharmaceutical packaging materials in the Chinese Pharmacopoeia 2025 Edition[J]. Drug Stand China, 2025, 26(1): 67-76.
[54]周亚菊, 徐俊, 杨美成. 新形势下药包材质量控制现状及监管对策思考[J]. 中国现代应用药学, 2025, 42(7): 1188-1194. ZHOU Y J, XU J, YANG M C. Investigation and analysis of the current situation of pharmaceutical packaging material and regulatory countermeasures under the new situation[J]. Chin J Mod Appl Pharm, 2025, 42(7): 1188-1194.
[55]林黄静, 田绍琼, 梅蕾, 等. 药品包装材料的研究进展[J]. 中国医药工业杂志, 2023, 54(3): 339-346. LIN H J, TIAN S Q, MEI L, et al. Research progress of pharmaceutical packaging materials[J]. Chin J Pharm, 2023, 54(3): 339-346.
[56]康可欣, 李莎, 韩祥东, 等. 我国药品包装材料的应用现状及发展方向[J]. 医药导报, 2024, 43(5): 722-726. KANG K X, LI S, HAN X D, et al. Current application situation and development direction of pharmaceutical packaging materials in China[J]. Her Med, 2024, 43(5): 722- 726.
[57]ISO. ISO 10993-1: 2018. Biological evaluation of medical devices—Part 1: Evaluation and testing within a risk management process[S]. Geneva: ISO, 2018.
[58]ISO. ISO 10993-3: 2014. Biological evaluation of medical devices—Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity[S]. Geneva: ISO, 2014. [58]
[59]ISO. ISO 10993-5: 2009. Biological evaluation of medical devices—Part 5: Tests for in vitro cytotoxicity[S]. Geneva: ISO, 2009.
[60]ISO. ISO 10993-6: 2016. Biological evaluation of medical devices—Part 6: Tests for local effects after implantation[S]. Geneva: ISO, 2016.
[61]ISO. ISO 10993-10: 2021. Biological evaluation of medical devices—Part 10: Tests for skin sensitization[S]. Geneva: ISO, 2021.
[62]ISO. ISO 10993-11: 2017. Biological evaluation of medical devices—Part 11: Tests for systemic toxicity[S]. Geneva: ISO, 2017.
[63]ISO. ISO 10993-12: 2021. Biological evaluation of medical devices—Part 12: Sample preparation and reference materials[S]. Geneva: ISO, 2021.
[64]ISO. ISO 10993-18: 2020. Biological evaluation of medical devices—Part 18: Chemical characterization of medical device materials[S]. Geneva: ISO, 2020.
[65]ISO. ISO 10993-23: 2021. Biological evaluation of medical devices—Part 23: Tests for irritation[S]. Geneva: ISO, 2021.
[66]ISO. ISO/TS 10993-19: 2020. Biological evaluation of medical devices—Part 19: Physico-chemical, morphological and topographical characterization of materials[S]. Geneva: ISO, 2020.
[67]ISO. ISO/TS 10993-20: 2021. Biological evaluation of medical devices—Part 20: Principles and methods for immunotoxicology testing of medical devices[S]. Geneva: ISO, 2021.
[68]于晓慧, 施燕平, 高用华, 等. ISO 相关药包材标准体系概况及对我国标准体系构建的启示[J]. 医药导报, 2023, (7): 1020-1025. YU X H, SHI Y P, GAO Y H, et al. Overview of ISO standard system for pharmaceutical packaging materials and implications for building China’s standard system[J]. Her Med, 2023, 42(7): 1020-1025.
[69]张博, 徐志洲, 沈永, 等. 《中华人民共和国药典》药包材标 准体系构建的调研与分析[J]. 医药导报, 2022, 41(10): 1412- 1416. ZHANG B, XU Z Z, SHEN Y, et al. Investigation and analysis on the proposed new standard system under onstruction for pharmaceutical packaging materials in Chinese Pharmacopoeia[J]. Her Med, 2022, 41(10): 1412-1416
邵丽竹
何发
相关推荐
-
因设备维护未在设备日志登记,被FDA列入483
设备维护是维护GMP活动和设备稳定的一个重要工作,在执行设备维护时,大家都知道要填写维护记录,详细记录维护时间、维护项目、周期、维护人员、涉及影响及维护后的必要测试证明。
2026-01-21 Dennis Wang
-
蛇胆川贝液直接接触药品包装材料变更的药学研究
为提升产品安全性、环保性及患者用药便利性,对蛇胆川贝液的内包装材料进行变更,即将原有的钠钙玻璃管制口服液体瓶变更为聚酯/铝/流延聚丙烯(PET/AL/CPP)口服液体药用复合膜包装,并开展相应的药学研究以评估变更的合理性与可行性。
2026-01-21 付彩群 1 张瑜华 2* 张霄吟 1 胡建海 3
-
公开征集医药领域企业级AI创新应用项目
为贯彻落实《“人工智能+制造”专项行动实施意见》《医药工业数智化转型实施方案(2025-2030年)》,更好地挖掘医药工业人工智能技术应用典型场景,帮助企业通过人工智能技术为业务赋能,优化运营管理,提升企业效益,中国医药企业管理协会拟联合医药工业数智化转型促进中心(筹)、北京未来医药产业链研究院,面向全行业公开征集一批具有代表性的医药领域企业级AI创新应用项目,并通过技术指南、项目集、会议等方式在行业内推介,供医药企业参考应用。
2026-01-20 北京未来医药产业链研究院
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多