药品共线生产中的清洁验证与风险管控
药品共线生产是制药企业普遍采用的生产方式,其在提升资源利用率、降低生产成本的同时,也带来了污染与交叉污染等质量风险。随着药品上市许可持有人制度的推进和委托生产的普及,共线生产的质量管理日益成为行业关注的焦点。本文结合《药品共线生产质量风险管理指南》及相关研究,从基本原则、风险评估、清洁验证等方面探讨共线生产中的关键控制点,并提出实施建议,旨在为企业规范共线生产、保障药品质量提供参考。
Part.01 共线生产的基本原则与法规依据
药品共线生产是指多个药品品种共用同一生产线、设备或厂房进行生产的模式。其核心是在保障药品质量的前提下,实现资源的高效利用。我国《药品生产质量管理规范》第四十六条明确规定,企业应当综合考虑药品的特性、工艺和预定用途等因素,评估多产品共线的可行性,并形成书面报告 [1]。
共线生产的最大风险在于交叉污染,尤其是口服固体制剂生产过程中粉尘的产生与扩散 [2]。因此,风险识别是共线质量管理的首要环节,持有人应对共线生产的可行性和风险控制承担主体责任,特别是在委托生产模式下,需对受托方的共线评估报告进行严格审核 [3]。
《药品共线生产质量风险管理指南》的发布,为企业提供了系统性的技术指导,明确了“基于风险、全程管控、科学验证”的基本原则,细化了共线生产的评估要素与控制要求 [4]。
Part.02共线生产风险评估的关键要素
共线生产的风险评估应涵盖药品特性、工艺特点、厂房设施、设备清洁等多方面因素。《湖南省药品监督管理局关于加强药品共线生产监督管理的通知》明确指出,企业应对所有共线品种(包括研发样品、临床试验用药等)进行全面排查,特别是高毒、高活、中药与化药共线等特殊情形 [5]。
2.1 药品特性的评估
应根据药品的毒性、活性、致敏性、溶解性等属性,识别其在不同共线场景下的风险等级。部分企业在共线评估中未对高毒高活药品(如抗肿瘤药)进行专门识别与控制,存在较大隐患 [6]。
2.2 工艺与用途的考量
对于研发品种与商业化产品共线、中药与化药共线、最终灭菌与非最终灭菌产品共线等情形,应制定针对性的控制策略。如研发品种应在固定生产线或阶段性生产后进行全面清洁确认;中药与化药共线时应重点评估化药对中药的污染风险;若最终灭菌产品与非最终灭菌产品共线生产,应按更高标准执行无菌控制 [4]。
2.3 厂房与设备的设计
合理的空间布局与模块化设计是有效控制交叉污染的重要手段。例如,口服固体制剂车间可采用“制粒 - 干燥 -压片 - 包装”的模块化分区方式,并利用垂直布置减少物料转运 [2]。此外,产尘岗位应配备负压操作间和高效除尘系统,以防止粉尘扩散。
Part.03清洁验证与残留限度控制
清洁验证是共线生产的核心环节,其目的是证明清洁工艺能够将活性成分、清洁剂等污染物去除至可接受水平。清洁验证中存在的主要问题包括残留限度设定不合理、检测方法不验证、清洁范围不全面等 [3]。
3.1 残留限度计算方法
传统的残留限度计算方法包括:1/1000 最低日治疗剂量法、10 ppm 法等。近年来,基于毒理学的允许日暴露量(PDE)或基于健康的暴露限度(HBEL)方法被广泛推荐。欧盟 EMA 及 ICHQ3C 均提供了 PDE 的计算方法,其公式为:
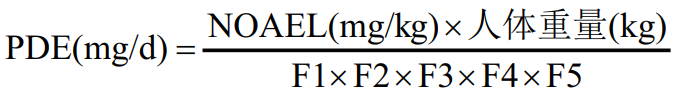
式中,NOAEL 为无可见有害作用水平;F1 ~ F5 为各种修正因子。
3.2 清洁验证实例
清洁验证中活性物质残留限度的计算直接影响清洁效果的判断,确定活性物质残留限度是清洁验证计划中的关键要素。参照 PDA 技术文件,限度应该务实、可确认、可达到且科学合理。在 1/1000 最低日治疗剂量、10 ppm 等传统方法基础上,规范增加了基于毒理学的暴露限度(如 PDE 值)的可接受标准,但未列明具体计算方法。
清洁验证活性物质残留限度计算举例说明(仅供参考):Ld 为最大允许残留;B 为下一批产品,批量为3000 L ;LDD 为每日最多使用制剂数,为 2 L ;SA 为与活性成分直接接触设备面积,为 160000 cm2 ;F 为安全因子,本次验证计算取 10 ;MF2 为修正因子,本次验证计算取 1000 ;NOAEL为无可见作用水平,为 600 g。默认限度 10 ppm 标准计算:
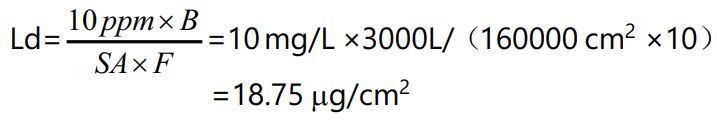
基于毒性的暴露限度标准计算:
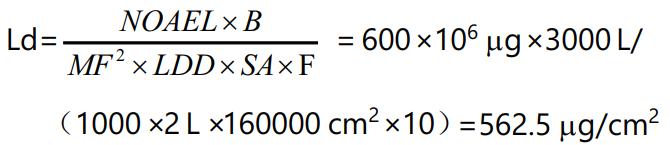
将两者计算结果综合进行比对,选择限度较低的 18.75 μg/cm2 作为清洁验证可接受标准。基于毒理的残留限度计算方法可以参考欧盟公布的“在共用设施中生产不同药品使用风险辨识建立健康暴露限度指南”。
企业应在产品研发阶段就收集毒理学数据,为后续清洁验证提供科学依据 [6]。
Part.04 共线生产的持续改进与监管建议
共线质量管理应贯穿药品全生命周期。持有人应定期开展共线生产回顾分析,及时识别新风险,更新控制策略 [5]。此外,监管部门应在许可检查、日常检查中加强对共线评估报告、清洁验证记录、清场操作等内容的审查。
企业还应加强人员培训,确保操作人员熟悉共线管理制度与清洁程序,避免因人为因素导致污染或混淆。
Part.05 结论
药品共线生产在提升经济效益的同时,也带来了复杂的质量风险。企业应在《药品共线生产质量风险管理指南》的框架下,建立科学的共线评估体系,完善清洁验证方法,落实持有人主体责任,并通过持续改进与监管协同,确保共线生产的药品质量安全可控。
参考文献
[1] 中华人民共和国卫生部. 药品生产质量管理规范(2010年修订)[S].卫生部令第79号. 2011.
[2] 杨军. 药品共线生产的风险及控制[J]. 山东化工,2018,47(11):116-120.
[3] 楼双凤,曹辉,张闯. 药品共线生产问题分析及建议[J]. 中国医药工业杂志,2022,53(7):1062-1065.
[4] 国家药品监督管理局食品药品审核查验中心. 关于发布《药品共线生产质量风险管理指南》的通告[EB/OL]. (2023-03-06). https://www.cfdi.org.cn/cfdi/resource/news/15186.html.
[5] 湖南省药品监督管理局关于加强药品共线生产监督管理的通知[EB/OL]. (2024-02-08). https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20230306174925137.html.
[6] 陈航,姚炜凯,吴声杨,等. 福建省药品上市许可持有人委托生产中共线生产的存在问题分析[J]. 中国药事,2023,37(10):1115-1119.
邵丽竹
何发
相关推荐
-
浅析胶囊用牛骨明胶生产企业批生产记录管理
本文旨在深入探究胶囊用牛骨明胶生产企业批生产记录管理的重要性、要求、常见问题以及优化策略,为当前胶囊用牛骨明胶生产企业进行批生产记录管理提供方法。
2025-12-12 陈世鹏,孙克洋,陈世会
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多