以人血白蛋白为例,无菌制剂生产过程中有哪些质量风险控制?
《中国药典》规定,无菌制剂是指法定药品标准中列有无菌检查项目的制剂,也就是说,在无菌制剂中不得含有活的微生物。 人血白蛋白是从人的血浆中提取分离白蛋白,按照无菌制剂的生产工艺制备的无菌制剂。血液制品是以健康人血液为原料,采用生物学工艺或分离纯化技术制备的生物活性制剂。 人血白蛋白是血浆中含量最高的蛋白质,约为4500mg/(100mL),占血浆总蛋白的一半以上。 白蛋白的黏度低,但产生的渗透压大,能有效增加血容量。
白蛋白的主要生理功能表现为可维持体液及血液胶体渗透压平衡、解毒、运输内源性或者外源性物质、抗休克及营养供给等,适应证包括失血创伤及烧伤引起的休克、脑水肿及损伤引起的颅压升高、肝硬化及肾病引起的水肿或腹水、低蛋白血症的防治、新生儿高胆红素血症、心肺分流术与烧伤的辅助治疗、血液透析的辅助治疗及成人呼吸窘迫综合征等[1-2]。
Part.01我国现有生产单位和批准文号
人血白蛋白市场需求量大,全国生产人血白蛋白的单位较多,通过在国家药品监督管理局网查询并统计,我国市场上现有的人血白蛋白生产企业和批准文号分别为32家和165个(人血白蛋白批准文号163个,冻干人血白蛋白批准文号2个)。
Part.02人血白蛋白的生产工艺
人血白蛋白是无菌生物制品,遵循注射剂的生产工序,主要操作步骤如下:
1、血浆采集
国家要求血液制品生产企业要有属于企业的单采血浆站,血浆站在采血浆之前,需要对献血浆者进行体格检查和血液检验,主要检查项目有丙氨酸氨基转移酶、乙肝表面抗原、丙肝抗体、艾滋病毒抗体、梅毒体抗体等,以确保捐献者的身体健康和捐献血浆的质量。
2、血浆的检测及存放
血浆采集之后,要按照中国药典规定逐一进行外观、蛋白质含量及病原体等项目检测,原料血浆在采集并检测合格后,用于血液制品生产的原料血浆,需要放置90d 的检疫期,让可能存在的病毒(如艾滋病病毒、肝炎病毒等)在这段时间内充分暴露和增殖,以便后续的病毒检测能够更准确地发现潜在问题。
3、血浆中分离人血白蛋白
血浆白蛋的分离方法有利凡诺法(利用利凡诺与蛋白形成络合物,降低溶解性而进行分离血浆蛋白)、盐析法(无机盐类在水溶液中电离成正负离子,这些离子不仅可以中和蛋白颗粒表面的电荷而且由于与水分子亲和力大而与蛋白竞争水分子,蛋白颗粒因电荷性减弱和水化膜难以形成而从溶液中析出)、层析法(按分子大小的顺序进行分离,也可按介质的不同分为凝胶、离子交换层析、亲和层析)和低温乙醇法等。
临床上应用的人血白蛋白是由健康人血浆经低温乙醇蛋白分离法分离纯化[3],并经巴氏灭活法灭活病毒后制成,下面重点介绍低温乙醇蛋白分离法制备人血白蛋白的工艺。低温乙醇蛋白分离法是以人血浆为起始原料,在逐步提高血浆中乙醇体积分数(8%→40%)的同时,提高血浆的酸度(pH值7.2→pH值4.0)、降低温度(-3 ℃ →-5℃ )并同步调节血浆的离子强度,低温乙醇蛋白分离法制备人血白蛋白生产工艺流程见图 1。
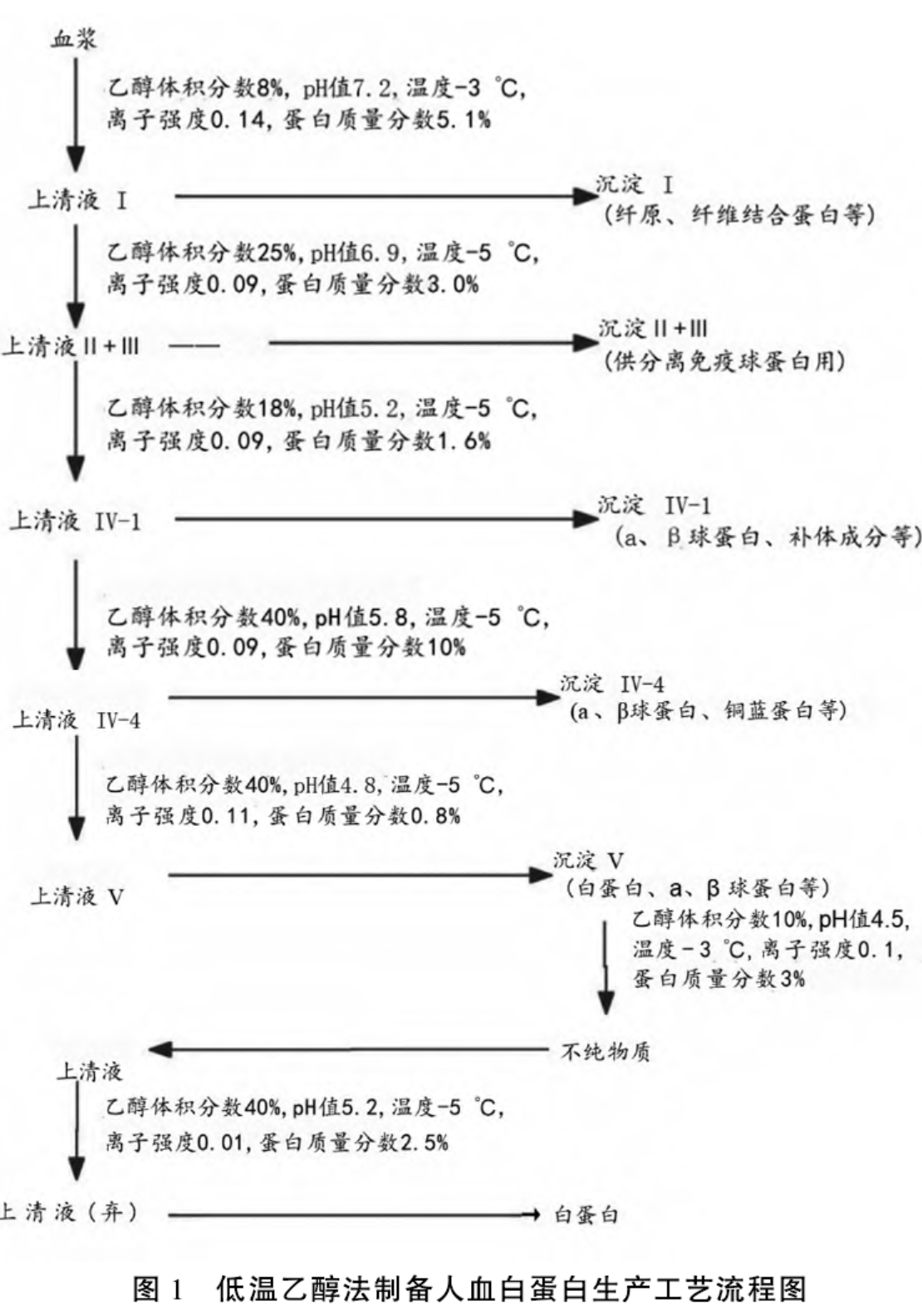
4、人血白蛋白的静制与灭活[4]
组分V 沉淀用 8~14倍的冷注射用水溶解后,搅拌 4h,调节 pH值为4.6,加低温乙醇,使溶液的乙醇体积分数15%,加入硅藻土,充分搅拌后静置10h 以上,用板框过滤,滤液用碳酸氢钠滴定液调节 pH值为 7.2,然后超滤浓缩至白蛋白含量为20.2%的原液。
在原液中按每1g蛋白质加入0.16mmol 辛酸钠作为稳定剂。 按成品规格以注射用水稀释蛋白质浓度,并适当调整 pH值及钠离子浓度。 每批制品必须在(60±0.5)℃ 水浴中连续加温10h,进行残留病毒灭活。
5、过滤除菌与分装[4]
将病毒灭活后的人血白蛋白中间产品用装有0.22 μm 的微孔滤膜的除菌滤器进行过滤除菌,除菌过滤的同时分装成规格为10g/瓶(10%,100mL)的产品,在过滤除菌及分装操作过程中,要使用无菌器械、无菌容器等进行无菌操作,以防止微生物的污染。
Part.03人血白蛋白的不良反应[5-7]
人血白蛋白使用后可能会出现一系列不良反应,主要表现为胸部闷憋、呼吸急促、呼吸困难、颜面发红、头痛、头晕、症状加重、寒颤、高热、抽搐、血压下降、心律失常、急性溶血、循环超负荷、腮腺肿大、喉头水肿、肾功能损害、降低某些药物疗效等。
Part.04人血白蛋白生产过程存在的安全风险
1、人员的资质与培训风险
药品生产需要员工具备熟练的设备操作、工艺控制等技能。 如果员工缺乏必要的培训,可能无法熟练掌握这些技能,从而影响生产效率和药品质量;培训不仅有助于提升员工的专业技能,还能增强员工的质量意识。 如果企业忽视培训,员工可能对质量标准和要求缺乏足够的了解,从而在生产过程中忽视质量控制,增加药品质量风险。
2、原料血浆带来的病毒感染与细菌污染风险
原料血浆中可能携带的病毒包括乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV)、甲型肝炎病毒(HAV)以及人细小病毒(B19) 等。 这些病毒可以通过血液制品的使用进入人体,并在体内复制和扩散。 一旦病毒进入血液制品的生产流程,它们可能通过血液制品的制备、储存和使用等环节传播给接受者。原料血浆的细菌污染可能来自献血者的皮肤、口腔、鼻腔等部位的微生物,以及采集、储存和运输过程中的不当操作。细菌污染可能接受者的感染,严重的细菌感染可能导致败血症、感染性休克等危及生命的并发症。
3、生产用具及包装材料的清洗与灭菌风险
如果生产用具及包装材料在清洗与灭菌过程中处理不当,可能残留细菌、霉菌等微生物,这些微生物可能进入人血白蛋白的生产流程,导致产品污染,进而影响产品的质量和安全性;清洗过程中使用的清洁剂或消毒剂如果未能彻底冲洗干净,可能残留在生产用具及包装材料上,灭菌过程中使用的化学物质(如环氧乙烷等),也可能残留从而影响白蛋白的纯度和生物活性,进而影响其疗效和安全性。
4、血浆蛋白分离过程中的风险
蛋白质变性风险
在低温乙醇法沉淀蛋白的过程中,乙醇需要在预冷后在低温条件下加入。 如果温度控制不当,在过高的温度下加入乙醇,可能会导致蛋白质发生不可逆的变性,从而影响产品的质量和疗效。
沉淀不完全与纯度风险
在低温乙醇法沉淀蛋白时,如果乙醇的体积分数、温度或pH 值等参数控制不当,可能会导致蛋白质沉淀不完全,影响人血白蛋白的回收率和纯度。 同时,如果沉淀过程中存在其他杂质的共沉现象,也会影响产品的纯度。
工艺的稳定风险
低温乙醇法沉淀蛋白是一个复杂的工艺过程,涉及多个步骤和参数控制。 如果工艺稳定性不足或操作不当,会导致产品质量的不稳定,进而对疗效和安全性产生潜在影响。
设备污染与交叉污染风险
在低温乙醇法沉淀蛋白的过程中,如果生产设备清洗不彻底或灭菌不到位,可能会导致设备污染。 此外,如果不同批次或不同类型的产品在同一生产线上进行处理时未进行严格的隔离和区分,可能会发生交叉污染。 这些都会对人血白蛋白的生产造成严重的风险。
环境因素影响风险
低温乙醇法沉淀蛋白的过程对环境条件有一定的要求。如果生产环境不符合要求(如温度、湿度、洁净度等),可能会影响产品的质量和安全性。 例如,如果生产环境中存在微生物污染或尘埃等杂质,可能会通过空气传播进入生产流程中,对产品造成污染。
配制、灭活与分装风险
配制、灭活与分装工序是人血白蛋白生产过程中至关重要的环节,这些工序的操作质量和控制直接关系到最终产品的质量和安全性。 以下是这些工序可能对人血白蛋白生产造成的风险:在配制过程中,如果未能准确按照配方比例进行混合,可能导致人血白蛋白的浓度、纯度或活性不符合预期标准。 配方的不准确将直接影响产品的质量和疗效,甚至可能引发患者的不良反应;配制过程中,如果操作不当或环境控制不严格,可能引入微生物、尘埃等污染物,这些污染物将影响产品的无菌性和安全性,降低产品的整体质量。
如果灭活工艺参数设置不当或操作不规范,可能导致病原体未被有效灭活,灭活不彻底将增加患者使用产品后感染的风险。 过度灭活或不当的灭活条件可能导致人血白蛋白的结构或活性发生变化,从而影响其疗效和安全性。
分装容器如果未经充分灭菌处理或存在质量问题,可能引入污染物。 分装容器的污染将直接影响产品的无菌性和安全性;分装过程中,如果操作不当或环境控制不严格,同样可能引入微生物、尘埃等污染物,这些污染物将降低产品的无菌性和安全性;分装时如果未能准确控制每瓶或每袋的装量,可能导致产品剂量不一致从而影响患者的用药剂量和疗效。
Part.05人血白蛋白生产过程质量风险控制措施
人血白蛋白是从人血浆中提取并大规模生产应用的血液制品,在临床上有着重要的应用价值,自20世纪40年代进入临床使用,人血白蛋白一直有“救命药” 之称,成为一种特殊的临床急救药品,其生产过程的质量风险控制至关重要。
1、加强原材料控制
确保采集的血浆来自健康、无传染病的献血者,要按规定对献血者进行严格的健康检查和筛查,包括病毒、细菌等病原体的检测,以防止病原体进入生产流程。 在采集后,血浆应储存在适当的温度下,以防止变质或污染。 同时,在运输过程中也要保持适当的温度和条件,确保血浆的质量和安全。
2、优化生产工艺
采用先进生产的低温乙醇蛋白分离法人血白蛋白生产工艺,该工艺经过长期实践验证,具有较高的安全性和稳定性;在生产过程中,要严格控制温度、 pH值、乙醇体积分数、离子强度等关键参数,以确保产品的质量和安全。 同时,对生产过程中的每一步骤都要进行严格地监测和记录,以便及时发现和解决问题。
3、强化质量检测与监控
建立完善的质量检测体系,对原材料、半成品和成品进行严格的质量检测。 包括病毒检测、蛋白质含量测定、杂质检测等,以确保产品的质量和安全。 对生产环境进行实时监测,包括空气洁净度、微生物污染情况等符合产品工艺的要求,以确保生产环境的清洁和无菌。
4、完善风险管理机制
对生产过程中可能存在的风险进行识别和评估,包括原材料风险、生产工艺风险、质量检测风险等。 根据风险评估结果。制定相应的风险控制措施,建立风险监控机制,对生产过程中的风险进行实时监控和报告,一旦发现风险问题,立即采取措施进行整改和纠正,以防止风险进一步扩大和蔓延。
5、加强人员培训与管理
加强员工的质量意识教育,使员工充分认识到产品质量和安全的重要性,通过培训和教育,提高员工的专业素养和操作技能,确保他们能够严格按照生产流程和质量标准进行操作。建立员工激励机制,对在工作中表现出色、质量意识强的员工进行表彰和奖励,对违反质量规定和标准的员工进行惩罚和纠正,以形成良好的工作氛围。
Part.06结语
人血白蛋白作为一种重要的无菌制剂,在临床上的应用日益广泛,其生产过程中的质量风险不容忽视。 为了确保产品的安全性和有效性,必须采取有效的风险控制措施,诸如加强原材料控制、优化生产工艺、强化质量检测与监控、完善风险管理机制以及加强人员培训与管理等。 通过这些措施的实施,可以有效降低生产过程中的风险,保障人血白蛋白的质量,使其更好地服务于临床需求,挽救更多患者的生命。
参考文献
[1] 窦姿,赵小洁,张齐明,等.人血白蛋白生产过程中多聚体含量的检测[J].中国输血杂志,2021,34(8):909-913.
[2] 范蓓,冯云安,王振海,等.模制瓶及盐水透析对人血白蛋白制品中铝离子残留量的影响[J].中国生物制品学杂志,2022,35(1):37-40.
[3] 卢锦汉,章以浩,赵铠.医学生物制品学[M].北京:人民卫生出版社,1995:832-837.
[4] 国家药典委员会.中国药典(三部) [M].北京:中国医药科技出版社,2020:245-246.
[5] 白凤芝,王亚芬,庞丽敏.人血白蛋白致不良反应 1 例[J].中国实验诊断学,2014,18(9):1547.
[6] 贾宝丽.人血白蛋白注射液不良反应一例[J].山西医药杂志,2012,41(2):185.
[7] 肖延民,范高路,项瑞.人血白蛋白的不良反应分析[J].中外医疗,2008(27):72-73.
邵丽竹
何发
相关推荐
-
基于 GMP 检查视角的无菌药品生产环境监测要点分析
目的:阐述无菌生产环境监测重点关注内容,分析常见检查缺陷,以期为无菌药品生产企业提升环境监测能力提供参考,同时为药品生产质量管理规范(GMP)无菌检查环境监测提供检查思路。
2025-12-04 李磊,班永生
-
底喷微丸包衣工艺参数对包衣效果的影响分析
流化床底喷微丸包衣的工作原理是借助急速上升的空气流使微丸在包衣室内悬浮流动,微丸在干燥室内上下翻动,利用喷枪借助压缩空气将包衣液雾化喷入流化床,在微丸表面形成一定厚度的膜,同时通入热空气迅速干燥上药后的微丸的包衣方法。
2025-12-04 刘辉宾
-
炒莱菔子配方颗粒提取工艺优化
本研究旨在以炒莱菔子为原料,通过对比动态提取和多功能煎煮提取参数,确定最佳提取工艺,优化炒莱菔子配方颗粒提取工艺,提高产品质量、收率和生产效率。
2025-12-03 李彦飞 史修强 张强
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多