生物发酵制药中微生物菌株筛选与改良的策略研究
✦
本文聚焦生物发酵制药中微生物菌株筛选与改良的策略研究,系统探索微生物菌株筛选与改良策略。研究方法整合传统方法与现代技术:传统方法包括自然筛选和诱变育种;现代技术涉及分子生物学(基因重组、编辑及表达调控)、代谢工程(网络分析、系统优化、底盘设计)、合成生物学(元件构建、基因线路设计),并结合高通量筛选与人工智能辅助。研究证实,传统方法仍具应用价值,现代技术可显著提升菌株性能:其中谷氨酸棒状杆菌经代谢工程改造后赖氨酸产量提升80%,大肠杆菌生产1,3-丙二醇的产量提升200%,芽孢杆菌通过基因重组技术优化后高温淀粉酶产量增幅超1000%,为生物制药产业提供理论支撑与实践路径,推动生物产业智能化、绿色化发展。
✦
✦
生物发酵制药作为现代生物技术的关键分支,在抗生素、氨基酸、维生素、酶制剂及重组蛋白药物等生产中占据重要地位。微生物菌株作为发酵过程的核心,其性能直接决定药物生产的效率、成本与质量。实践数据显示,通过菌株改良技术,不同类别目标产物产量提升效果显著:氨基酸类(如赖氨酸)产量可提升 80%[1],小分子化合物类(如1,3-丙二醇)产量提升200%[2-3],酶制剂类(如高温淀粉酶)产量增幅甚至超1000%[4]。随着分子生物学、代谢工程及合成生物学等学科的发展,菌株改良技术从传统随机诱变向理性设计转变[5]。本研究旨在系统剖析生物发酵制药中微生物菌株筛选与改良策略,助力产业发展。
Part.01
微生物菌株筛选的传统策略与技术
1.2诱变育种技术
诱变育种技术借助物理、化学或生物诱变剂处理微生物,诱导基因突变后筛选优良性状菌株,是工业微生物菌株改良的常用方法。物理诱变剂如紫外线可诱导脱氧核糖核酸(deoxyribonucleic acid, DNA)形成嘧啶二聚体,电离辐射能引起DNA双链断裂或碱基损伤;化学诱变剂包括碱基类似物、烷化剂、移码诱变剂等,通过不同机制导致基因突变;生物诱变剂如转座子可引起插入突变或基因表达调控改变。筛选时常用抗性筛选、形态学筛选和高通量筛选等方法。然而,该技术存在随机性高、表型与基因型关联差、多轮诱变效率递减以及难以改良复杂性状等问题[6]。
1.3传统筛选策略的局限性
传统自然筛选与诱变育种虽取得一定成效,但弊端明显。诱变育种突变随机,需大规模筛选;难以针对目标代谢途径改良,常出现生长缺陷等负效应;长期诱变会导致基因组损伤积累,菌株性能提升幅度下降;对于多基因协同调控的复杂性状改良效果不佳,这促使新型菌株改良策略发展[7-8]。
Part.02
基于分子生物学的菌株改良策略
2.2 基因编辑技术的发展与应用
人工智能辅助新药研发所展现出的能力和潜力得到了全球主流药企认可,规律间隔成簇短回文重复序列相关蛋白9(clustered regularly interspaced short palindromic repeats/CRISPR-associated proteing, CRISPR-Cas9)作为第三代基因编辑技术,凭借高效性和简便性成为菌株改良核心工具。它由 Cas9 核酸酶和单导核糖核酸 (single guide ribonucleic acid, sgRNA) 组成,可精准切割目标DNA 序列,触发细胞 DNA 修复机制,实现基因敲除、敲入或定点突变,在基因敲除、调控及多基因编辑等方面广泛应用。此外,锌指核酸酶(zinc-finger nucleases, ZFN)、类转录激活因子效应核酸酶(transcription activator-like effector nucleases, TALEN)、CRISPR关联蛋白(CRISPR-associated protein, CRISPR-Cpf1) 等基因编辑技术也各有特点和应用范围。
2.3 表达调控网络优化
微生物代谢表型是基因表达调控网络综合作用的结果,该网络精密调控着细胞内各类代谢活动。因此,优化这一网络成为提升目标产物合成效率的关键突破口。启动子作为基因表达起始的关键元件,其工程通过筛选微生物基因组中天然存在的具有不同强度和调控特性的启动子,利用易错聚合酶链式反应(polymerase chain reaction, PCR)等手段进行定向进化,或基于核心序列从头设计合成启动子,实现对基因表达水平的精准把控。转录后调控层面,优化核糖体结合位点(ribosome binding site, RBS)序列能增强信使RNA(messenger RNA,mRNA)与核糖体的结合效率;小RNA(sRNA)可特异性结合靶标 mRNA,调控其稳定性与翻译过程;核糖“开关”则能响应代谢物信号,动态调节基因表达,这些调控方式协同作用,有效提升菌株合成目标产物的性能。
Part.03
代谢工程导向的菌株改良策略
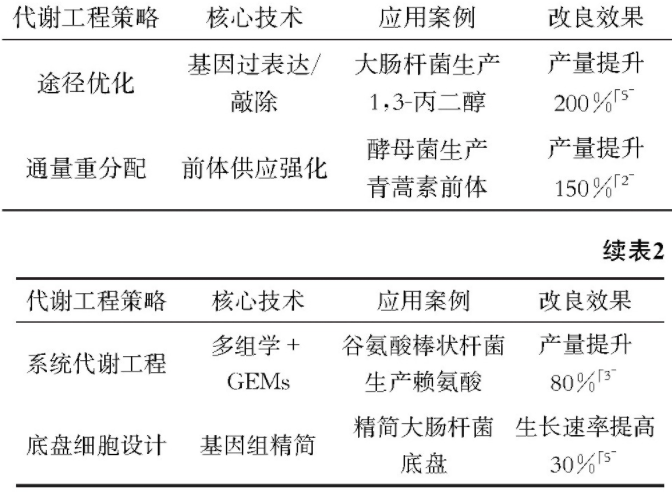
代谢工程通过系统分析微生物代谢网络,设计基因操作优化目标产物合成途径。包括解析目标产物合成途径,构建从头合成途径或优化天然途径;通过增强前体供应、阻断竞争途径、平衡辅酶因子供应等方式,实现代谢通量重分配,提高目标产物产量,如表1所示。
表1 代谢途径重构主要优化策略及应用

3.2 系统代谢工程策略
系统代谢工程通过整合多组学数据与计算生物学模型,搭建起代谢网络全局优化的系统性框架。借助转录组学技术可解析不同生理状态下的基因表达谱,代谢组学能精准检测胞内代谢物浓度动态变化,蛋白质组学则揭示蛋白质互作与修饰调控机制。通过转录组学、代谢组学、蛋白质组学数据的交叉分析(如基于生物信息学工具对差异表达基因、关键代谢物及互作蛋白进行关联映射),可定位代谢网络中的关键节点与潜在瓶颈(表2)。在此基础上,结合基因组规模代谢模型(如大肠杆菌 iJO1366 模型)与通量平衡分析(FBA)等计算工具,通过数学建模预测不同基因扰动或环境条件下代谢通量分布,进而指导基因敲除、过表达等改造策略的设计,实现从局部途径优化到全局代谢网络重分配的精准调控,为菌株高效生产目标产物提供数据驱动的理性改造方案[9]。
3.3 底盘细胞设计
底盘细胞是经定向改造、适配制药需求的 “标准化生产平台”,核心技术有:对大肠杆菌等模式菌用基因组精简剔除冗余基因、定制代谢网络,如精简大肠杆菌生长速率,提高至30%[5];对非模式/极端菌通过代谢网络重构“适配” 合成模块、基因编辑改特殊代谢机制;用标准化元件接口改造实现 “一底盘多产品”。其侧重宿主架构优化,与系统代谢工程的全局通量调控形成 “基础—应用” 递进。
表2 代谢工程主要策略及应用案例
Part.04
合成生物学驱动的菌株创新改良
4.1 标准化生物元件构建
4.2 人工基因线路设计
人工基因线路通过组合生物元件设计遗传调控网络,赋予微生物新功能或优化现有功能。逻辑门电路实现不同信号响应下的基因表达调控;振荡系统使基因表达周期性变化,提高代谢产物合成效率;记忆系统记录细胞历史状态,用于环境胁迫响应或产物合成时序调控。组合生物合成通过模块化重组生物合成基因簇,可重构次级代谢途径以创造新型化合物,或优化关键酶组合提升目标产物产量。
4.3 合成生物学在菌株改良中的前沿应用
合成生物学在复杂天然产物全合成、细胞工厂智能化设计和基因组编辑重编程等方面展现出巨大潜力。在酵母菌中重构阿片类生物碱合成途径,突破传统提取限制;设计智能响应系统,使微生物自动调整代谢通量;构建最小基因组,优化生产底盘。
Part.05
菌株筛选与改良的高通量技术平台
5.1 高通量筛选技术
5.2 人工智能在菌株设计中的应用
机器学习预测模型通过监督学习(以已知基因-表型关联数据为标签,训练随机森林、神经网络等模型)或无监督学习(对多组学数据聚类,挖掘未知基因-型关联)分析多组学数据,构建精准基因-表型映射模型,高效预测菌株改良靶点。自动化设计平台结合计算模型与机器学习,实现菌株设计流程智能化,加速开发进程。
Part.06
结 论
生物发酵制药中微生物菌株筛选与改良技术经历了从传统到现代的演进。传统筛选策略如自然筛选、诱变育种虽存在一定局限性,但仍在特定场景发挥作用;基于分子生物学、代谢工程和合成生物学的现代技术,实现了对菌株的精准设计与高效改造,显著提升了目标产物产量与生产效率。高通量筛选技术和人工智能的应用,进一步加速菌株开发进程。未来,随着多学科交叉融合的深入,菌株改良技术将朝着智能化、绿色化、高效化方向发展,有望攻克更多技术难题,为生物发酵制药产业的高质量发展注入强劲动力。
参考文献
[1]陈宇翔.微生物发酵技术在生物制药产业中的智能化应用研 究[J].高科技与产业化,2025,31(4):67-70.
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多