一文读懂预防用 mRNA 疫苗生产及工艺
mRNA 技术已在疫苗领域成功应用。随着越来越多的 mRNA 疫苗上市,相关产品正逐步迈向产业化阶段,因此也面临更多生产规范及质量合规性的挑战。文章分析了已上市 mRNA 疫苗的分子结构及其递送系统的设计关键,阐述了 mRNA技术的应用现状及面临的法规要求,并结合监管视角,探讨了质粒模板生产、mRNA 体外转录、制剂中间体生产、制剂分装等方面要求,旨在为 mRNA 疫苗产业的持续发展提供科学、实用的建议。
mRNA 可通过翻译表达蛋白或多肽。1990 年,mRNA 技术的潜力首次得到证实,WOLFF 等 [1]将编码 mRNA 注射至小鼠骨骼肌后,观察到某蛋白质在体内表达,并证实了体外转录 (in vitrotranscription,IVT) 合成的 mRNA 可诱导活性组织中蛋白质表达。文献 [2—4] 进一步研究了 mRNA 的胞内递送方法,证实体外合成的 mRNA 能够经一定的方式被递送进入体内,诱导产生靶蛋白特异性免疫应答。目前,mRNA 技术已被应用于预防或治疗性药物的研发。
在新型冠状病毒感染大流行的背景下,mRNA疫苗成为首个进入Ⅰ期临床试验的候选疫苗 [5],充分显示了 mRNA 技术的优势。① mRNA 疫苗具有平台灵活性。mRNA 疫苗靶基因的变化不会影响 mRNA 整条序列的理化特性 [6],因此在应对突发传染病时,仅需更替靶抗原基因,即可快速进行平台化生产。② mRNA 疫苗的安全性风险较低。mRNA 进入机体后,可通过细胞自身的生理代谢被迅速降解 [7],随机基因组整合的概率几乎为零 [8]。
IVT 合成无需细胞基质,能将疫苗生产中常见的细胞源性杂质和病毒污染物的潜在风险降至最低。③mRNA 在疫苗免疫原性方面具有优势。不仅可触发先天性免疫系统,还可诱导体液免疫反应和细胞免疫反应 [9]。
随着越来越多 mRNA 疫苗上市,相关产品正逐步迈向产业化阶段,mRNA 疫苗面临更多生产规范及质量合规性的挑战。本文分析了已上市 mRNA疫苗的分子结构及其递送系统的设计关键,阐述了mRNA 技术平台的应用现状与面临的法规要求,并结合监管视角,探讨了 mRNA 疫苗在生产过程中的关注点,旨在为 mRNA 疫苗产业的持续发展提供科学、实用的建议。
Part.01mRNA 疫苗的结构及其递送系统
编码特定抗原的 mRNA 是诱导特异性免疫应答的基础。mRNA 主要分为非复制、自扩增和环状 3种类型 [10—11]。目前已批准上市或处于临床阶段的mRNA 疫苗大多基于非复制型 mRNA 设计,因此本文重点介绍非复制型 mRNA。其基本结构 [12] 包括 5' 端帽子 (5'Cap)、5' 端非编码区 (5' untranslated region,5'UTR)、编码目标蛋白序列的开放阅读框 (open reading frame,ORF)、3' 端非编码区(3' untranslated region,3'UTR) 和 3' 端多聚腺苷酸[polyadenylation,poly(A)] 尾。
1、非复制型 mRNA
5'Cap 是真核生物 mRNA 的标志,可与翻译起始因子 4E(eukaryotic initiation factor 4E,eIF4E) 结合,保证 mRNA 的有效翻译,同时抑制外切核酸酶降解 mRNA,维持 mRNA 的稳定 [13]。根据甲基化修饰程度,可将帽子结构分为帽 0(Cap0)、帽1(Cap1) 和帽 2(Cap2)3 种类型,其中 Cap1 结构在真核生物中最常见 [13]。将 Cap1 结构引入,可提高mRNA 进入体内后的翻译效率,并防止先天性免疫反应 [14—15]。加帽工艺可选择共转录加帽 ( 一步法 )或转录后加帽 ( 二步法 )。
5'UTR 和 3'UTR 会影响 mRNA 的体内翻译效率、半衰期、蛋白表达水平等,采用 Kozak 序列、短小设计、引入稳定元件 ( 人类 α- 珠蛋白 /β- 珠蛋白 ) 等方法,可增强 mRNA 的稳定性,提高翻译效率 [16—20]。
ORF 用于编码目的蛋白,通过密码子优化 ( 如规避不常见或不安全的密码子组合 )、核苷酸替换( 用假尿嘧啶、5- 甲基胞嘧啶、N6- 甲基腺苷等修饰核苷酸 ) 等,增强 mRNA 的体内翻译效率和稳定性,同时减少先天性免疫反应和 mRNA 的降解 [21]。
3'poly(A) 尾在抑制 mRNA 脱帽和降解时可发挥重要作用,尾巴的长度可影响翻译效率和蛋白表达水平。一般 64 ~ 150 nt 长度的 Poly(A) 可实现较高水平的蛋白表达。加尾途径一般有 2 种 [15,22] :转录模板中引入多聚腺苷酸或转录后进行多聚腺苷酸修饰。
2、递送系统
裸 mRNA 不易穿透细胞膜进入细胞质,且极易降解,因此研发有效的递送系统是 mRNA 疫苗开发的关键。目前,脂质纳米颗粒 (lipid nanoparticle,LNP) 是 mRNA 疫苗递送的主要载体,可将 mRNA包裹在疏水性核心,形成物理保护屏障,从而实现有效的细胞摄取和内体逃逸释放。LNP 体系的安全性和有效性已在新型冠状病毒 mRNA 疫苗上得到验证 [23]。
LNP 体系主要由可电离脂质、胆固醇、磷脂和PEG 化脂质构成。可电离的阳离子脂质与带负电荷的 mRNA 能通过静电作用聚集形成复合物,避免mRNA 被 RNA 酶 (ribonuclease,RNase) 降 解。 可电离脂质在生理环境呈中性,毒性小 ;在酸性环境可发生电离,从而改变 LNP 的构象并释放 mRNA。
胆固醇能调节膜流动性,并稳定颗粒结构,在体内通过低密度脂蛋白 (low density lipoprotein,LDL) 受体介导 mRNA-LNP 的胞吞。辅助性脂类通常为磷脂,如 DSPC 可促进 LNP 与细胞膜融合,利于 mRNA从内体逃逸并释放至细胞质中。PEG 化脂质可提高LNP 结构的稳定性,避免非期望的免疫清除,从而延长 mRNA 疫苗在体内代谢时间。因此,筛选适宜的可电离脂质和优化 LNP 组分,是提高 LNP 安全性、提高递送效率的关键 [9]。
Part.02mRNA 技术的应用和监管指导
1、mRNA 疫苗的开发现状
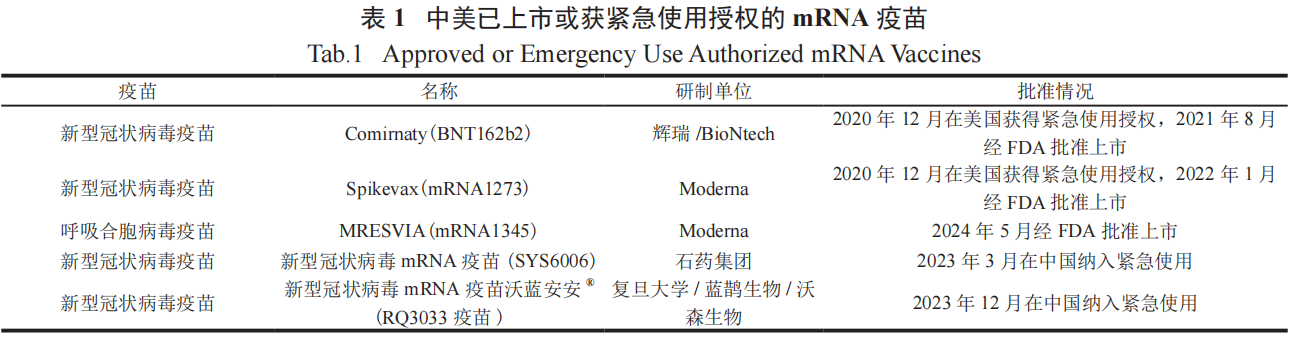
2020 年,美国辉瑞 / 德国BioNTech公司联合开发的新型冠状病毒疫苗 Comirnaty® 及美国 Moderna 公司的新型冠状病毒疫苗 Spikevax® 均获得了紧急使用授权,最终分别于 2021 年和 2022 年获 FDA 批准正式上市 [24]。我国也建立了 mRNA 平台开发疫苗,两款国产 mRNA 疫苗在我国纳入紧急使用,具体如表 1 所示。2024 年,FDA 批准了第 3 款人用 mRNA 疫苗 [25], 即 Moderna 公司的呼吸道合胞病毒疫苗MRESVIA( 表 1)。目前,mRNA 预防用疫苗的研究还涉及流感病毒、巨细胞病毒、寨卡病毒、人类免疫缺陷病毒等 [6],进一步表明了 mRNA 技术在疫苗领域的前景广阔。
2、mRNA 疫苗的监管指导
与传统疫苗相比,mRNA 疫苗尚属新兴领域,其监管具有一定的挑战。2020 年,NMPA 药品审评中心发布《新型冠状病毒预防用 mRNA 疫苗药学研究技术指导原则 ( 试行 )》[26]( 主要针对非复制型 mRNA 疫苗 ),用于指导应急状态下 mRNA 疫苗的研制,明确现阶段对 mRNA 疫苗药学研究的基本技术要求。2022 年,WHO 生物制品标准专家委员会发布第 1039 号技术报告,其附录 3《传染性疾病预防用 mRNA 疫苗质量、安全性和有效性评价的监管考虑》(Evaluation of the Quality, Safety and Efficacy of Messenger RNA Vaccines for the Prevention of Infectious Diseases: Regulatory Considerations)[27]。针对预防用 mRNA 疫苗的生产和质量控制,以及非临床和临床评估的关键方面信息和监管,为 mRNA疫苗提供具体指导。
在中国注册的预防用 mRNA 疫苗,应按照预防用生物制品进行注册申报,其生产质量管理应当符合注册批准的制造、检定规程和注册标准,还应符合现行版 ChP、《药品生产质量管理规范 (2010 年修订 )》及其无菌药品附录和生物制品附录的要求。作 为 WHO 成 员 国, 我 国 mRNA 疫苗生产还应符合《WHO 生物制品生产质量管理规范》(WHO Good Manufacturing Practices for Biological Products) 的要求。该规范所覆盖的生物制品包括过敏原、抗原、疫苗、某些激素、细胞因子、单克隆抗体、酶等,但该规范未对疫苗提出详细指导意见。因此,WHO 生物制品标准专家委员会发布了关于疫苗的相关要求,在其年度技术报告附录《WHO 关于生物制品生产及质量控制评价的相关建议、指南和其他文件》(WHO Recommendations, Guidelines and other Docouments Related to the Manufacture, Quality Control and Evaluation of Biological Products) 中作了明确,我国的 mRNA 疫苗生产也应当遵守。
2023年11月,国际药品认证合作组织(PharmaceuticalInspection Convention and Pharmaceutical Inspection Co-operation Scheme,PIC/S)致函 NMPA,确认了NMPA 的正式申请者身份。这表明我国向正式加入PIC/S 又迈进了一大步,因此我国 mRNA 疫苗的生产、监管应提前考虑符合 PIC/S 规范。PIC/S 发布的GMP 指南相关附录中包括 2023 年发布的新修订版本《附录 1 无菌药品生产》(Annex 1 :Manufacture of Sterile Medicinal Products),适用范围中的无菌产品类型广泛,包括原料药、制剂、辅料等,提出的技术要求也适用于 mRNA 疫苗 ;《附录 2B 人用生物制品原料及产品的生产》(Annex 2B :Manufacture of Biological Medicinal Substances and Products for Human Use) 的适用范围包括重组蛋白、单克隆抗体、过敏原、疫苗等。建议相关药品生产企业可提前布局,对标PIC/S附录1无菌药品和附录2生物制品的要求。
Part.03mRNA 疫苗的生产工艺及检查要点
mRNA 疫苗生产一般包括原液生产、mRNA 脂质中间体 (mRNA-LNP) 生产和制剂生产 3 个环节。其中,原液生产包括质粒模板生产和 mRNA 体外转录 ;mRNA-LNP 生产包括包封及包封后的纯化、超滤工艺 ( 含透析和浓缩 );制剂生产包括半成品配制、灌装 ( 可能包含冻干 ) 和包装。
1、质粒模板生产
质粒模板生产的具体工序包括菌种复苏、扩增、规模培养、菌体收集、菌体裂解、澄清过滤、质粒纯化、质粒线性化、模板纯化。
质粒模板生产应重点关注以下内容 :①原始菌种的管理是否符合注册批准文件及 ChP 的要求,如可溯源性、限定代次、备份管理等 ;②发酵培养及质粒纯化过程中杂质及纯度属性相关工艺参数的控制,如培养基成分、裂解过程的 pH 值和时限控制、线性化酶切体系、柱色谱收集标准等。
2、mRNA 的 IVT( 得到 mRNA 原液 )
IVT 以线性化质粒为转录模板,在多聚酶作用下通过一步加帽或两步加帽,再经离子交换等柱色谱步骤,将转录形成的 mRNA 进行纯化,最后经超滤、浓缩,得 mRNA 原液。该工序产生的杂质会极大影响 mRNA 疫苗的安全性和效力,可能形成的双链 RNA 和 DNA-RNA 杂交分子等能被模式识别受体识别,触发先天免疫反应,诱导Ⅰ型干扰素的表达,导致蛋白质翻译减少,因此 mRNA 纯化步骤至关重要。
IVT 工序应重点关注以下内容 :①转录原料的质量控制,如合成过程中大量使用的酶、核苷酸、帽子类似物等 ;② IVT 反应体系中起始物料的配比情况及转录时间、温度、终止反应条件等参数的控制情况 ;③模板去除过程的控制情况,如 DNA 酶处理工艺中的 DNA 酶浓度、处理时间、温度、终止反应条件等参数的控制情况 ;④加帽反应体系中物料投料比、补料方式、反应温度、时间等参数的控制情况。
3、制剂中间体生产 ( 得到 mRNA-LNP)
mRNA 的包封 / 装载是 mRNA 疫苗生产中最关键的工序。通常是将 mRNA 原液稀释至酸性水相缓冲液中,另将脂质成分按照一定比例溶解在乙醇溶液中,然后将有机相 (脂质混合溶液 )和水相 (mRNA溶液 ) 按一定的流速比经纳米混合设备 ( 如微流控芯片设备或射流混合器 ) 混匀,得纳米级的 mRNALNP 包封液,包封液经稀释、超滤、浓缩和无菌过滤后得 mRNA-LNP 制剂中间体。
制剂中间体生产应重点关注以下内容 :①mRNA 浓度、包封液的 pH 值、有机相流速、水相流速等关键参数的控制情况 ;②使用多台包封设备时,不同包封设备之间制备产物的均一性 ;③超滤浓缩用膜包的管理,如截留分子量、超滤过程中进 /出 / 滤过液的压力 ( 透膜压力 )、超滤时限等。
4、制剂分装
此步骤与传统疫苗制剂生产控制的要求相差不大,重点应关注 :半成品的配制参数,如搅拌转速、时长 ;除菌过滤验证及日常完整性确认要求 ;无菌操作和周期性无菌工艺的验证 ;分装时限及均一性控制 ;容器密封性情况等。
参考文献
[1] WOLFF J A, MALONE R W, WILLIAMS P, et al.Direct gene transfer into mouse muscle in vivo [J].Science, 1990, 247(4949 Pt 1): 1465-1468.
[2] GRANOT Y, PEER D.Delivering the right message: challenges and opportunities in lipid nanoparticles-mediated modified mRNA therapeutics——an innate immune system standpoint [J].Semin Immunol, 2017, 34: 68-77.
[3] QIU P, ZIEGELHOFFER P, SUN J, et al.Gene gun delivery of mRNA in situ results in efficient transgene expression and genetic immunization [J].Gene Ther, 1996, 3(3): 262-268.
[4] HOERR I, OBST R, RAMMENSEE H G, et al.In vivoapplication of RNA leads to induction of specific cytotoxic T lymphocytes and antibodies [J].Eur J Immunol, 2000, 30(1): 1-7.
[5] LE T T, CRAMER J P, CHEN R, et al.Evolution of the COVID-19 vaccine development landscape [J].Nat Rev Drug Discov, 2020, 19(10): 667-668.
[6] ARMBRUSTER N, JASNY E, PETSCH B.Advances in RNA vaccines for preventive indications: a case study of a vaccine against rabies [J].Vaccines(Basel), 2019, 7(4): 132.
[7] STEINLE H, BEHRING A, SCHLENSAK C, et al.Concise review: application of in vitro transcribed messenger RNA for cellular engineering and reprogramming: progress and challenges [J].Stem Cells, 2017, 35(1): 68-79.
[8] TOMBÁCZ I, WEISSMAN D, PARDI N.Vaccination with messenger RNA: a promising alternative to DNA vaccination [J].Methods Mol Biol, 2021, 2197: 13-31.
[9] KUTIKUPPALA L V S, KOURAMPI I, KANAGALA R S D, et al.Prospects and challenges in developing mRNA vaccines for infectious diseases and oncogenic viruses [J].Med Sci(Basel), 2024, 12(2): 28.
[10] FLEETON M N, CHEN M, BERGLUND P, et al.Selfreplicative RNA vaccines elicit protection against influenza A virus, respiratory syncytial virus, and a tickborne encephalitis virus [J].J Infect Dis, 2001, 183(9): 1395-1398.
[11] SANGER H L, KLOTZ G, RIESNER D, et al.Viroids aresingle-stranded covalently closed circular RNA molecules existing as highly base-paired rod-like structures [J].Proc Natl Acad Sci U S A, 1976, 73(11): 3852-3856.
[12] MARUGGI G, ZHANG C, LI J, et al.mRNA as a Transformative technology for vaccine development to control infectious diseases [J].Mol Ther, 2019, 27(4): 757-772.
[13] MUTTACH F, MUTHMANN N, RENTMEISTER A.Synthetic mRNA capping [J].Beilstein J Org Chem, 2017, 13: 2819-2832.
[14] SHATKIN A J.Capping of eucaryotic mRNAs [J].Cell, 1976, 9(4 PT 2): 645-653.
[15] MCNAMARA M A, NAIR S K, HOLL E K.RNA-Based Vaccines in Cancer Immunotherapy [J].J Immunol Res, 2015, 2015: 794528.
[16] PICKERING B M, WILLIS A E.The implications of structured 5' untranslated regions on translation and disease [J].Semin Cell Dev Biol, 2005, 16(1): 39-47.
[17] TREPOTEC Z, ANEJA M K, GEIGER J, et al.Maximizing the translational yield of mRNA therapeutics by minimizing 5'-UTRs [J].Tissue Eng Part A, 2019, 25(1-2): 69-79.
[18] MCCLEMENTS M E, BUTT A, PIOTTER E, et al.An analysis of the Kozak consensus in retinal genes and its relevance to gene therapy [J].Mol Vis, 2021, 27: 233-242.
[19] JIA J, YAO P, ARIF A, et al.Regulation and dysregulation of 3'UTR-mediated translational control [J].Curr Opin Genet Dev, 2013, 23(1): 29-34.
[20] HONG D, JEONG S.3’UTR diversity: expanding repertoire of RNA alterations in human mRNAs [J].Mol Cells, 2023,46(1): 48-56.
[21] ROSS J.mRNA stability in mammalian cells [J].Microbiol Rev, 1995, 59(3): 423-450.
[22] HOLTKAMP S, KREITER S, SELMI A, et al.Modification of antigen-encoding RNA increases stability, translational efficacy, and T-cell stimulatory capacity of dendritic cells [J].Blood, 2006, 108(13): 4009-4017.
[23] SUZUKI Y, ISHIHARA H.Difference in the lipid nanoparticle technology employed in three approved siRNA (Patisiran) and mRNA(COVID-19 vaccine) drugs [J].Drug Metab Pharmacokinet, 2021, 41: 100424.
[24] 刘 芬 , 陈一飞 , 俞佳宁.mRNA 疫苗监管案例分析——基于 FDA 对 COVID-19 mRNA 疫苗的审评 [J].中国医药工业杂志 , 2024, 55(8): 1143-1147.
[25] MULLARD A.FDA approves mRNA-based RSV vaccine [J].Nat Rev Drug Discov, 2024, 23(7): 487.
[26] 国家药品监督管理局药品审评中心.新型冠状病毒预防用 mRNA 疫苗药学研究技术指导原则 ( 试行 )[EB/OL].(2020-08-14)[2023-09-30].https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=9efa70b504dc5c66965001181a49c30b.
[27] WHO.Evaluation of the quality, safety and efficacy of messenger RNA vaccines for the prevention of infectious diseases: regulatory considerations, Annex 3, TRS No 1039 [EB/OL].(2022-04-15)[2023-09-30].https://www.who.int/publications/m/item/annex-3-mRNA-vaccines-trs-no-1039.
邵丽竹
何发
相关推荐
-
FDA官方深度解读:从最新申报数据与483检查看冻干工艺趋势、控制缺陷与未来方向
FDA CDER OPQ专家团队发布:从162份申报与201次现场检查看冻干工艺趋势、控制缺陷与升级路径。
2025-12-22 冻干工艺之家
-
压片制粒生产各过程关键因素之考量
本文根据实际生产中的切身体会,从制备湿颗粒、选用筛网、干燥物料等常见控制因素进行探讨,分析压片生产过程中可能发生问题的常见影响因素,并提出了相关控制措施,以保证药品生产的质量。
2025-12-22 制药人职场加油站
-
SGLH-A-2000D 型蒸汽灭菌器在人血白蛋白生产工艺中的应用
本文旨在对 SGLH-A-2000D 型蒸汽灭菌器进行确认、培养基模拟灌装以及工艺验证试验,以此验证该灭菌器的灭菌效果是否满足人血白蛋白生产工艺的要求。
2025-12-19 魏周涛,赵崎光,董晖,丁轩宇,赵子伟,杨灵通
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多