SGLH-A-2000D 型蒸汽灭菌器在人血白蛋白生产工艺中的应用
本文旨在对 SGLH-A-2000D 型蒸汽灭菌器进行确认、培养基模拟灌装以及工艺验证试验,以此验证该灭菌器的灭菌效果是否满足人血白蛋白生产工艺的要求。按照《药品生产质量管理规范(2010 年修订)》的要求,对 SGLH-A-2000D 型蒸汽灭菌器进行设计确认、安装确认、运行确认和性能确认(包括热分布、热穿透和微生物挑战试验),并通过培养基模拟灌装和工艺验证试验,判定 SGLH-A-2000D型蒸汽灭菌器对人血白蛋白分装用具、胶塞、铝塑组合盖的湿热灭菌效果。结果表明,SGLH-A-2000D型蒸汽灭菌器的设计确认、安装确认、运行确认和性能确认均符合要求。连续 3 批培养基模拟灌装试验的结果均为零污染,连续 3 批工艺验证试验的人血白蛋白无菌检查合格率均为 100%,SGLH-A-2000D型蒸汽灭菌器对人血白蛋白分装用具、胶塞、铝塑组合盖的湿热灭菌效果符合《药品生产质量管理规范(2010 年修订)》的要求。综上,本文得出结论:SGLH-A-2000D 型蒸汽灭菌器能够满足人血白蛋白生产工艺的要求,能够用于人血白蛋白的分装用具、胶塞、铝塑组合盖的湿热灭菌。
人血白蛋白(Human Albumin)是从健康人血浆中提取、分离和纯化制备,并经病毒灭活处理后,可直接静脉注射的血液制品 [1]。因它具有增加血容量、维持胶体渗透压,以及作为氮源提供营养供给等药理作用,临床上可用于低血容量的紧急治疗、肝硬化和肾病引起的水肿或腹水等病症 [2]。
蒸汽灭菌器主体采用卧式压力容器,运用双面焊接加强结构,保证设备具备足够高的承压力能力。机动门由门板、门罩、安全连锁机构组成。管路系统由夹层进气管路、内室进纯蒸汽管路、疏水管路、进空气管路和软化水管路构成。控制系统由 PLC、触摸屏、温度传感器、压力变送器、压力控制器、气动阀、电磁阀、真空泵、仪表和微型打印机等组件构成 [3]。常用灭菌程序包括织物程序、液体程序、器械程序。
人血白蛋白生产过程使用器械灭菌程序,其工作流程为:脉动 - 升温 -灭菌 - 排汽 - 干燥。蒸汽灭菌器作为无菌药品生产的关键设备,应当经过确认与验证 [4]。本文对 SGLH-A-2000D 型蒸汽灭菌器的湿热灭菌效果进行确认、试运行和工艺验证试验,以确保该设备满足无菌药品生产工艺要求。
Part1 材料与方法
1.1材料
SGLH-A-2000D 型蒸汽灭菌器(山东新华医疗器械股份有限公司,容 积:2000 L);温 度 记 录 仪(ebro,EBI 310TX 型有线温度记录仪);生物 指 示 剂(Terragene,BT20,Cell Line#7953);恒温培养箱(POL-EKO,S470 型);水分测试包(ebro);分装用具(SYNTEGON);药用卤化丁基橡胶塞(江苏华兰药用新材料股份有限公司,20-A5);抗生素瓶用铝塑组合盖(上海久正医用包装材料有限公司,Φ20×7.5)。
1.2方法
1.2.1设计确认(design qualification,DQ)
DQ 需确认 SGLH-A-2000D 型蒸汽灭菌器的设计是否符合预定用途和《药品生产质量管理规范(2010 年修订)》的要求,其功能(灭菌程序、热分布、热穿透、微生物杀灭等)设计是否与用户需求说明(user requirment specification,URS)一致;检查 DQ 方案是否已通过审核与批准;确认设备布局图、管路及仪表图、公用工程清单及耗量表、电气图、仪表和关键传感器清单、电气部件清单、功能说明、硬件设计说明、软件设计说明、机械设计说明等文件是否已完成。
1.2.2安装确认(installation qualification,IQ)
IQ 旨在确认设备的制造是否符合设计标准,设备安装是否符合规定,能否满足产品工艺的需求。检查设备的资料(详细设计图纸、安装手册、操作手册、维护手册、部件技术文件、金属及非金属材质证书、管段表、电气部件技术文件、内窥镜检测报告、焊接过程质量记录卡、质量保证计划等)是否齐全并存档;检查确认铭牌信息、设备布局、搬运车及灭菌架、材质、公用工程,并进行工效试验检查。
1.2.3运行确认(operational qualification,OQ)
进 行 OQ 前, 需 确 认 IQ 是否完成,设备仪表及关键传感器是否已校验,设备操作、清洁和维护标准操作规程(standard operation procedure,SOP)是否起草完毕,操作培训是否完成。OQ确认项目包括设备系统通信检查、噪声检查、执行器检查、设备启停检查、设备急停检查、泄露测试、在线灭菌(SIP)测试、BD 测试、程序检查、冷凝水排水检查、空载热分布测试 [5]。
1.2.4性能确认(performance qualification,PQ)
进行 PQ 前,应确认 OQ 是否完成,若存在偏差、变更是否已解决。确认PQ 方案是否已完成审批,人员是否已接受本培训且培训是否合格。检查仪器仪表是否已校验。按照人血白蛋白工艺规程和质量控制要求,PQ 进行负载热分布试验、负载热穿透试验、微生物挑战实验、干燥效果测试,确认 SGLHA-2000D 型蒸汽灭菌器的性能是否满足生产工艺要求。泄露测试、在线灭菌测试、BD 测试、空载热分布测试已由厂家在 OQ 阶段完成,PQ 不再执行。
1.2.4.1 负载热分布试验
在蒸汽灭菌器矩形腔室内的 8 个角落、疏水口处设置 9 个温度记录仪(位置编号:1 ~ 9),蒸汽灭菌器温控探头(TE1)和一个活动探头(TE5)位于疏水口附近。选择器械灭菌程序(程序参数见表 1)进行试验。
表 1 器械程序参数
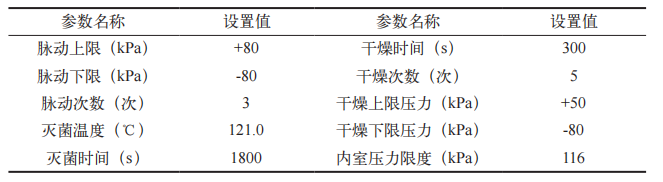
可接受标准:在灭菌阶段,灭菌腔室内各个热分布测试点的温度均应处于 121 ~ 124℃范围之内,灭菌时间≥ 1800 s ;在灭菌段同一时刻,各测试点之间的最大温差为 2℃ ;TE1、TE5 的平均温度与附近温度记录仪平均温度T2 的温差不超过 ±1℃ [6]。
1.2.4.2 负载热穿透试验、微生物挑战试验
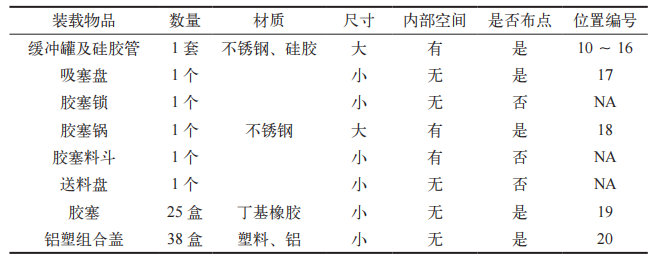
按照 SGLH-A-2000D 型蒸汽灭菌器操作 SOP 规定的装载方式码放灭菌物品,灭菌物品统计情况见表 2。热穿透试验需要挑战所有负载物蒸汽最难穿透的点。根据负载物特性及其码放特点,在负载物内部设置 11 个温度记录仪(位置编号:10 ~ 20),将第二个活动探头(TE6)与温度记录仪一同放置于负载物内部 [7]。同时,在每个温度记录仪附近设置一个生物指示剂(BI),用于进行微生物挑战试验(位置编号:10 ~ 20)。负载热分布试验、负载热穿透试验、微生物挑战试验同步进行。灭菌程序结束后,读取温度记录仪的数据并进行分析,取出 BI 进行培养,测试连续进行 3 次。可接受标准:在灭菌阶段,各热穿透测试的温度均应在 121 ~ 124℃之间;F0 值≥ 15 min ;平衡时间≤ 30 s ;TE6 平均温度与附近温度记录仪平均温度 T3 的温差不超过±1℃ [8] ;经过灭菌的 BI,培养结束后不变色,阳性对照 BI,培养结束后变为黄色 [9]。
表 2 灭菌物品统计
1.2.4.3 干燥效果试验
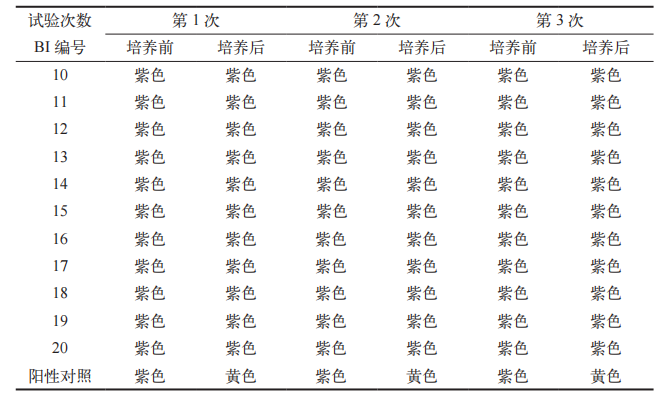
与 PQ 同时进行,每次测试均需放置水分测试包,以确认干燥效果。将水分测试包称重后放置在蒸汽灭菌器腔室底面,距离腔室底水平面的高度为100 mm ~ 200 mm。灭菌程序结束后,取出标准测试包再次称重。可接受标准:负载物品水分测试包的质量增加不超过0.2%[10]。
1.2.5试运行试验
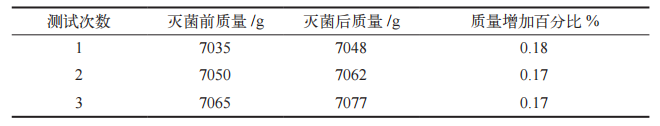
根据《无菌工艺模拟试验指南(无菌制剂)》,分装线首次验证需连续进行 3 批培养基模拟灌装试验 [11],每批设计分装量为 30500 瓶,使用 SGLHA-2000D 型蒸汽灭菌器对每批次分装用具、胶塞、铝塑组合盖进行湿热灭菌,统计合格率、污染瓶数,判定其湿热灭菌效果是否符合 GMP 的要求。
1.2.6工艺验证试验
按照人血白蛋白工艺规程分别进行 30500 瓶(投血浆 10 t)、7500 瓶(投血浆 2.5 t)、7500 瓶(投血浆 2.5 t)3批人血白蛋白工艺验证,使用 SGLHA-2000D 型蒸汽灭菌器对每批次分装用具、胶塞、铝塑组合盖进行湿热灭菌,按分装瓶数的 0.1% 于分装过程中进行抽样,必须包含第一筐第一瓶与最后一筐最后一瓶,进行无菌检查以判定湿热灭菌效果 [12]。
Part2 结果
2.1DQ 结果
SGLH-A-2000D 型蒸汽灭菌器的功能(灭菌程序、热分布、热穿透、微生物杀灭等)设计与用户需求规格(URS)一致;DQ 方案已通过审核与批准;设备布局图、管路及仪表图、公用工程清单及耗量表、电气图、仪表和关键传感器清单、电气部件清单、功能说明、硬件设计说明、软件设计说明、机械设计说明等文件均已完成。
2.2IQ 结果
设备的制造与安装符合规定,能够满足人血白蛋白工艺需求。设备的详细设计图纸、安装手册、操作手册、维护手册、部件技术文件、金属及非金属材质证书、管段表、电气部件技术文件、内窥镜检测报告、焊接过程质量记录卡、质量保证计划等文件齐全且已存档;铭牌信息、设备布局、搬运车及灭菌架、材质、公用工程及工效试验检查均符合要求。
2.3OQ 结果
安装确认(IQ)、设备操作、清洁和维护的标准操作规程(SOP)已起草完毕,操作培训已完成且人员培训合格;设备仪表及关键传感器己校验且处于有效期内;设备系统通信正常、噪声≤ 85 db;执行器、启停 / 急停功能正常;泄露测试、在线灭菌(SIP)测试、BD测试、程序检查、冷凝水排水效果、空载热分布测试结果均符合要求。
2.4PQ 结果
2.4.1负载热分布、热穿透、微生物挑战试验结果
运行确认(OQ)已完成,未出现偏差与变更;连续三批次负载热穿透、热分布试验灭菌阶段,灭菌腔室内各测试点温度均处于 121 ~ 124℃之间,灭菌时间> 1800 s ;各热分布测试温度记录仪灭菌段同一时刻各测试点之间最大温差< 2℃ ;各热穿透测试温度记录仪的 F0 值> 15 min ;平衡时间< 30 s ;TE1、TE5、TE6 与附近温度记录仪平均温度差< ±1℃,热分布、热穿透试验结果见表 3、表 4 和表 5 ;灭菌后的生物指示剂(BI),在 55 ~ 62℃培养24 h 后不变色,均为阴性,阳性对照BI 培养结束后变为黄色,微生物挑战实验结果见表 6。以上结果表明 PQ 符合可接受标准。
表 3 第 1 次热分布、热穿透试验结果
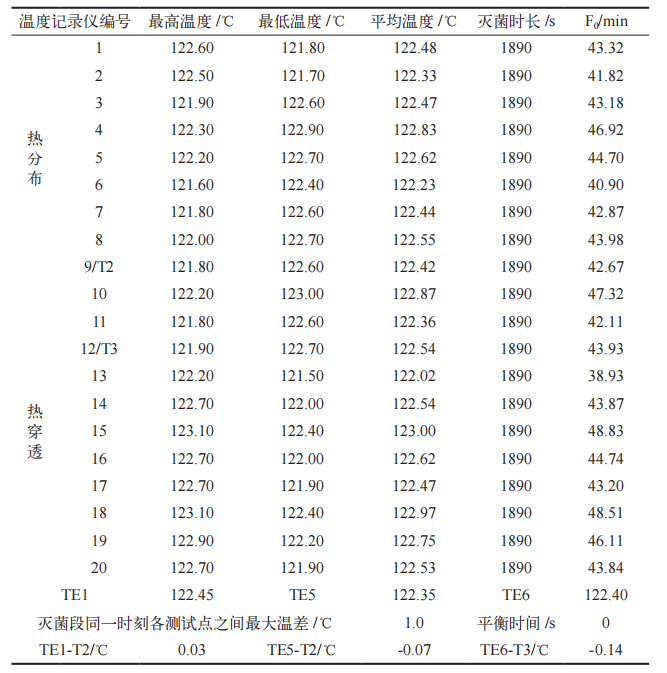
表 4 第 2 次热分布、热穿透试验结果
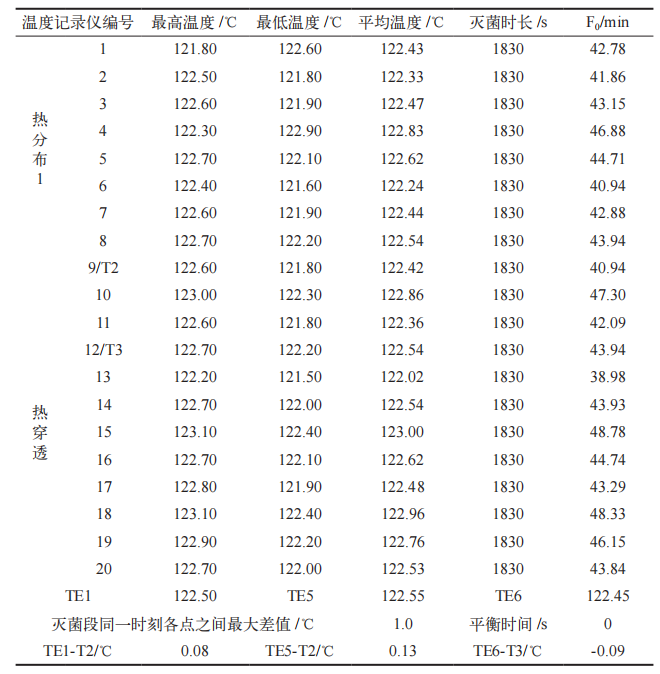
表 5 第 3 次热分布、热穿透试验结果
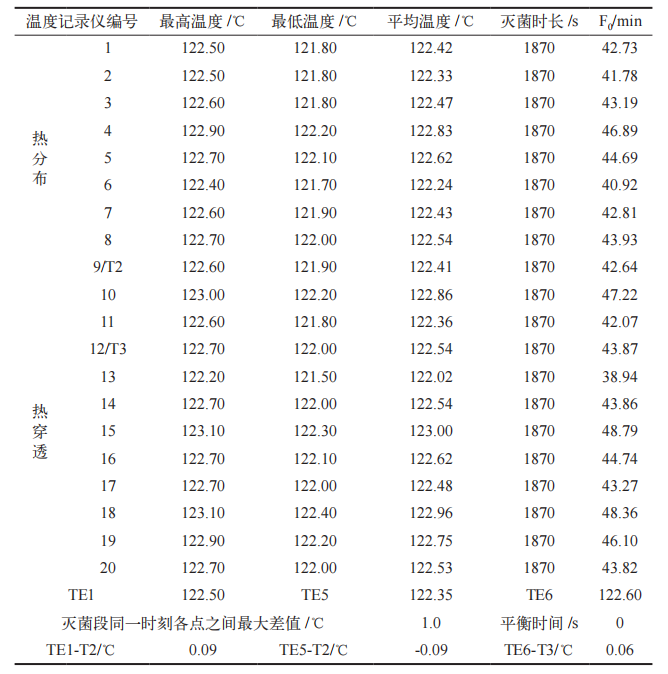
表 6 微生物挑战试验结果
2.4.2干燥效果试验结果
连续三批次试验负载物品干燥测试包的质量增加均< 0.2%,干燥效果良好。干燥效果实验结果见表 7。
表 7 干燥效果试验结果
2.5培养基模拟灌装试验结果
按照《无菌工艺模拟试验指南(无菌制剂)》进行的三批培养基模拟灌装试验,合格率达 100%,污染瓶数为 0,培养基模拟灌装试验结果见表 8。由此可判定,SGLH-A-2000D 型蒸汽灭菌器对分装用具、胶塞、铝塑组合盖的湿热灭菌效果符合 GMP 的要求。
表 8培养基模拟罐装试验结果
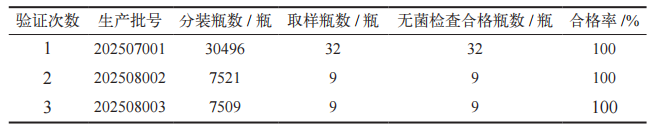
2.6工艺验证试验结果
工艺验证生产的三批人血白蛋白,其无菌检查合格率均为 100%。工艺验证结果见表 9。这证明 SGLH-A-2000D型蒸汽灭菌器对分装用具、胶塞、铝塑组合盖的湿热灭菌效果符合 GMP 的要求。
表 9 工艺验证结果
Part3 结语
人血白蛋白作为血液制品的主流产品,凭借特有的治疗效果在国内外得以广泛生产和使用 [13]。在生产过程中,应最大限度降低微生物、各种微粒和热原的污染 [14]。其生产所用的分装用具、内包材普遍采用湿热灭菌法进行灭菌。本文按照《药品生产质量管理规范(2010 年修订)》的要求,对 SGLH-A-2000D型蒸汽灭菌器进行了确认与验证,确认SGLH-A-2000D 型蒸汽灭菌器的设计、安装、运行均符合药品生产及工艺的要求,性能测试所有测试项均符合可接受标准,且对分装用具、胶塞、铝塑组合盖的湿热灭菌效果符合《药品生产质量管理规范(2010 年修订)》的要求,可用于人血白蛋白分装用具、内包材的湿热灭菌。
参考文献
[1] 倪道明 . 血液制品 [M]. 北京:人民卫生出版社,2013:91.
[2] 魏君慧,王双喜,杨灵通,等 . 人血白蛋白及其内包装材料浸出物分析 [J]. 流程工业,2025,(08):112-117.
[3] 种法明,英晓,刘宁 . 矩形蒸汽灭菌压力容器力学性能研究 [J]. 机械管理开发,2025,40(03):35-37.
[4] 中华人民共和国卫生部 . 药品生产质量管理规范(2010年修订)附录:确认与验证 [S]. 北京:中华人民共和国卫生部,2011.
[5] 巩 喜 军, 赵 崎 光, 陆 麒, 等 .KSZ620/43B 型隧道烘箱在血液制品生产工艺中的应用 [J]. 医疗卫生装备,2022,43(08):45-49.
[6] 张启林,林晶晶 . 湿热灭菌工艺验证探讨 [J]. 中国医药工业杂志,2021,52(8):1106-1114.
[7] 牛振东,路银环,刘文杰,等 . 脉动真空灭菌器灭菌效果验证 [J]. 中国药业,2022,31(22):75-77.
[8] 中国国家标准化管理委员会 . GB8599-2023,大型蒸汽灭菌器技术要求自动控制型 [S]. 北京:中国标准出版社,2008.
[9] 陈世鹏,董炎超 . 应用生物指示剂验证蒸汽灭菌器的灭菌效果 [J]. 流程工业,2021,(07):51 -53.
[10] 刘宁 . 脉动真空灭菌器湿包原因及对策分析 [J]. 设备管理与维修,2024,(04):64-67.
[11] 余鼎,孙玉忠,杨丹波,等 . 血液制品生产工艺验证实践的探讨 [J].中国当代医药,2013,20 (08):161-163.
[12] 国家药品监督管理局 . 无菌工艺模拟试验指南(无菌制剂)[S]. 北京,2018.
[13] 袁诗宇 . 揭秘人血白蛋白的科学应用 [ J ]. 药物与人,2 0 2 5,( 0 8 ): 25 - 2 7.
[14] 国家食品药品监督管理局药品认证管理中心,组织编写 . 无菌药品[M]. 中国医药科技出版社,2011.
邵丽竹
何发
相关推荐
-
论设计模拟在生物药厂建设项目中的协同应用
本文探讨了在高端复杂药厂建设项目中,特别是生物制药厂房的设计管理领域,如何综合运用各类设计模拟软件进行项目设计与分析,并提出应对措施。文章详细描述了在药厂项目中,如何分别对室内空间、吊顶空间及设备安装空间进行精准建模,并通过后期的综合集成应用以实现优化。
2025-12-05 周隽杰
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多