制药企业无菌制剂车间可视化设计和管理探索
本文梳理了药品相关法规对生产可视化的要求,全面分析了无菌制剂车间的可视化设计和管理的必要性及价值,依据设计和管理实践系统的提出了切实可行的可视化解决方案。目的是助力制药企业提升无菌制剂车间设计和管理水准,从源头筑牢药品生产质量与安全防线。
制药企业无菌制剂车间的生产环境直接关系到药品的质量与安全。2025 版 GMP 无菌药品附录(征求意见稿)[1] 多次提出无菌制剂车间生产过程、环境参数、设备运行等多方面的实时监控与数据可视化要求。为满足日益严苛的法规标准及企业不断提升的质量要求,可视化设计作为一种先进的设计理念和管理手段,正逐渐成为无菌制剂车间建设与管理优化的关键要素。本文将结合法规要求与行业实践,深入探讨无菌制剂车间可视化设计和管理的实现路径。
Part.01无菌制剂车间可视化设计和管理的必要性及价值
1.1 满足药品相关法规的要求
国家药监局发布的 2025 版 GMP无菌药品附录(征求意见稿)[1] 要求:洁净厂房的设计应当尽可能避免管理或监控人员不必要的进入,A 级和 B级洁净区的设计应当能够使管理或监控人员从外部(如通过视窗、远程摄像系统等)观察到内部的操作。同时,征求意见稿 6 次提到气流流型可视化要求:无菌制剂车间气流流型研究应当可视化、单向流系统的气流可视化研究应当与风速测量相关联,应当根据洁净度级别、气流可视化研究结果、生产操作情况以及风险评估,确定微生物取样点的位置和数量,关键区域监测位置的风险评估还应当考虑气流可视化研究结果等,无菌生产操作人员应当接受气流可视化研究相关内容的培训。
欧盟 GMP 附录 1(2022 版)[2] 和对无菌区设计的要求无菌区中的 A 级和 B 级区域,设计要允许从外部观察内部生产活动。比如设置能全方位查看区域及工艺过程的窗户,或安装远程摄像头,方便监督人员不进入区域就能进行观察和监管,这样可减少人员进入无菌区带来的污染风险。洁净室的气流模式应进行可视化研究证明,气流不会从低级别区域侵入到高级别区域,当空气流动对洁净区或关键区域构成风险时,应采取设计改进等纠正措施,且在制定环境监测计划时,要考虑可视化气流流型研究的结果。
1.2 满足药品生产审计要求
在药企接受各类法规审计和日常监督检查时,车间内的环境参数,如温湿度、压差梯度、洁净度、气流速度等应实时采集数据并可视化展示,确保生产环境始终符合标准要求。如果环境参数出现异常,能够及时采取的措施并能查看报警列表。外部人员能够通过玻璃窗或视屏监控系统实时观察和监控,从而减少人员进入无菌区带来的污染风险。可视化系统记录的大量数据和图像资料可作为有力证据,证明企业在无菌区管理方面的合规性。这些直观、详细的资料能够快速、准确地呈现企业对法规要求的执行情况,减少审计时间和成本,提高审计通过率。
1.3 优化药品生产管理和运营效率
借助数字化建模与仿真技术,对无菌区的布局和生产流程进行可视化模拟,直观地评估不同布局和流程方案的优劣,从而进行科学合理的调整,提高空间利用率和生产效率。借助可视化资料能够快速对操作人员进行培训和考核,提高了操作人员的工作规范性和熟练度;管理人员通过可视化系统及时了解无菌制剂车间的生产进度、设备运行状态、人员工作情况等信息,从而更高效地进行生产调度和资源分配。可视化系统为企业提供了丰富的数据资源,通过对这些数据的分析,企业可以发现无菌区管理中存在的问题和潜在风险,从而有针对性地采取改进措施,不断完善无菌制剂车间的管理体系,优化药品生产管理和运营效率。
Part.02无菌制剂车间可视化设计和管理探索
2.1 透明隔断或观察窗的设置
无菌制剂车间设计初期对操作区域进行合理规划,将 A 级和 B 级区域设置在便于观察的位置(见图 1)。在通道设置透明隔断或大尺寸观察窗实现无菌操作的可视化(见图 2)。透明隔断应采用高强度、高密封性、耐腐蚀的双层中空玻璃,观察窗的位置和模数需经过精心设计,确保监督人员能够全方位观察到内部操作情况。
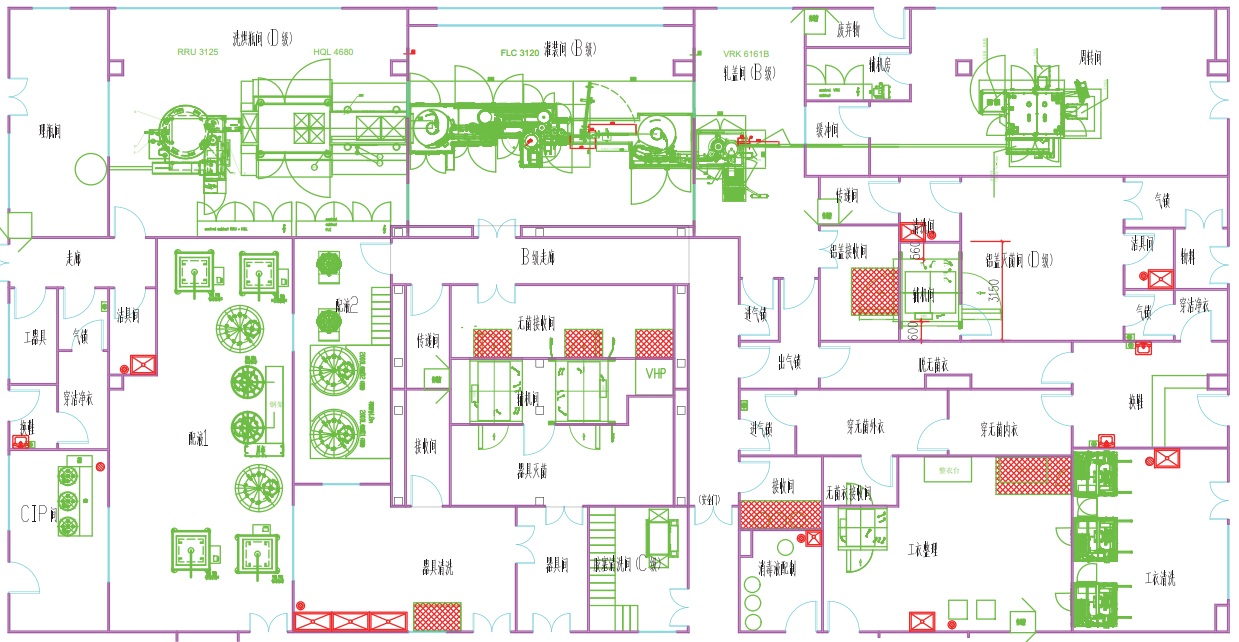
图 1 洗灌封轧盖设备放在便于观察的区域

图 2 观察窗实现无菌操作的可视化
2.2 CCTV 视频监控系统的可视化应用
在无菌区内合理布置高清摄像头,覆盖关键操作区域和设备灌装线、配料区、无菌设备的操作界面,实现对无菌区的实时监控(见图 3)。摄像头应具备高清、低照度、防水、防尘、防腐蚀、易清洁等特性,以满足无菌区的特殊环境要求。摄像头应具备自动跟踪功能,能够根据操作人员的位置和操作流程自动调整拍摄角度,实现对生产操作的全方位、无死角监控。监控视频可以进行录制和存储,以便后续追溯和分析。通过 AI 算法识别异常操作,生成报告及时发现违规操作并进行预警,有效提升了生产操作的规范性和安全性。

图 3 B 级区域 CCTV 视频监控系统
2.3 气流模拟设计、测试与验证可视化
在无菌制剂车间设计阶段,利用流体动力学(CFD)技术的软件工具Fluent,输入送风口和回风口的位置、尺寸、风速,设备的布局,人员的活动路线等,软件能够模拟出车间内的气流流型、速度分布、温度分布等情况。通过对模拟结果的分析,可提前发现气流组织存在的问题,如气流短路、涡流、气流速度不均匀等,并对设计方案进行优化调整。
在无菌制剂车间建成后,需使用水雾发生器产生可见烟雾,进行气流可视化测试,观察烟雾在车间内的流动轨迹,直观展示气流走向,以验证实际气流情况是否符合设计要求。将测试过程录制视频,以便后续分析和存档,为气流模式的评估提供直观依据。气流可视化研究不仅要在静态条件下进行,还需模拟实际操作中的动态情况,如操作员的干预、设备的运行等,以全面评估气流在各种场景下的稳定性和合规性。
2.4 BMS 可视化系统
BMS(Building Management System,楼宇管理系统)系统用于控制空调机房、照明、电力系统等,空调机组(AHU)与 MES 系统对接可根据生产计划自动切换空调系统的运行模式,实现生产流程与环境控制的协同。BMS 控制调节空调机组送风、回风、排风温湿度,总送风量、回风量、排风量,监测初效、中效过滤器的压差,表冷器、加热器的冷热水流量或电加热功率等系统参数(见图 4)。接收 EMS 的环境参数数据(如回风温湿度、压差梯度),自动调整空调系统运行策略(如增加送风量)。监测系统将采集的数据进行分析处理,通过可视化界面展示设备的运行状态。
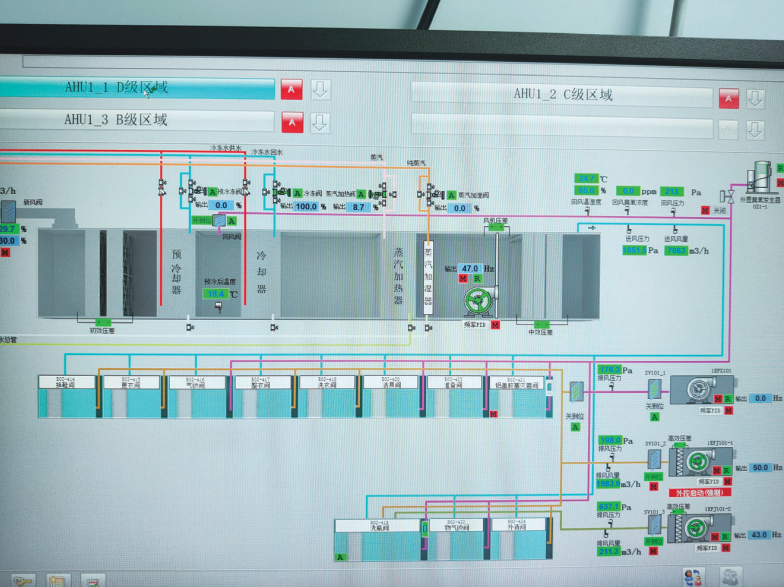
图 4 空调机组和排风系统参数监测
2.5 EMS 可视化系统
EMS(Environmental Monitoring System,环境监测系统)主要监测洁净区域的温湿度、压力梯度(见图 5)、A、B 级区域洁净度尘埃粒子、浮游菌、沉降菌、风速、压差等环境参数,实时连续监测控制(见图 6),并以图表、曲线、数字等形式展示出来,生成趋势曲线,确保药品生产环境条件符合药品质量体系的要求。当参数超出设定范围时,除触发 BMS 的设备控制系统外,还自动发出声光报警信号,提醒相关人员及时采取措施进行调整,EMS 还会记录异常数据并生成报警日志,用于 GMP 合规审计。
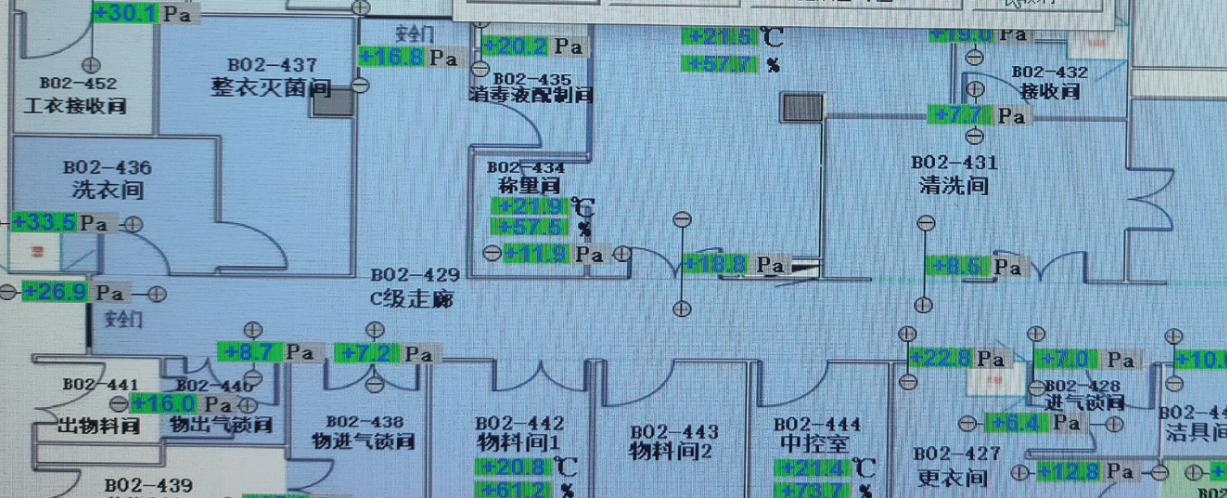
图 5 洁净区温湿度、压力梯度监测

图 6 洁净区环境在线监测
2.6 EAM 企业资产管理系统可视化系统
EAM(Enterprise Asset Management,企业资产管理)是以提高设备可靠性、降低维修成本为目的的企业资产全生命周期管理系统。可视化管控制药企业生产设备、空调系统、水系统等各类资产的采购、安装、调试、运行、维护、维修、报废等各个环节(见图 7)。对车间内的关键设备进行实时监测,包括设备的运行参数、状态、故障信息等。同时实现了设备维护、仪器仪表校准、备件库存等信息的可视化管理,提高了设备维护管理的效率和精准度。同时通过系统对设备维护数据的分析,可预测设备的故障趋势,提前进行设备更新或改造,降低设备故障率,保障生产的连续性。
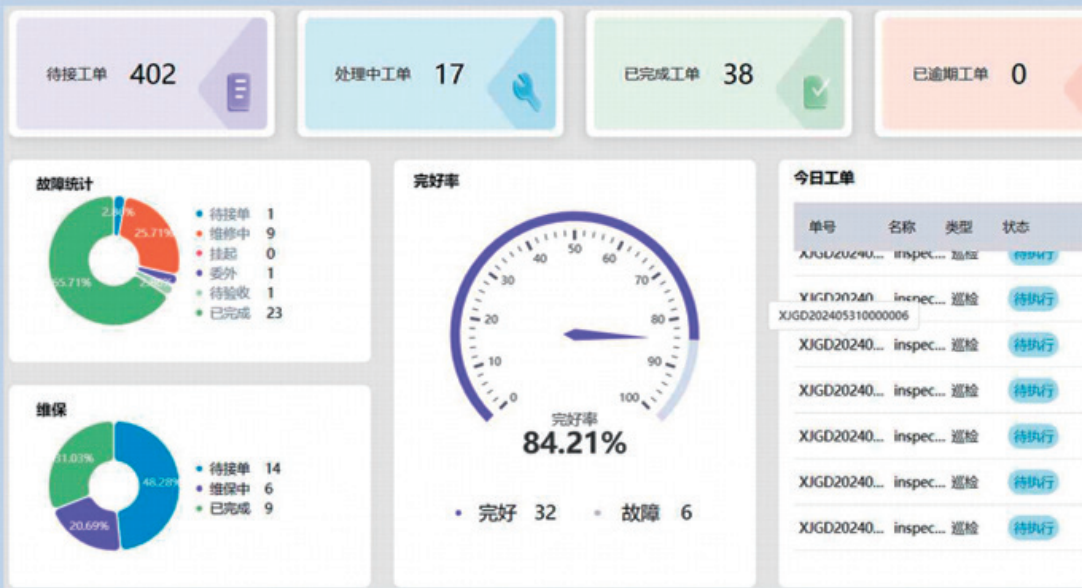
图 7 生产车间资产管理系统
2.7 可视化标识和标签
在洁净车间设置清晰可视化的门禁系统,不同的洁净级别不同颜色标示,设备、管道内容物及流向标识,工作人员在操作过程中可随时参照更衣视频,确保操作的规范性和一致性,减少因人为操作失误带来的污染风险。通过可视化标识和标签,可以帮助操作人员快速识别不同的区域和设备,避免误操作和混淆。同时标识和标签还可以用于指示操作流程、安全注意事项、有毒有害试剂或设备的位置展示安全操作说明和防护要求等信息,提高操作人员的工作效率和安全性。保证人员和物品的流动符合无菌操作规范。
2.8 中央控制室实时集中可视化数据展示
在公司设置中央控制室,将无菌制剂车间的环境参数、设备运行状态、生产进度等可视化数据、监控图像同时集中展示,管理人员可以通过查看屏幕上的数据,及时了解无菌区的运行情况,通过数据的积累利用 AI+IoT+ 机器人技术逐步实现智能化的黑灯工厂。
Part.03无菌制剂车间可视化挑战与应对策略
药品生产数据、设备数据、人员数据以及药品质量数据具有高度的商业敏感性和数据安全风险。制药企业要加强数据安全管理,建立完善的数据安全管理制度和流程,明确数据的使用规范和访问权限。采用先进的数据加密技术,对传输和存储的数据进行加密处理,防止数据被窃取和篡改。部署防火墙、入侵检测系统、数据备份与恢复系统等安全防护设备,构建多层次的数据安全防护体系。提高员工对数据安全重要性的认识,规范员工的数据操作行为,防止因各种因素导致的数据安全事故。
Part.04总结
药品生产质量管理法规 [3] 要求药品生产过程“可追溯、可控制、可验证、可视化”,数据可视化可实时呈现关键工艺参数和过程影像,来确保生产全流程符合法规要求。随着《计算机化系统附录》等法规落地,数据可视化工具满足电子数据的“真实性、完整性、保密性”提供了数据合规和数据安全的双重保障(如审计追踪、权限管理)。无菌制剂车间可视化设计和管理已非“可选配置”,而是法规合规与智能制造的“必选项”。通过数据的直观呈现与深度挖掘,制药企业不仅能满足监管要求,更能以数据驱动生产效率提升与质量风险管控,在制药行业数字化转型中占据先机。
参考文献
[1] 国家药品监督管理局.《药品生产质量管理规范(2010年修订)》无菌药品附录(征求意见稿)[S].2025-03-17.
[2] 欧盟委员会.卷四:欧盟人用与兽用药品GMP指南《附录1:无菌药品生产》[S].布鲁塞尔,2022-08-22.
[3] 中华人民共和国卫生部令.《药品生产质量管理规范(2010年修订)》[Z].2011-02-12
邵丽竹
何发
相关推荐
-
默克如何利用人工智能成为行业标杆企业
人工智能(AI)正成为医疗保健(Healthcare)、生命科学(Life Sciences)和电子科技(Electronics) 领域的颠覆性力量,位于德国Darmstadt的默克集团(Merck)志在引领这一潮流。
2025-09-10 Anke Geipel-Kern
-
qPCR技术:药典 2025 版下生物制品2小时无菌放行方案
在生物制药领域,"无菌"二字承载着千钧之重。从疫苗到单克隆抗体,从血液制品到细胞治疗产品,任何微生物污染都可能导致批次报废、临床风险飙升,甚至威胁患者生命。
2025-09-10 友康生物
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多