20周年特辑 | 论制药洁净厂房的洁净度保证
洁净厂房是制药工厂最关键的设施之一。如果其洁净度不能保证,不但会影响产品质量,还可能会导致长时间的生产中断,从而影响公司的产品供应;同时洁净厂房也是法规审计的重点关注领域。本文将从洁净度的全生命周期管理和消毒灭菌两个方面出发来阐述如何正确地保证制药洁净厂房的洁净度。

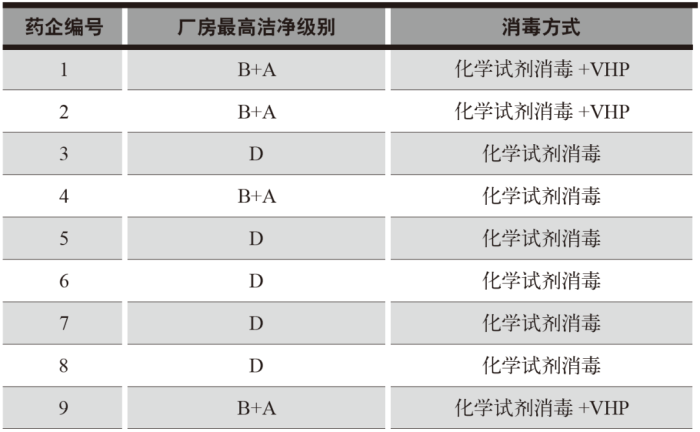
笔者曾经历过三家药企洁净厂房的微生物超标案例,具体情况如表1所示。这三家案例公司的管理层都曾请笔者帮忙解决微生物超标问题,经过现场查看与分析,案例一和三的根本原因很相似,基本是如表2所示的3类。
表2 微生物超标的根本原因
而案例二经过现场查看后,发现有一个预留到B级区(该区域与现有的C级区相通)更衣间的不锈钢镜子的密封胶发生了脱落,导致其背面无法清洁消毒,笔者给出的整改措施是对镜子进行重新固定并密封。
经过上述的整改措施,三个案例的微生物超标问题都解决了。在与案例公司的人员交流过程中,笔者发现公司人员对于保证洁净室的洁净度的思考主要都停留在发生超标时设法杀灭微生物,而缺少预防洁净室微生物超标的意识。这是典型的治标不治本的思路,这种思路可以称之为“杀”,通过超标后杀灭微生物来保证洁净区的洁净度,这显然不符合GMP(药品生产质量管理规范)的期望。正确的思路应该是“防”,即通过合理的预防措施来确保洁净区的洁净度,而这种预防还必须是全生命周期的管理。
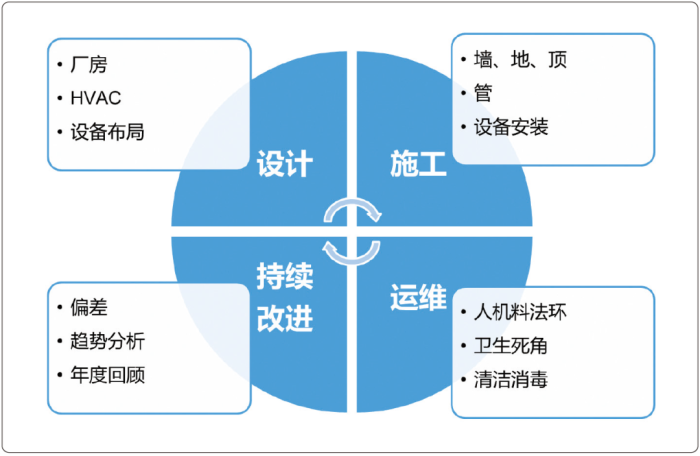
制药洁净厂房的洁净度保证从设计开始就需予以关注,施工的目标是实现设计的期望,运维的作用是保持设计和施工的成果,而后续还需要通过持续改进进一步提升洁净度的可靠性,这四个方面就是洁净度保证全生命周期管理的关键点,如图1所示。
洁净厂房的设计就是“质量源于设计”的应用。设计是基础,设计不充分,后期很难整改,甚至无法整改。对于洁净度控制而言,洁净厂房的设计应重点关注3个方面:
(1)厂房的设计。
厂房设计的考虑要点包括:厂房布局的合理性、选材的合理性、防止污染和交叉污染的合理性、更衣的合理性、缓冲间设置的合理性、人物流的合理性等等。对于生物制药的洁净厂房,还要考虑生物污染的控制。
(2)HVAC(供热、通风及空气调节)的设计。
洁净度的控制主要是通过HVAC的换气或单向流来保证。HVAC设计的考虑要点包括:空调分区设计、洁净度分级设计、压差设计(特别是缓冲间)、回排风设计等等。
(3)设备布局的设计。
GMP的原则是设备不能阻挡气流,所以设备的布局考虑非常重要,设备与送、回、排风口的距离是关键考虑点。
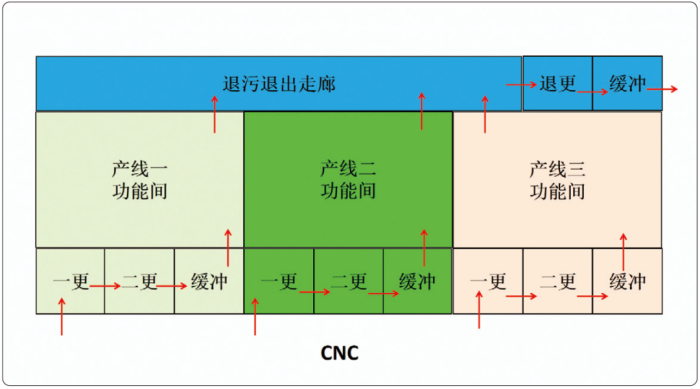
下文将以一个简化版的案例来说明,其初始设计如图2所示。这是一个生物制药的病毒车间,为了易于说明,暂不考虑其物流。由于是病毒车间,更衣间和退更间需独立。
图2 初始设计(设计一)示意图(注 :红色箭头表示人流路线)
(1)空调配置:三条产线相互独立,各自配备独立的空调系统,退污退出走廊和退更间配备一套独立的空调系统。
(2)压差:功能间压差高于退污走廊,所有缓冲间都是正压缓冲。
(3)洁净级别:三条产线均为C级;退污退出走廊为C级。
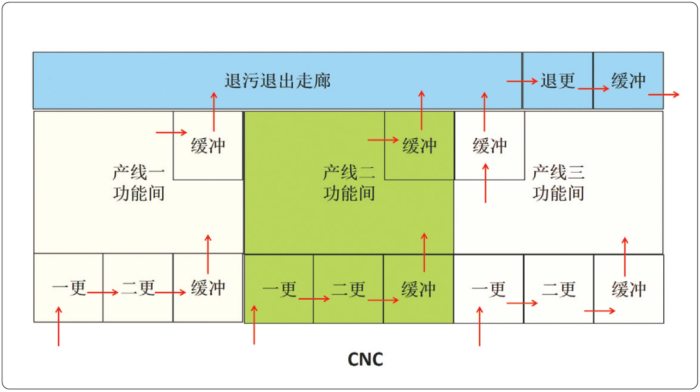
由于各功能间的污物量比较大,无法通过传递窗传递。如果通过各功能间和退污退出走廊的门传出,这个门需频繁开关,显然不合理,存在风险:退污退出走廊属于脏区(有污染过的生物活性废物),可能影响功能间。所以还应在各功能间和退污退出走廊之间增加缓冲间,如图3所示。通过缓冲间的隔断可以避免这种污染的可能性,这个缓冲间设计为梯度缓冲间。采取这样的设计后,由于有了缓冲间,退污退出走廊的洁净级别可以降为D级。
图3的设计看起来似乎没有问题了,但是结合生产的实际情况,还是存在交叉污染的风险。譬如,三条生产线都在生产,空调都开启,该设计是没有问题的;但实际生产中,可能有一条生产线或两条生产线在一段时间内并不生产。假定产线三停产,产线三这个区域的空调系统便是关闭的,房间都没有压差;但由于产线一、二在生产,退污退出走廊的空调是开启的,其房间为正压。在这种情况下,退污退出走廊的风就会通过缓冲间进入产线三的房间,从而污染产线三的区域。这种问题的解决方案也很简单,使三条产线退到退污退出走廊的缓冲间与退污退出走廊共用一套空调即可。如此,缓冲间的正压便可以防止前述污染的发生。
可能有读者已经想到更好的解决方案,就是将三条生产线的更衣间、功能间、退污退出走廊全部设计成独立区域,配置独立空调(称为设计三),这样就不会有前述的问题。但这里面有两个限制条件需明确:
(1)设计三需要更大的空间,如果厂房足够大,这样设计是不错的。
(2)文中的是简化的示例图,其实退污退出走廊是要配备灭活间和灭活设备的,设计一和二的思路就是共用灭活间和灭活设备,减少空间需求和设备投入。但如果按照设计三的思路,各产线还要配备独立的灭活间和灭活设备,并且在实际的案例中生产线有可能是多于三条的,如果全部独立,对厂房的需求和设备投入会增加很多。
设计再好,若施工安装不到位,也无法实现设计的期望。施工时同样需要关注3个方面:
(1)墙面、地面、吊顶。这是洁净厂房施工最关键的部分,也是施工中涉及最多的部分。安装的平整度、弧度、密封性等都有相关的规范要求,必须按规范施工,按规范验收。
(2)管路施工。洁净室不可避免地会有管路,对于穿墙、穿顶的管路需要特别注意。施工的牢固性和密封性尤其重要。还有洁净室的管路如需要保温,也是有特殊要求的。
(3)设备安装。设备安装的位置不能留有不能进入清洁的背面和侧面。侧面或背面紧靠墙面的,建议用密封胶密封。若设备顶部较高、距离吊顶较近,建议用不锈钢板围到吊顶,然后用密封胶密封。不建议通过自刹车的滚轮固定设备,建议用密封胶密封设备的固定脚与地面接触处。
本文开头提及的三个案例中,现场发现的卫生死角基本都属于这三方面的问题,即初始安装不到位、后期运维没解决,从而导致微生物超标。
好的运维能够把好的设计和施工的成果长期保持下去,同时纠正和改进设计与施工的不合理方面。运维需关注的3个方面如下:
(1)人机料法环。
人的更衣和操作要符合要求;机器、设备、工具的选择和使用要符合要求;物料不能带入污染;各种操作方法要按SOP(标准作业程序)和GMP规范进行;注意对洁净环境的保护。在前文提及的一个案例中,洁净区使用的榔头由木柄插入榔头槽组成,这是一个错误的选择:本来木头就不应该出现在洁净区,更何况槽和木柄结合处的死角是无法清洁消毒的。类似工具还有很多,必须多加注意。
(2)卫生死角。
首先要培养生产、工程、QA(质量保证)人员发现卫生死角的能力;然后一旦发现卫生死角,应立即分析原因并采取CAPA(纠正和预防措施)。在前文的案例中,现场的人员便对卫生死角缺少认识和理解,缺乏发现的能力,亟待培养。
(3)清洁消毒。
清洁、消毒的要求,以及所用试剂的要求,很多公司的员工都有所了解。但是清洁消毒的效果有时候却差异很大,这是因为他们清洁消毒的全面程度有所不同,确保清洁消毒的全面性是个中关键。在前文的案例中,一家药企的很多设备下面的地面从未清洁消毒,如隔离器、二氧化碳培养箱、离心机等设备下面的地面。清洁消毒SOP的细节关注和全面性(譬如详细的清洁消毒位置点清单)很重要。同样重要的是清洁消毒人员的认识,这些人员如果缺乏对清洁消毒的作用、逻辑、GMP符合性的认识,便很难保证在实际操作中做到没有遗漏。关于清洁消毒,目前很多药企都采用臭氧熏蒸,这需要慎重,具体原因将在本文第二部分进行阐述。
通过偏差调查、日常监控的
数据趋势分析和年度回顾来发现深层次的原因,然后采取相应的CAPA,这样可以长期地保证洁净厂房的洁净度,显然前文的案例一和三的持续改进并未发挥完整的作用。这方面可查的相关规范和资料有很多,本文限于篇幅就不再作详细阐述。
设计、施工、运维、持续改进涵盖了洁净厂房的全生命周期,通过各阶段各方面的合适管理,才可能确保制药洁净厂房的洁净度,预防微生物超标问题的出现。
笔者曾在跨国药企连续工作超过15年,经历的洁净厂房既有D级的固体制剂厂房,也有A、B级的无菌制剂厂房,洁净厂房的清洁消毒都是采用化学试剂擦拭。近几年工作和接触的一些药企,其洁净厂房除了采用化学试剂擦拭的清洁消毒方式外,还采用了用臭氧熏蒸消毒方式。并且对于新厂房的设计,设计方都设计了臭氧熏蒸方式。为此,笔者进行了相关的调研和查询,把相关结果分享如下。
(1)臭氧是消毒,不是灭菌。通常说的灭菌,要能够达到降低6个log单位的微生物的水平,臭氧是做不到这点的。
(2)关于臭氧残留对药品的影响,目前没有公认的验证方法。这不满足GMP附录1无菌药品第四十五条:“必要时,可采用熏蒸的方法降低洁净区内卫生死角的微生物污染,应当验证熏蒸剂的残留水平。”
(3)臭氧消毒有三个关键参数:浓度、湿度和时间。GB 28232 《臭氧消毒器卫生要求》中的7.1.2节规定:“空气消毒应在封闭空间,室内无人的条件下进行,一般臭氧浓度5 mg/m3~30 mg/m3,相对湿度≥70%,作用时间30 min~120 min。”在实际应用中,很多药企只控制了浓度和时间,湿度是经常被忽略的参数。查阅资料显示:“相对湿度<45%,臭氧对空气中悬浮微生物几乎没有杀灭作用,在60%时才逐渐增强,在95%时达到最大值。”由于洁净厂房的湿度本身要求都是不超过60%,所以若不在臭氧消毒过程中另外考虑加湿控制,是几乎没有消毒效果的。
(4)臭氧会加速橡胶制品的老化,洁净厂房的很多设备密封材质都是橡胶类。
其次,对于熏蒸,查阅的相关法规均未提及臭氧,臭氧不是法规建议的制药洁净厂房消毒方式,具体查阅的法规如下所示。
(1)我国药品GMP指南第2版无菌制剂册,列举的试剂不包括臭氧:
熏蒸方法可以产生很好的表面消毒效果,但需要更长的时间来确保消毒剂或杀孢子剂的充分扩散和足够的表面接触时长。雾化法会产生非常细小的消毒剂液滴,而气体法则使用气体形式的消毒剂。虽然两者都非常有效。但均不具备表面清洁的能力。因此,如果不使用常规机械清洁动作来清洁待消毒表面,采用的熏蒸方法也可能导致残留物水平高、颗粒物包裹、表面腐蚀等情况,并且还会因为消毒剂或杀孢子剂无法消除微生物污染从而增加微生物污染水平。该方法常用过氧乙酸、过氧化氢、苯酚、漂白剂、季铵盐、多聚甲醛和二氧化氯等化学试剂。由于潜在的职业暴露及爆炸危险,在使用这些试剂时需要特殊的安全考虑。
(2)欧盟GMP附录1无菌药品生产的4.36条列举的试剂也未包括臭氧:
4.36 Where fumigation or vapour disinfection (e.g. Vapour-phase Hydrogen Peroxide) of cleanrooms and associated surfaces are used, the effectiveness of any fumigation agent and dispersion system should be understood and validated.
参考翻译:如果洁净室和相关表面使用熏蒸或蒸汽消毒(如过氧化氢蒸汽),应了解并延后所用熏蒸剂和分散系统的有效性。
(3)PDA(美国注射剂协会)技术报告TR70无菌生产设施的清洁消毒程序原理中的7.10条“Types of Clean Room Disinfecting Agents”(洁净厂房消毒剂种类)罗列了各种消毒剂、灭菌剂、杀孢子剂,未提及臭氧。
再次,笔者也咨询了行业内资深专家,这位专家的回复主要有如下3点信息:
(1)他从事了超过40年的制药洁净厂房工作,从未使用过臭氧熏蒸洁净厂房,臭氧多用于纯水消毒。
(2)化学试剂擦拭是制药洁净厂房的通用清洁消毒做法,有些药企也使用VHP熏蒸作为辅助措施,这一般是在超标后的杀灭或长期停产的恢复生产前使用。
(3)VHP熏蒸是无菌产品暴露区域(厂房、隔离器)的常用措施。
最后,笔者还进行了行业内的调研,
设计了调查问卷,发给制药行业内的人士填写。最终收到32份回复,数据显示:除了通常的化学?试剂清洁消毒外,有14家药企选择了VHP作为洁净厂房的辅助灭菌,其中11家都是外资企业。同时对调研的9家大型跨国药企(销售额排名前20的跨国药企)单独分析。发现两个信息:
(2)化学试剂消毒是主要方式,VHP为辅助方式。详细信息如表3所示。
综合上述研究,笔者得出结论:对于制药洁净厂房的消毒而言,化学试剂清洁消毒是常用方式,VHP灭菌可以作为辅助,臭氧熏蒸的选用需慎重。
关于制药洁净厂房的洁净度保证,必须对设计、施工、运维、持续改进这四个方面进行全生命周期的管理,预防洁净度超标的发生。而清洁消毒是保证洁净厂房洁净度的重要措施之一,因此必须选择合适的清洁消毒方式。
撰稿人 | 姚中华 云舟生物科技(广州)股份有限公司基因递送研发生产基地项目负责人
责任编辑 | 胡静
审核人 | 何发




















评论 0
没有更多评论了