qPCR技术:药典 2025 版下生物制品2小时无菌放行方案
在生物制药领域,"无菌"二字承载着千钧之重。从疫苗到单克隆抗体,从血液制品到细胞治疗产品,任何微生物污染都可能导致批次报废、临床风险飙升,甚至威胁患者生命。对生物制药企业而言,确保产品质量不仅是生产的基本要求,更是保障患者安全、维护企业声誉、符合法规要求、推动行业创新以及适应市场需求的关键所在,而其中无菌检测作为产品质量控制的核心环节尤为重要。
药典规定传统无菌检测方法(薄膜过滤法与直接接种法)作为"金标准",其强制14天培养周期源于微生物学的客观规律:
产气荚膜梭菌、黑曲霉等慢增殖微生物,需在模拟人体环境的培养基中培养 14 天才能可靠检出;
为实现 “零漏检” 安全目标,需覆盖最慢生长微生物的增殖周期,采用保守检测策略。
Part1 时效性之困:短周期生物制品的检测难题与破局挑战
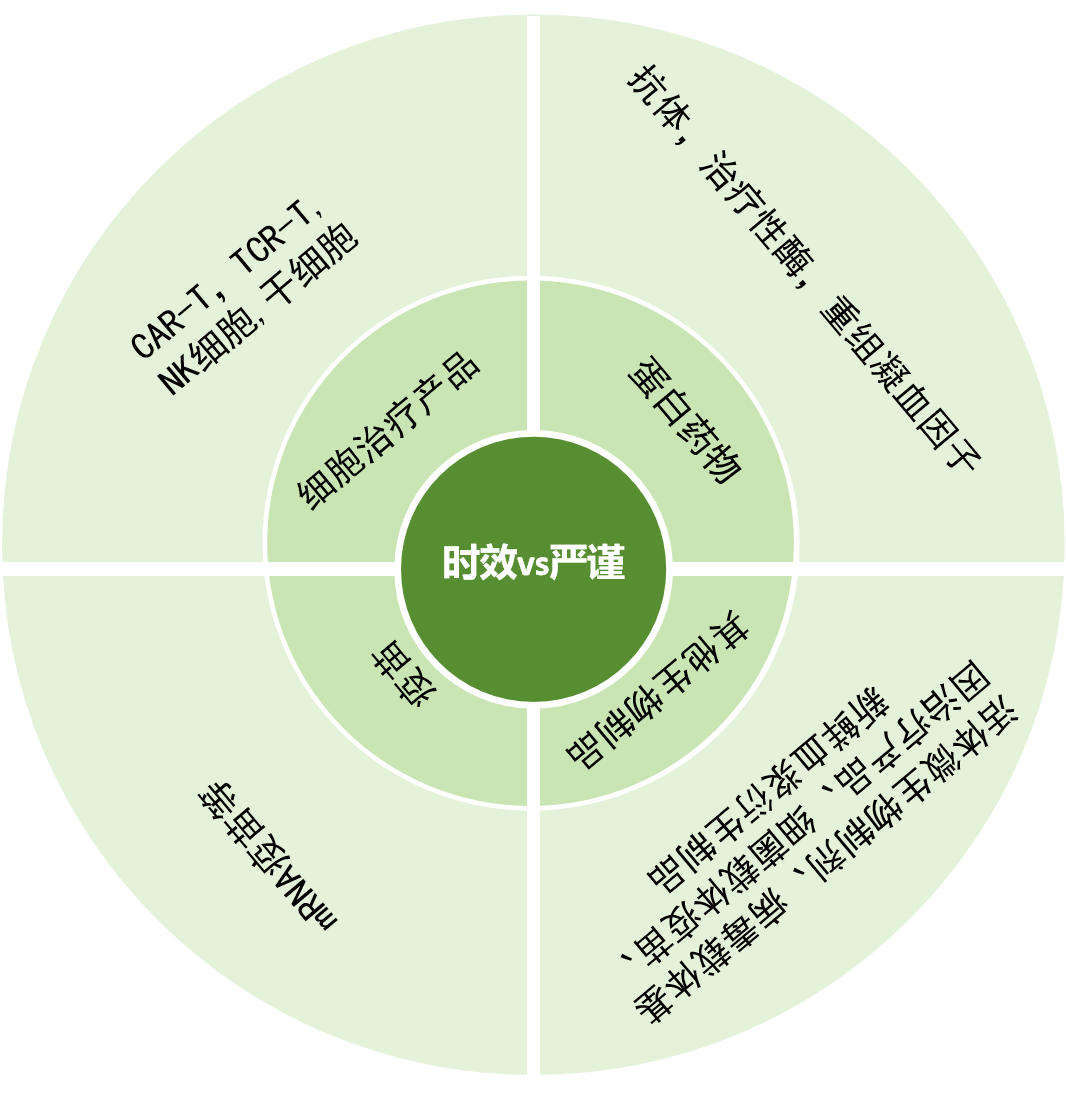
然而,这一严谨性正与日益增长的生物制品时效性需求形成根本性冲突,尤其对于以下几类关键产品而言,漫长的等待期不仅意味着效率的损失,更潜藏着巨大的质量风险与临床危机:
短效细胞治疗及移植产品受检测周期冲击显著:CAR-T疗法从采集到回输仅7天,但14天检测未完成时改造T细胞已失活;TCR-T、NK细胞疗法亦受7-14天制备周期限制。更严峻的是,部分新鲜造血干细胞移植样本活性仅维持数小时至数天,与14天检测周期完全冲突。
mRNA疫苗冷链管理矛盾突出:需-70℃超低温储存且对温度波动敏感,14天等待期延长冷链故障风险,检测过程本身还加速了疫苗的降解。
稳定性差蛋白类药物(如戈谢病酶制剂、血友病重组凝血因子)在溶液中半衰期仅数小时至数天,14天检测导致活性显著衰减,既丧失疗效,还可能因蛋白结构改变引发安全隐患。
其他短存活期产品(如活体微生物制剂、AAV病毒载体、卡介苗、解冻后4小时内使用的凝血因子复合物)因活性成分存活窗口极短(数小时至数天),亟需时效性检测以避免快速失效。
传统长周期检测不仅拖慢产品上市节奏,更在等待中埋下质量隐患:若检测发现质量问题,前期投入将付诸东流,且延误患者治疗。部分企业尝试用《9406指导原则》推荐的呼吸信号法(压缩至5-7天)缓解矛盾,但该法设备成本高、操作复杂,对中小企业形成技术壁垒,难以满足细胞治疗、mRNA疫苗等领域"当日放行"的迫切需求。
Part2 新规护航:《中国药典》2025 版开启 qPCR 快检时代
《中国药典》2025 版堪称关键里程碑,它不仅将核酸扩增技术(涵盖 qPCR)正式纳入附录,更在《9201 药品微生物检验替代方法验证指导原则》修订中,为 qPCR 等快速微生物检测方法(RMMs)构建科学验证框架。
这些检测技术作为传统药典方法的替代,是对药品微生物质量控制方法的创新与拓展。这些技术通过原理创新(突破微生物培养限制)与效能跃迁(检测速度提升10倍级),重构了无菌质控范式,为解决传统方法检测周期长的问题提供了可能。特别是在无菌检查这类定性试验中,qPCR 无菌快速检测技术凭借其快速识别活微生物的能力,显著缩短了检测时间,从而大幅提升了生产效率。

此次修订顺应技术发展、贯彻风险监管、衔接国际标准,主要体现在以下三方面:
01技术适配:突破 qPCR 等新技术验证瓶颈
基于核酸技术(如 qPCR、NGS)、生物传感器、流式细胞术等的快速微生物检测方法(RMMs)已渐趋成熟。这类技术优势显著,在实时性方面,例如无菌检测时间能够从传统的 14 天大幅缩短至数小时;在灵敏度上,可精准检测低至单细胞水平的微生物。然而,2020 版 9201 指导原则对于非生长依赖型技术的验证框架存在明显不足,比如未对核酸扩增技术的假阳性控制要求作出明确规定。2025 版则通过技术分类的进一步细化(例如清晰区分“生长信息检测”与“成分分析技术”),以及专属性挑战的强化(如开展干扰物质评估),为新技术的验证工作提供了科学合理的路径指引。
02监管革新:落实 ICH Q9 场景化风险管理
ICH Q9 原则促使验证要求从传统的“一刀切”模式向场景化风险管理方向转变:
过程控制:允许在准确度要求上适当放宽(例如接受相关性证明),但必须强化重现性和中间精密度的验证工作,以此确保实时监控过程的稳定性。
终产品放行:要求所采用的方法“不劣于药典方法”,需通过平行试验和全面的风险评估,并且部分情况可能还需获得监管部门的批准,从而切实保障患者的用药安全。
03标准接轨:加速国产创新技术国际化
修订后的 9201 指导原则与 USP <1223>、EP 5.1.6 等国际指南逐步趋同。例如,引入了风险导向的验证参数(如过程控制更侧重于灵敏度而非绝对准确度);要求设备类方法进行 4Q 确认,这与 PDA TR33 等国际文件的要求保持一致。这一系列举措为跨国药企在华开展生产活动提供了统一标准,有力地加速了国产创新技术走向国际市场的步伐。
Part3技术解码:qPCR 的原理、分类与核心优势
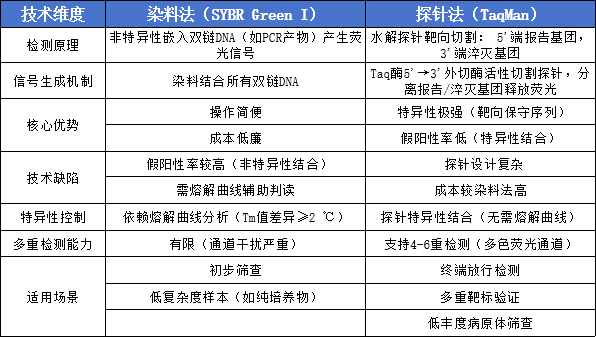
qPCR(定量聚合酶链反应)通过在 PCR 扩增过程中监测荧光信号变化,实时检测扩增产物量,实现对起始模板的定量。根据荧光产生原理,主要分为染料法(SYBR Green I)和探针法(TaqMan)两类,具体对比如下:
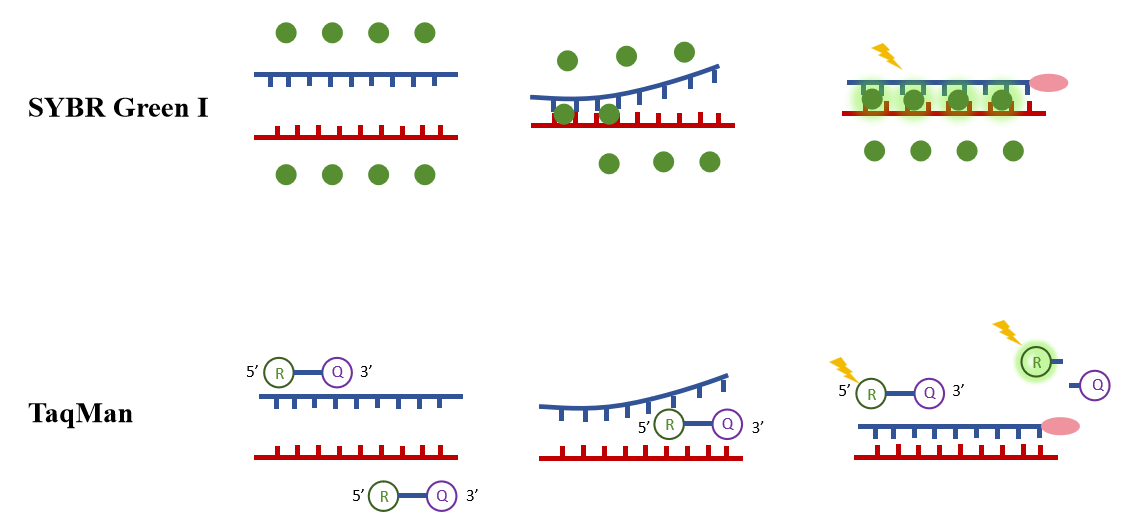
下图直观显示了两种方法的检测原理:
qPCR技术在细胞类生物制品无菌放行检测中优势显著:
灵敏度高、特异性强:可精准识别低拷贝目标核酸(如残留病毒、支原体),大幅降低漏检风险,源头保障安全。
快速高效:检测流程(提取、扩增、分析)数小时完成,远快于传统培养法的数天至数周,有力支持快速放行。
操作简便:流程标准化程度高,仪器需求低,降低实验门槛和成本,适合高通量处理。
定量稳定:精确量化目标分子(如污染物或特定基因),提供客观质量数据;优异重现性确保批次间结果稳定可靠,为产品质量一致性和长期安全性提供坚实依据,是保障细胞制品安全有效的理想技术。
Part4 解决方案:友康生物2小时快检体系
目前全球微生物技术行业增长态势良好。预计2026年全球微生物检测市场规模将达69亿美元,在中国,微生物技术行业也取得了显著进展。例如,2022年中国微生物检测市场规模为96.5亿元人民币,同比增长22%,显示出国内市场对微生物技术的强劲需求。生物医药推动微生物技术发展,预计中国生物医药2025年将达8310亿元。技术上,传统培养法被PCR、基因测序等取代,自动化与AI提升检测效率。基因编辑、合成生物学助力菌株优化。微生物行业市场竞争激烈,但市场集中度较高,国际巨头占优,在中国市场上,随着国内生物技术的不断发展和创新,一些本土企业也在微生物技术领域取得了显著进展。
友康生物科技(北京)股份有限公司,成立于2006年,基于19年在无血清细胞培养与分子诊断领域的技术积淀,友康生物开发了覆盖细菌、真菌及支原体检测的快速无菌检测试剂盒系列。该系列产品采用国际主流的TaqMan探针法技术路径,通过多通道荧光探针的创新组合:
细菌检测:使用FAM(目标序列)和ROX(内参对照)双通道探针
真菌与支原体检测:使用FAM(目标序列)和HEX(内参对照)双通道探针
以2小时极速检测突破传统14天培养周期的瓶颈,在大幅提升检测效率的同时,确保高灵敏度与广谱环境污染物精准筛查。其通过"一提三检"技术(细菌、真菌、支原体一体式核酸提取试剂盒+三种微生物检测试剂盒实现"一次提取,三种检测"),结合特异版/广谱版灵活选择,构建高度合规的微生物快检体系。该体系严格满足中国药典、美国FDA及欧洲药典等全球标准,通过双荧光探针的协同作用既实现目标微生物的精准检测,又确保检测过程的质量控制,为细胞治疗产品提供兼具速度革命、精准靶向与全链条无菌保障的本土化解决方案。
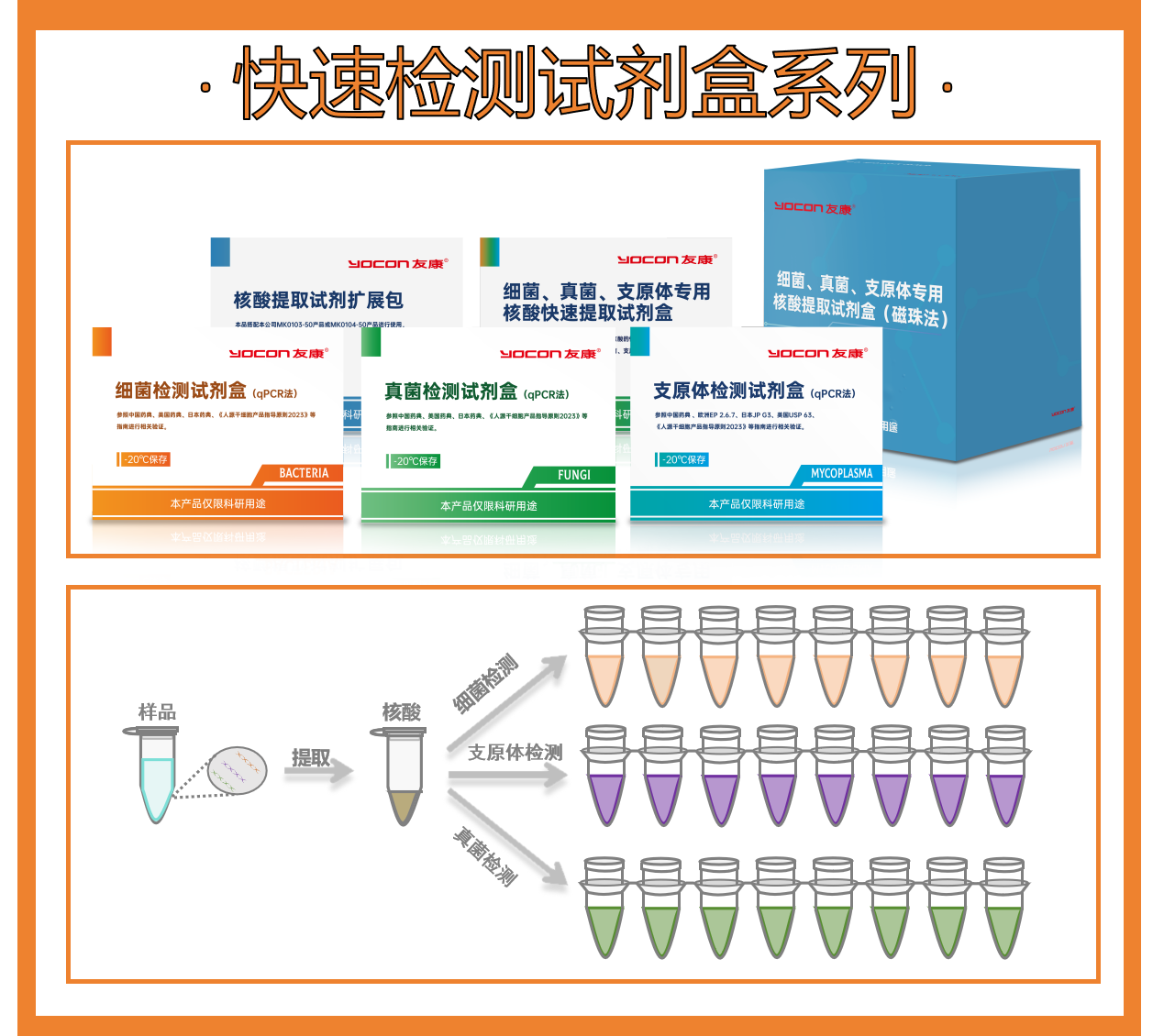
01细菌、真菌、支原体专用核酸快速提取
试剂盒友康生物研发的细菌、真菌、支原体专用核酸快速提取试剂盒,适用性强,提取得到的核酸,可搭配本公司细菌、真菌和支原体三种核酸检测试剂盒进行使用。操作方便,样本处理能力强,最快三步操作,可在四十分钟内完成核酸的提取。

02细菌、真菌、支原体专用核酸提取试剂盒
友康生物研发的细菌、真菌、支原体专用核酸提取试剂盒,适用性强,提取得到的核酸,可搭配本公司细菌、真菌和支原体三种核酸检测试剂盒进行使用。搭配扩展包,排除干扰,只检活菌。

两款核酸提取试剂盒性能对比(下图)

03细菌检测试剂盒(qPCR法)特异版&广谱版
友康生物研发的细菌检测试剂盒(qPCR法)特异版&广谱版,基于荧光定量 PCR(Taqman 探针法)技术,经过充分验证,可在2小时内定性检测如培养基、细胞培养物以及生物制品中是否有细菌污染。

已参照qPCR微生物定性检验方法进行验证(下表)
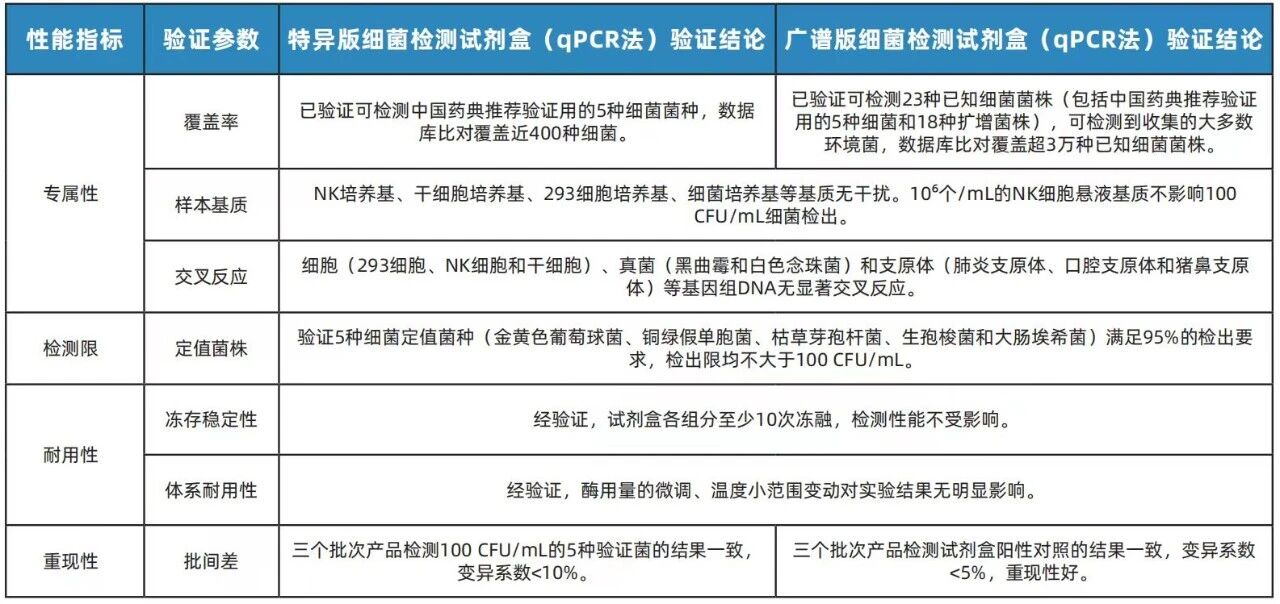
04真菌检测试剂盒(qPCR法)特异版&广谱版
友康生物研发的真菌检测试剂盒(qPCR法)特异版&广谱版,基于荧光定量 PCR(Taqman 探针法)技术,经过充分验证,可在2小时内定性检测如培养基、细胞培养物以及生物制品中是否有真菌污染。

已参照qPCR微生物定性检验方法进行验证(下表)
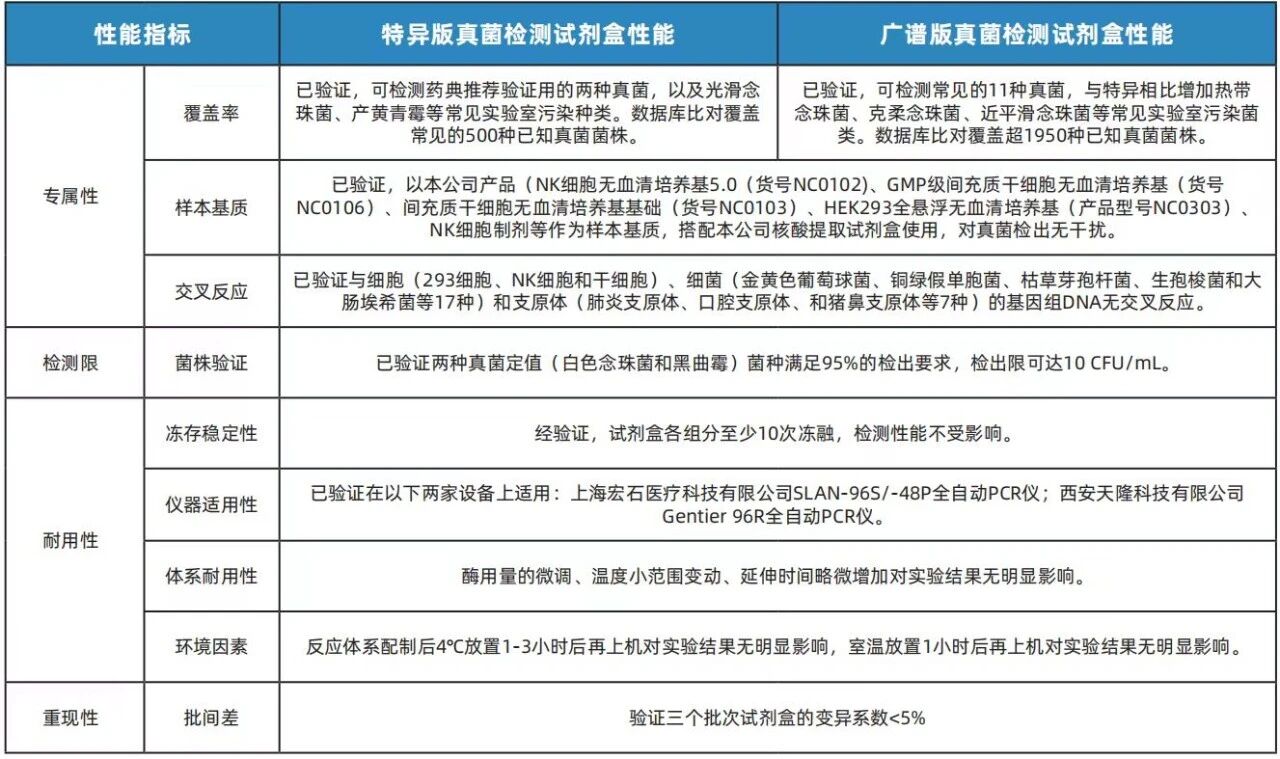
05支原体检测试剂盒(qPCR法)
支原体检测试剂盒(qPCR 法)基于荧光定量 PCR 技术,采用多重 PCR 的方法定性检测培养基、细胞培养物以及生物制品中是否有支原体污染。本试剂盒可检测的支原体种类涵盖范围广,具备灵敏度高、特异性好,稳定性好等特点,与支原体进化树上的近缘物种、其他常见细菌、真菌以及细胞DNA均无交叉反应。

Part5两小时革命:从检测台到患者床边的生命加速
当无菌检测从“两周”压缩至“两小时”,生物制药行业获得的不仅是效率提升,更是对生命的重新敬畏。qPCR技术正在重塑的不仅是质控标准,更是整个产业对安全与速度的平衡哲学——这场始于检测台的革命,终将抵达每一个等待救治的患者床边。

若对相关产品感兴趣,可扫码联系友康生物获取更多信息。

【直播预告】友康生物将于2025年9月11日(周四)14:00开启线上直播,主题是“告别14天等待!生物制品无菌快检2小时放行技术深度解析与应用”,将由友康生物技术专家在微信小程序小鹅通直播分享,扫描海报二维码,预约观看直播。我们直播间见!
邵丽竹
何发
相关推荐
-
粉针无菌分装过程中影响粉针剂质量的因素探究
在粉针无菌分装过程中存在诸多不稳定的因素能够对粉针剂质量造成影响,这些因素主要包括尘埃粒子、微生物、包装材料、压差、空气温度和相对湿度等。 因此,本文针对上述因素进行了讨论,旨在能够引起业界的重视并为完善粉针的制备流程和操作规范提供参考。
2025-06-06 朱琳
-
药品微生物检验洁净室中常见环境菌的消毒效果研究
通过对药品检验洁净室中常用的消毒剂进行效能验证,进而控制潜在的微生物污染风险。本研究采用悬液定量杀灭试验法,利用已知的标准菌株及从洁净区采集的已鉴定环境菌,对甲酚皂、新洁尔灭、75%乙醇和杀孢子剂等4种常见消毒剂的杀菌效果进行快速评估。结果显示,在各种消毒剂对菌株的杀灭效果中,当作用时间不同时,会呈现出显著的差异。
2025-06-03 | 刘蓉 赵晓冬 王丹等
-
注射剂到底该怎么确定灌装量才能降低发补风险
近年来针对化学仿制药注射剂过量灌装的发补通知逐年增多,审评老师大体会问(1)过量灌装的合理性,(2)过量灌装的量制定的合理性,(3)并结合临床用法及本品和参比制剂复溶后抽取情况予以说明,审评老师的灵魂三问直击化学仿制药注射剂过量灌装的本质,令对化学仿制药注射剂过量灌装缺乏科学性、合理性研究的药企手足无措。
2025-05-30 药事纵横
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多