生物制药 300 L 独立混合罐灭菌工艺验证研究
为验证生物制药生产中两台 300 L 独立不锈钢混合罐的灭菌工艺稳定性及无菌保证效果,采用山东新华 XG1.D 型脉动真空高压蒸汽灭菌器,设定脉动抽真空 3 次、真空限度 -80 kPa、121℃灭菌30 min 的工艺参数,开展三次独立验证试验。通过 Ebro 温度压力记录系统(10 个探头测热分布、6 个探头测热穿透),结合 ATCC7953 嗜热脂肪芽孢杆菌孢子生物指示剂与化学指示卡,进行热性能测试、微生物挑战及化学验证,利用EbroWinlog.Validation V3.71 软件计算各点 F0值。
结果显示,三次试验中热分布温度波动度≤1.95℃、均匀度≤1.32℃,最低温度≥121.05℃,F0值均远超15min;热穿透测试中两台混合罐上中下各位置最低 F0 值达35.32min,生物指示剂培养后均无菌生长,化学指示卡均符合标准。该工艺通过多维度验证,可确保混合罐各部位灭菌充分且一致,F0值与生物指示剂杀灭结果均满足接受标准,工艺稳定可靠,符合药品生产质量管理规范(GMP)要求,适用于实际生产。
在生物制药领域,无菌生产是确保药品安全性和有效性的核心环节。与产品直接接触的设备、容器和管路必须经过有效的灭菌处理,以消除所有可能存在的微生物污染风险[1]。对于大型固定设备(如混合罐),蒸汽灭菌因其高效、可靠而成为首选方法。根据中国《药品生产质量管理规范(2010 年修订)》及其相关附录的要求,关键的灭菌工艺必须经过严格的验证,以证明其重现性和有效性[2]。灭菌工艺验证通常包括安装确认(IQ)、运行确认(OQ)和性能确认(PQ),其中性能确认的核心内容即为热分布和热穿透测试,并结合微生物挑战试验[3]。本研究旨在依据法规和行业标准,对某生物制品生产企业用于物料混合的两台 300 L 独立不锈钢混合罐的灭菌工艺进行全面的性能确认。通过科学布点及连续三次试验,系统评估灭菌器腔室及罐体内部的热力学性能和实际灭菌效果,为该工艺在生产中的应用提供可靠的数据支持。
Part.01 材料与方法
1、设备与仪器
验证试验采用经确认符合规范要求的灭菌设备、待灭菌混合罐系统以及校准合格的数据采集装置,具体配置与技术参数如下:
灭菌设备:采用 XG1.D 型脉动真空灭菌器(由山东新华医疗器械股份有限公司生产),产品标准为YZB/鲁0237-2008,注册号为鲁食药监械(准)字 2008 第2570278号。容器设计温度为150℃,容积为 2.5m3。本次验证参数设定为:脉动抽真空 3 次,真空限度为-80kPa,温度 121℃,灭菌时间 30min ;
待灭菌设备:包括两台 300L 不锈钢独立混合罐(由上海森松制药设备工程有限公司制造,编号分别为罐1、罐 2),工作容积为 0.3m3,执行标准为 NB/T47003.1-2009。每台罐的进、出液口均配置赛多利斯 0.2μm PTFE膜 Midisart 2000 空气过滤器(型号17805G);
数据采集系统:使用 Ebro 温度压力记录仪(温度探头 EBI12T 的量程为 -85℃ ~+150℃ ;压力探头 EBI12-TP 的量程为 -0.09~1 MPa),配套读卡器 EBI-IF-200,数据处理软件为 Ebro Winlog.Validation V3.71(具备 F0 值计算与审计追踪功能)。所有探头均在有效校准期内(校准证书编号 ACC-20250218116 由北京艾科瑞斯科技有限公司出具)。
2、生物与化学指示物
本验证选用符合药典标准的生物指示剂与化学指示卡作为灭菌效果直接监测与过程参数确认工具,其具体配置与性能参数如下:
生物指示剂(BI):选用嗜热脂肪芽孢杆菌孢子(ATCC7953),孢子量为 1.0×106 ~ 5.0×106CFU/ 支,D121℃值为 1.5 ~ 3.0 min[4]。每批次试验使用 16 支,由 TerragenS.A. 提供;
化学指示卡:采用新华牌 121℃压力蒸汽灭菌化学指示卡,批号为24M02,由山东新华医疗器械股份有限公司提供。
3、方法
本研究通过规范化的探头布点、连续灭菌循环测试、F0值计算、生物指示剂判读以及接受标准设定五个关键环节实施验证,具体方案如下。
探头布点方案
探头布点方案针对热穿透测试和热分布测试分别制定如下布置策略,并配套设置相应监测组件:
热穿透测试:在两台混合罐内部各布置3个温度探头,分别位于罐内上部、中心部和底部。每个探头旁同时放置一支生物指示剂和一张化学指示卡;
热分布测试:在灭菌器腔室内布置10个温度探头。位置包括:上左前、上左后、上右前、上右后、下左前、下左后、下右前、下右后、中心处以及空载验证确定的冷点位置[5]。另有一个带压力探头的记录仪置于冷凝水排放口。
试验过程
连续进行三次独立的灭菌循环,每次均按照设定的灭菌程序运行。数据记录系统自动记录各监测点的温度 -时间数据。
F0值计算
参照制药行业灭菌验证技术规范,软件根据如下公式自动计算各探头的累计 F0 值。
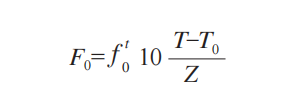
参数设定:T= 实时温度,T0=121.1℃,Z=10℃。本次实验起始温度为100℃,累计的致命目标时间需≥15min[6]。用于等效换算灭菌时间,以确保无菌保障。
生物指示剂培养与判读
灭菌结束后,取出生物指示剂,并将它置于 58 ~ 62℃恒温培养箱中进行培养。分别于 10 h 和 14 h 观察结果,总培养时间为 24 h 。判定标准为:所有测试的生物指示剂均不变色(表示无菌生长),同时阳性对照生物指示剂变色(表示有菌生长[7],方为合格。
接受标准
接受标准的具体要求如下:
热分布:腔室内各点温度需在121℃及以上维持时间≥ 30 min,且温度波动度和均匀度需符合设备性能要求;
热穿透与 F0 值:各混合罐内部最冷点的 F0 值≥ 15 min ;
生物指示剂:所有测试的生物指示剂均无菌生长;
化学指示卡:颜色变化达到或深于标准色。
Part.02 结果与讨论
1、热分布测试结果
三次试验的热分布数据(见表 1)显示,灭菌器腔室内所有 10 个监测点的最低温度均高于 121℃,最高温度在122.41℃至 123.23℃之间。温度波动度(最高与最低温度之差)最大为 1.95℃,均匀度(各点平均温度的最大差值)最大为 1.32℃,表明灭菌器腔室内的热量分布均匀且稳定,重现性良好 [8]。
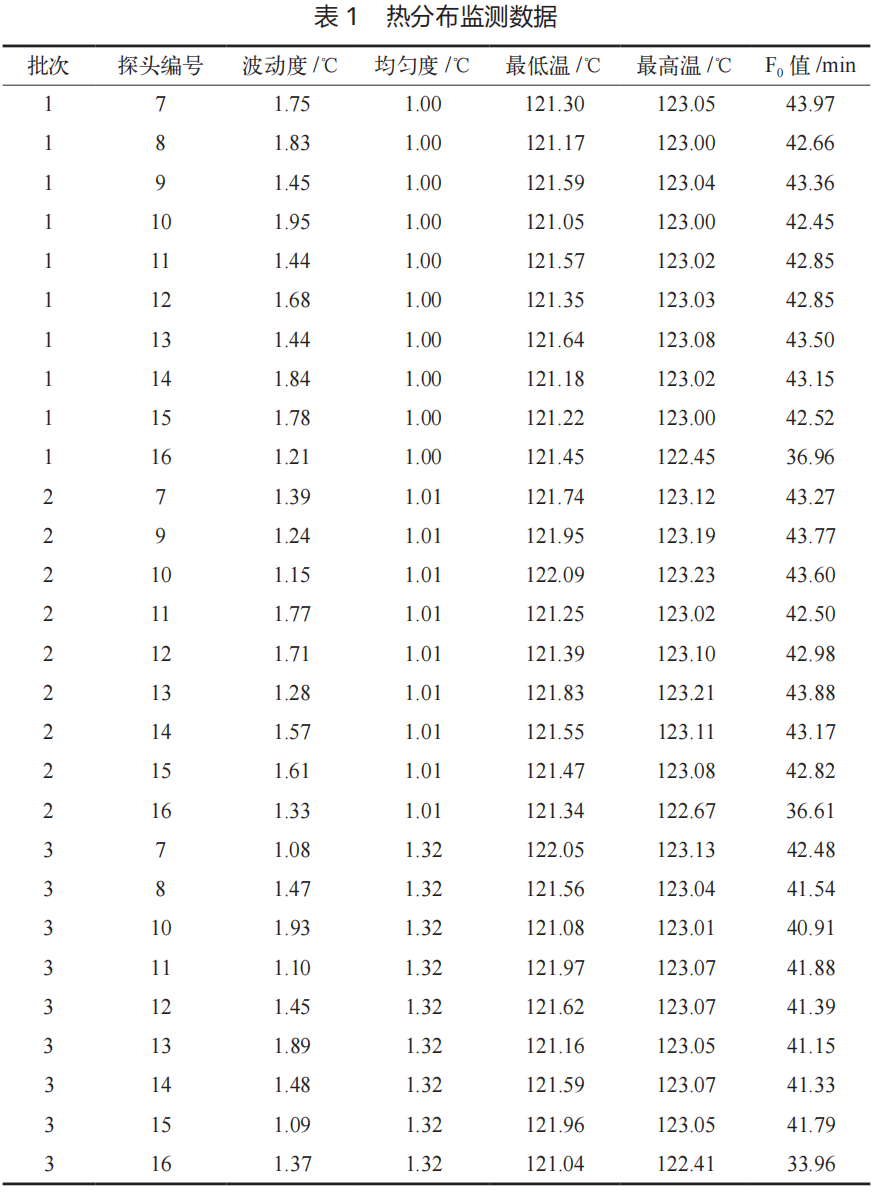
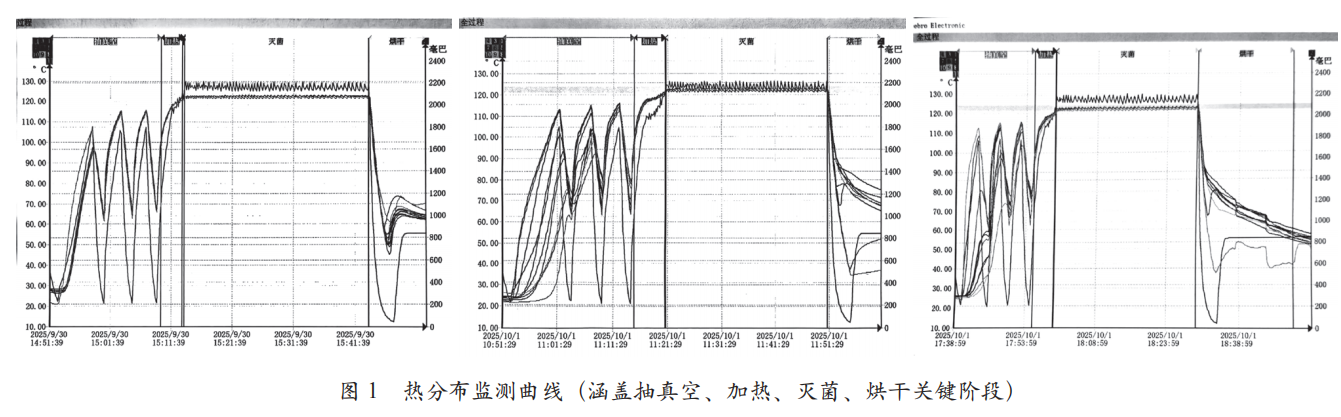
所有探头的 F0 值均远高于 15 min 的接受标准,其中位于冷凝水排放口的16号探头因温度略低,F0 值相对较低(最低 33.96 min),但仍远超标准,确认该灭菌程序能为腔室提供充分的过程致死率。如图1所示的热分布监测曲线(涵盖抽真空、加热、灭菌、烘干关键阶段),可直观观察到各阶段温度变化平稳,无明显波动。
2、热穿透与微生物挑战测试结果
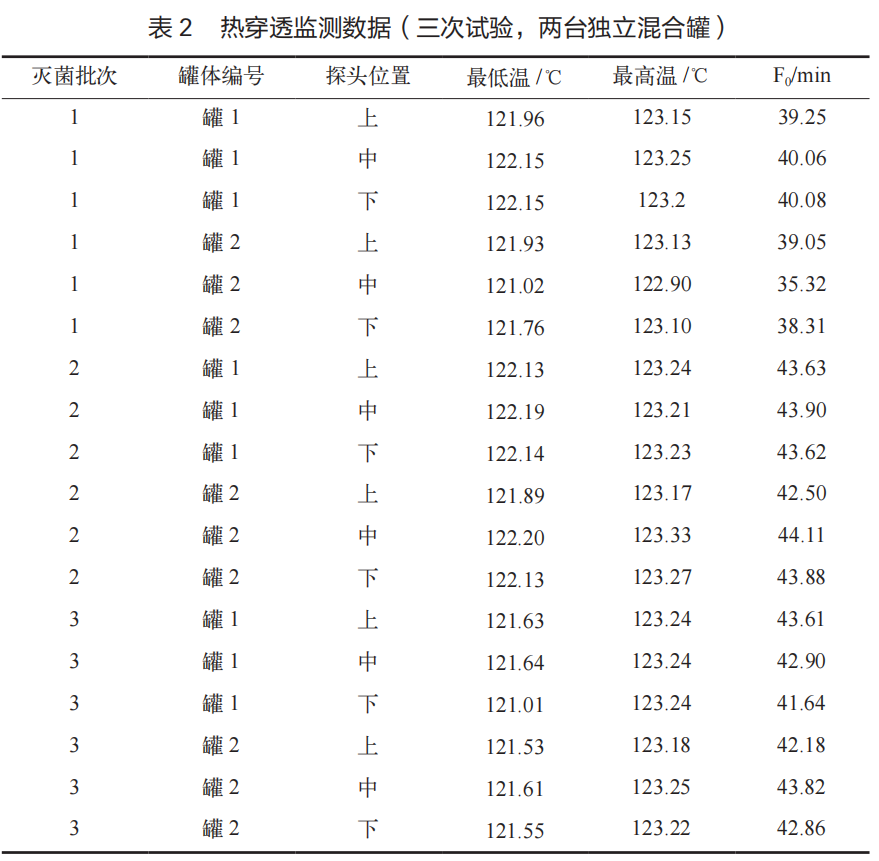
热穿透测试数据(见表 2)是验证的核心,它直接反映了物料(或模拟设备)内部所接收到的实际灭菌效果。三次试验中,两台混合罐内6个监测点的F0值范围为35.32min~44.11min,最低 F0 值出现在第一次试验中罐 2 的中心位置(35.32 min),但仍远高于15 min 的接受标准。这表明混合罐内部(包括可能存在气流死角的区域)均能接收到足够的灭菌热量。与热穿透探头共同放置的生物指示剂在经过24 h 培养后,所有 48 支(3 批 ×16 支)均显示无菌生长,而阳性对照均显示有菌生长。此结果与 F0 值数据高度吻合,共同证明了该灭菌工艺能有效杀灭高抗性的嗜热脂肪芽孢杆菌孢子,无菌保证水平(SAL)可达 10-6 或更高[9]。所有化学指示卡的颜色变化均达到或深于标准色,提供了快速的现场过程确认。
3、讨论
本研究成功验证了在既定参数下,采用 XG1.D 型脉动真空灭菌器对两台300 L 独立混合罐进行灭菌的工艺稳定且有效。设备工况及纯蒸汽的干度值、过热度、不凝性气体含量监测均符合要求 [10],物理参数(温度、F0 值)与生物参数(BI 杀灭)均一致满足预定的严苛接受标准。
F0 值作为量化灭菌效力的关键参数,其计算基于微生物的 Z 值,能够综合评估不同温度下的累积杀菌效果。本研究中所有位置的 F0 值均显著高于标准,为工艺提供了充足的安全边界。生物指示剂的成功杀灭,是灭菌工艺有效性的最直接证据,符合国内外药典和GMP 对于灭菌验证的基本要求 [11]。
两台混合罐作为独立系统同时进行灭菌,尽管其内部各点的 F0 值存在差异,但均达到了规定标准,证明了灭菌程序设计的合理性和灭菌器性能的可靠性。验证过程中使用了经过校准且符合数据完整性要求的电子记录系统,确保了数据的准确性和可追溯性 [12]。
Part.03 结论
通过对热分布、热穿透、F0 值及生物 / 化学指示剂的综合评估,可以得出结论:在脉动抽真空 3 次、真空限度为 -80 KPa、温度为 121℃、灭菌时间为 30 min 的工艺参数下,山东新华 XG1.D 型脉动真空灭菌器能够稳定、可靠地使两台 300 L 独立不锈钢混合罐达到预定的无菌状态。该灭菌工艺验证成功,所有指标均符合药品 GMP 要求,可以正式应用于该生物制品的生产过程,为保证最终产品的无菌质量提供了坚实保障。
参考文献
[1] 曹敏静,陈富超,刘畅,等. 浅析在药品生产质量管理规范中关键设备对疫苗生产的影响[J]. 中国设备工程,2025(19):68-71.
[2] 李瑶.中药生产监督管理专门规定发布[N].医药经济报,2025-09-15(001). DOI:10.38275/n.cnki.nyyjj.2025.000109.
[3] 令狐霞. 中小型药企第三方冷链物流供应商服务质量评价研究[D]. 贵阳:贵州大学,2025. DOI:10.27047/d.cnki.ggudu.2025.001545.
[4] 陈冬梅. 食品微生物检测实验室标准菌株的管理措施分析[J]. 食品安全导刊,2023(18):27-29+33. DOI:10.16043/j.cnki.cfs.2023.18.015.
[5] 王睿陟,李世文. 黄芩粉的干热灭菌工艺研究[J]. 中草药,2013,44(15):2092-2096.
[6] 雒毅,冯煜,张伟,等. 养正合剂灭菌工艺优化与研究[J]. 生物化工,2025,11(04):99-103. DOI:10.20284/j.cnki.swhg.2025.04.018.
[7] 王舰兵,李铎,徐康,等 . 132℃灭菌法在疫苗生产中的灭菌效果验证[J]. 中国消毒学杂志,2017,34(05):419-421.
[8] 彭海云,李安喜,罗路明,等. 小型蒸汽灭菌器物理参数的校准[J]. 大众标准化,2025(06):190-192.
[9] 牟怡平,张扬,郑中阳,等. 3D生物打印临床应用的伦理困境与法律规制研究[J]. 医学与哲学,2025,46(19):37-40+45.
[10] 王世辉,田继钊,郭莹,等. 制药蒸汽系统设计研究[J]. 机电信息,2020(33):86-89. DOI:10.19514/j.cnki.cn32-1628/tm.2020.33.048.
[11] 张林爽,李珏,郑小玲,等. 中国无菌药品生产过程控制回顾与展[J]. 中国药品标准,2023,24(06):573-578.DOI:10.19778/j.chp.2023.06.003.
[12] 任群红.食品安全监管中农药残留检测难点及优化路径分析[J]. 食品安全导刊,2025,19(26):18-20. DOI:10.16043/j.cnki.cfs.2025.26.049.
邵丽竹
何发
相关推荐
-
2025国谈,企业、品种排名分析
12月7日,2025年国家医保药品谈判结果正式公布,基本医保目录成功新增114种药品(含独家105种),首版商保创新药目录纳入19种药品(全部独家),两个目录共成功纳入独家品种124个。其中,超过2个品种的有19家企业,本土企业占58%(12家)、外企占42%(8家)。
2025-12-26 张自然
-
非最终灭菌无菌制剂 B 级洁净区物料输入的问题分析及对策探讨
根据最新国内外法规及指南对非最终灭菌无菌制剂污染控制的相关规定,非最终灭菌无菌制剂 B 级洁净区物料输入是无菌生产工艺的关键环节。
2025-12-26 罗婧舒,孙文刚,王斌,张继康,裴鑫,杨创
-
酒黄精中药饮片炮制工艺改进研究进展
酒黄精在现行的《中国药典》2020 年版一部虽有收载,但并未对炮制工艺参数作出具体规定,导致酒黄精饮片生产炮制工艺标准不统一,市面上酒黄精饮片质量存在显著差异,尤其是黄精多糖的含量极易不合格。
2025-12-25 陈佳祺
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多