纳米喷雾干燥技术的应用研究进展
纳米喷雾干燥是一种温和、有效的颗粒制备技术,创新性地采用了压电喷雾机制、层流加热方式和静电粒子收集系统,具有可调节微粒尺寸、改善溶解度、实现表面修饰等诸多优点,可高产量 (90% )地获得纳米级颗粒。纳米喷雾干燥仪能处理的最小样品量可达毫克级。该文从纳米喷雾干燥技术的发展历程和技术特色出发,综述了纳米喷雾干燥机的结构和工作机制,汇总了影响纳米喷雾所得颗粒的处方和工艺参数,对其选择与优化提出建议。
喷雾干燥技术是将一定浓度的药物溶液通过雾化器喷射成雾状液滴,并利用具有一定流速的干燥气体对雾化的小液滴进行干燥,最终得到水分含量低的微粉颗粒 [1—2]。喷雾干燥是调节微粒尺寸和形态的有用技术 [3—5],其设备参数可控、成本 - 效益高,适于工业大规模生产。随着纳米药物和纳米治疗学的兴起和不断发展,人们越来越需要将常规喷雾干燥的功能扩展到“纳米”范围。但传统的喷雾干燥技术要实现药物纳米化,首先要对粉体进行前处理 ( 例如湿磨法、均质化 [6—8]),再进行喷雾干燥、固化。并且,传统雾化器和收集器的效率低下,收率仅 50%~ 70%。纳米颗粒的喷雾干燥制备技术尚未实现规模化。
目前,喷雾干燥已发展出喷雾冷冻、纳米喷雾、过热蒸汽喷雾等技术。其中,纳米喷雾干燥技术具有在亚微米甚至纳米范围内生成颗粒的独特能力,直接得到比传统喷雾干燥更小的颗粒尺寸,并且可高产率地处理毫克级样品量,适用于制药、生物技术、食品、纳米材料等产品的开发。
本文阐述了纳米喷雾干燥技术的关键要素,主要综述处方工艺参数对最终粉体性能的影响,说明纳米喷雾干燥技术在药物研发早期的处方工艺筛选中的应用。
Part.01纳米喷雾干燥技术简介
1.1 发展历程
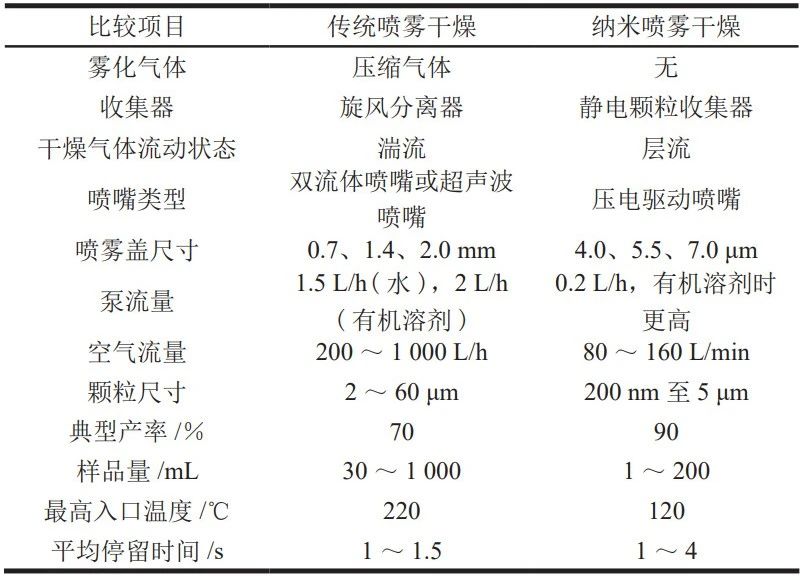
从 1979 年开始,瑞士 BÜCHI 公司对干燥工艺进行了一系列优化 [9];B-90 型纳米喷雾干燥器是其 2009 年开发的第四代实验室规模喷雾干燥器,实现了一步法直接干燥获得纳米颗粒的目标,所得颗粒的粒径可低至 300 nm,产率高达 90%,处理量最小能达到 2 mL。2017 年发布的 B-90 HP 型 ( 高性能型 ) 喷雾干燥器具有操作简易、能生产更小颗粒( 达到 200 nm)、产品收率高等特点。纳米喷雾干燥技术与传统喷雾干燥技术的区别如表 1 所示。
表 1 传统喷雾干燥与纳米喷雾干燥的对比
1.2 纳米喷雾干燥设备的结构组成
喷雾干燥设备通常由雾化器、干燥室、气体物料收集和回收系统组成。纳米喷雾干燥设备主体结构(图 1) 包括:①电加热器,将进气加热到所需温度;②超声雾化器,形成液滴;③干燥室,进行干燥气体和样品液滴之间的热交换;④静电粒子收集器,收集粒子;⑤出口过滤器,收集最细颗粒以保护用户和环境;⑥抽气机,输送压缩气体。与传统喷雾干燥相比,特殊部件包括:电加热器、超声雾化器、静电粒子收集器。
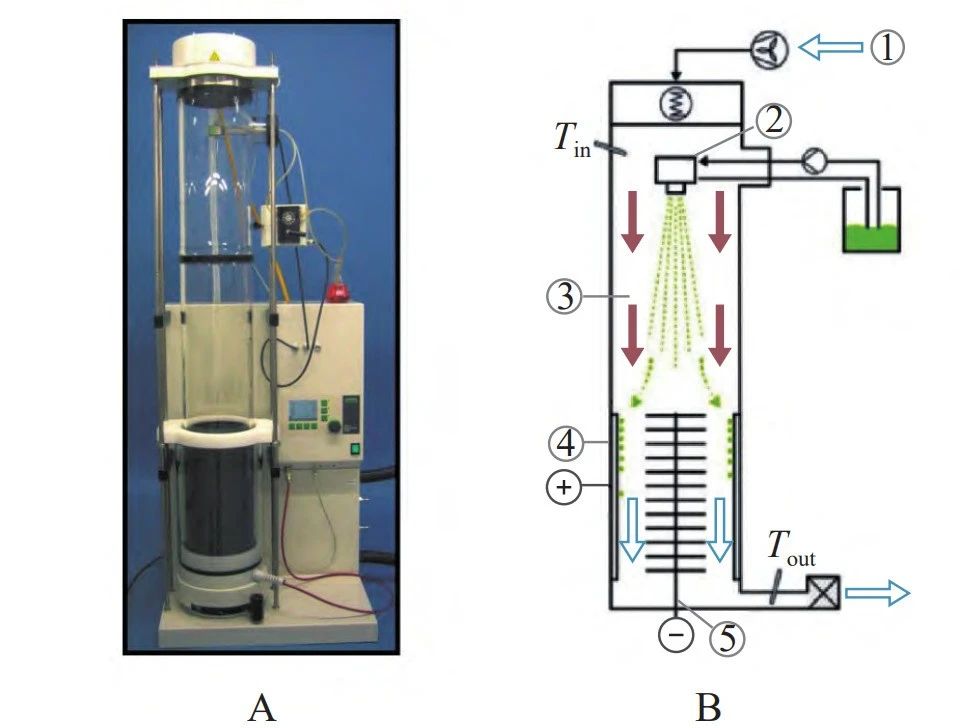

图 1 纳米喷雾干燥器的外观 (A) 和结构示意图 (B)
1.3 操作模式
纳米喷雾干燥操作可以在“开放”或“闭合”环境下进行。对于水性溶剂,一般采用以空气为干燥气体的开放模式,所需的干燥空气可通过单独的外置空气压缩机、无油压缩机或抽气机提供,气体无需再循环,更加经济和稳定 [10—12];而当使用有机溶剂或水相 - 有机混合溶剂时,则需要结合惰性气体循环装置和除湿机在闭合模式下操作。通常以氮气或二氧化碳为惰性气体在干燥室中重循环,氧浓度需控制在 4%以下,防止气体混合 [13],适用于易氧化药物。
1.4 技术特点
纳米喷雾干燥可调节所得颗粒的尺寸、分散性和形态 [14—16]。由于其独特的压电喷雾机制、层流加热方式和静电粒子收集系统,这项技术只需一步即可将微粒形成和干燥完美结合在一起 [10]。
压电喷嘴可产生粒径均匀的微细雾滴。雾化器单元包括带有不锈钢薄膜的压电致动器,该膜具有微米级的阵列孔,当以超声波频率 (80 ~ 140 kHz)振动时,可高速喷射出大量尺寸精确的液滴,这种基于振动雾化的新方法可以在反应器中生成粒径200 nm 至 5 μm 的颗粒 [17]。与传统喷雾干燥技术通过旋转雾化器、压力喷嘴或双流体喷嘴进行雾化的过程相比,该压电喷雾过程能更好地控制颗粒大小以及重现性,得到 PDI 小的亚微米级甚至是纳米级颗粒。
加热系统中使用层流气体,可使加热更加均匀且快速。在传统的喷雾干燥室中,分散的液滴会受到不同的局部空气温度和湿度条件,以及非层状( 即湍流 ) 气流的影响,从而引起干燥程度出现差异,导致粒度和形态的不均匀性 [18]。而纳米喷雾干燥器的喷雾室采用层流加热系统。操作时,气体透过热的多孔金属泡沫层进行加热。这种加热方式有助于优化能量输入,可实现气体快速、均匀、微细受热,是热敏性药物干燥的理想途径。
采用静电颗粒收集器可分离并收集目标颗粒,且产量可高达 90%。目前,颗粒收集大多采用布袋式过滤器、旋风分离器和静电收集器等 [5,19]。在布袋式过滤器中,过滤器的织物可将颗粒从废气中分离出来,过滤效率随织物孔径的减小而增加 [20]。旋风分离器目前最为常用,通过高速旋转气流产生的离心力实现分离。离心力会使颗粒集中于设备内壁,通常难以收集到粒径小于 2 μm 的颗粒,纳米级颗粒基本没有产出,且颗粒收率低。静电颗粒收集器 [21],创新性地采用了星状电极 ( 负极 ) 和圆筒状电极 ( 正极 ) 组成的高压静电场,固体颗粒通过强电场聚集在圆筒状电极壁上。
与传统喷雾干燥方法相比,纳米喷雾干燥法的产率更高,并且基于该技术的设备允许制备样本量少 ( 毫升或毫克级 ) 的样品,可实施昂贵、稀少药物的研发,对于尚处于早期阶段的项目而言,是一项重要的优势。
Part.02影响纳米喷雾干燥粉末性能的处方和工艺因素
纳米喷雾干燥技术可用于纳米级载药颗粒的研发和生产 [22—24]。应用纳米喷雾干燥技术获得的粉末的粒径、形态、收率、释放曲线和稳定性等特性同时受处方和工艺参数的影响,并且各种因素会发生相互作用,在实际应用中有必要根据具体情况选择合适的处方和工艺参数。通常,处方工艺参数对喷雾干燥产品的影响如表 2 所示。
表 2 处方和工艺参数对喷雾干燥产品的影响 1)
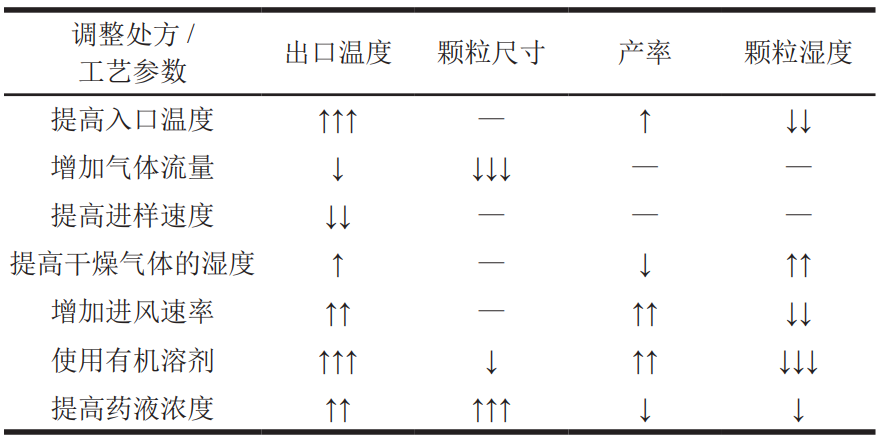
注:1)“↑↑↑/↓↓↓”表示强烈的增 / 减影响;“↑↑/↓↓”表示中等的增 /减影响;“↑/↓”表示微弱的增 / 减影响;“—”表示极小影响或无影响。
2.1 工艺参数
纳米喷雾干燥可控制的工艺参数包括喷雾速度、筛孔尺寸、入口温度、干燥气体流速等 [22—23]。
2.1.1 入口温度
仪器的入口温度、出口温度和喷头温度对颗粒性质和有效成分活性具有重要影响。其中,入口温度是可设定的。在喷雾干燥器中,液滴温度最初会上升到所设定的入口温度,接着在蒸发过程中保持恒定,最终将接近干燥器出口处的周围气体温度 [24]。在使用传统喷雾干燥器时,干燥气体的入口温度设置较高 ( 通常为 220 ℃ )。高温虽有助于提高料液干燥效率,但易使多肽、蛋白质等热敏性大分子生物活性物质降解,限制其应用。而纳米喷雾干燥机中的入口温度在 60 ~ 120 ℃可调。并且,纳米喷雾干燥过程迅速,样品在喷头处仅停留几毫秒;干燥过程温和,不易破坏样品结构,对温度敏感性样品友好。
在喷雾干燥工艺的设计中应考虑入口温度的设定和出口温度的调节。BOURBON 等 [25] 证明入口温度设定为 80、100 和 120 ℃时不会引起纳米水凝胶的变性,即使设定为 120 ℃,也不会对样品产生结构性破坏。文献 [26—27] 报道,当喷雾干燥热敏性的酶制品时,需要降低入口和出口处的温度以保持最大的酶活性、防止产物降解。SCHMID 等 [28] 报道较高的入口温度会降低干燥气体的相对湿度,并形成水分含量较低的颗粒。另一方面,TIOZZOFASIOLO 等 [29] 报道温度与粒径也存在一定关系,当入口温度从 70 ℃降至 40 ℃时,所得微粒的平均直径从 (5.69±0.36)µm 减小至 (4.31±0.44)µm,具有显著性差异 (P<0.05)。也有观点 [30] 提出:由于热量对液滴 / 颗粒的影响时间短暂,液滴会在几毫秒内干燥,并且在干燥热空气中的总停留时间只有几秒,所以可认为入口温度的影响较小。
通常,设置较高的入口温度,有利于物料干燥完全,但存在破坏热敏性物质活性的风险。相反,温度设置较低,会导致物料干燥不完全、易结块,降低产率。具体操作时,应结合产品特性与需求,判断入口温度是否为关键工艺参数。若温度的影响较大,建议依据处方组分及物料的理化性质进行摸索,优选较低的入口温度进行预试验,降低温度对喷雾干燥产品的影响,并通过评估干燥粉末的关键质量属性进行判断,逐步提高温度、控制含水量。
2.1.2 喷嘴孔径
喷雾颗粒的大小主要由喷嘴孔径控制。由于振动频率是固定的,因此较小的筛孔尺寸将导致单位时间内的通量降低,即液滴尺寸取决于安装的喷雾帽,网孔尺寸越小,喷射出来的液滴和获得的干燥颗粒越细。纳米喷雾干燥器通常配有 3 种规格的喷雾帽:4.0、5.5、7.0 µm,表 3 列出了不同规格对应的参数。
表 3 喷雾帽孔径对应得到的雾滴参数和通量
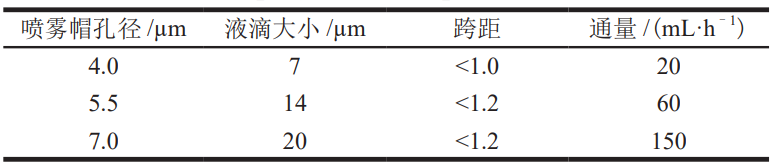
文献 [25,27] 报道,随着筛孔尺寸的减小,喷雾液滴尺寸显著减小,喷雾速度逐渐下降,参数间具有良好的相关性。ABDEL-MAGEED 等 [26] 也得出相同的结论,并报道随着筛孔的减小,产率呈升高趋势,且筛孔尺寸对酶活性没有明显影响。另一方面,喷嘴孔径对所得产品的外观形态也有影响。KYRIAKOUDI等 [24] 对比了 2 种不同尺寸 (4 和 7 µm)筛网的影响,结果显示使用孔径 4 µm 的喷雾帽产生的颗粒是球形的,具有光滑的表面;而使用孔径 7 µm的喷雾帽,得到的球形颗粒既有表面光滑的,又有表面起皱的。在纳米喷雾干燥机的应用研究中,也报道了由于干燥过程中的收缩作用而形成褶皱颗粒的情况。
综上所述,喷嘴筛网的孔径与颗粒大小、产量以及表面形态均存在一定的联系。虽然小孔径有利于制备粒径更小的粒子,但喷雾效率会变低,物料所承受的剪切力也会加大,继而对一些敏感性物质产生影响,且不适于黏度较大的料液。在实际应用中,应根据产品属性及试验目的选择喷嘴。
2.1.3 气体流速与喷雾速度
纳米喷雾干燥机中的干燥气体流速可通过抽气机在 80 ~ 160 L/min 调节。根据喷雾干燥理论,气体流速与喷嘴流出的液滴情况密切相关,当雾化流量高时,从喷嘴喷出的液滴较小;而气体流速越低,出口温度也越低。所以,气体流速也是喷雾干燥工艺设计中应考虑的因素。
BELOTTI 等 [31] 证实影响颗粒粒径的另一个参数是气体流速。ABDEL-MAGEED 等 [26] 证明酶活性也与进料气体流速有关,并且保持高流速 (95 ~105 L/min) 可防止温度对酶活性的不利影响,即以较低进料流量干燥所得胰岛素的降解程度要比使用较高进料流量时高得多。另外,气体流速也是影响干燥时间的因素之一,假设液滴为 7 µm,干燥温度为 75 ℃,干燥空气流速为 100 L / min,则纳米喷雾干燥机中的水滴干燥时间约为 10 ms。
依据文献 [32] 报道,气体流速可首先依据肉眼观察到的喷头液滴柱的喷射情况进行调节,以喷射出连续不断的均匀雾滴为宜,并结合仪器压力值,探索一个合适的范围,再依据产品的关键质量属性进行优化。
2.2 处方因素
2.2.1 载体材料
喷雾过程中加入适宜浓度的载体材料可保护药物结构、增加稳定性、提高产率,以及更高效地制备粒径均匀的干燥粒子。常用的载体材料 [33—35] 包括:亚硫酸钠、海藻糖、甘露醇、乳糖、胶质、阿拉伯胶、表面活性剂、聚乙烯醇、麦芽糊精、环状糊精、锰钴纳米悬浮物、酒石酸等。LI 等 [36] 在喷雾过程中应用了 5 种代表性载体材料 ( 阿拉伯树胶、乳清蛋白、聚乙烯醇、改性淀粉和麦芽糊精 ),结果显示 5 种载体材料都具有制备纳米晶的潜力。
难溶性药物与载体材料在喷雾过程中需要先进行溶解,而表面活性剂具有两亲性,故作为载体材料的应用也较为广泛。SCHMID 等 [28] 使用赋形剂( 甘露醇、海藻糖 ) 及表面活性剂 ( 聚山梨酯 20)进行喷雾干燥,能在 50 mg 规模的粉末产量下得到平均粒径为 0.5 和 0.8 μm 的颗粒。BEBER 等 [37] 以纳米喷雾干燥法制备了载地塞米松纳米粒,证明加入适宜的载体材料可有效提高生物利用度,改善地塞米松局部用药的局限性。在难溶药物的制备中,加入 HPMC[38]、大豆磷脂 [39] 有抑制无定型物重结晶的功效,在纳米喷雾干燥工艺中也较常用。
表面活性剂也是蛋白质药物中常用的赋形剂。文献 [32] 考察了阴离子、阳离子以及非离子型表面活性剂对处方和工艺的影响。试验表明,在相同的工艺参数条件下,加入阴离子或阳离子表面活性剂时产率更高、粒径控制更精准。同时,在含有离子型表面活性剂的情况下,产率和回收率较高;而含有非离子型表面活性剂的处方,产率和回收率较低。推测原因是纳米喷雾干燥器采用静电颗粒收集器,收集器内部产生的电场更有利于收集含有离子型表面活性剂的粒子。
总之,选择载体材料的相关标准较多,需要考虑的影响是复杂而多方面的,包括但不限于:与活性成分的相容性、合适的释放特性、高包封率、机械强度、贮存稳定性、乳化性能、水溶性和可食性等,最终要结合药物属性进行摸索。
2.2.2 溶剂
纳米喷雾干燥可对水性或有机溶剂的样品进行干燥。与水相比,有机溶剂具有较低的表面张力、黏度和密度 [40],喷雾产生的液滴稍小;另外,大多数药物可溶解于有机溶剂中,且沸点较低的有机溶剂能够降低干燥温度。纳米喷雾干燥工艺中常用的溶剂有甲醇、乙醇、丙醇、丙酮、二氯甲烷、甲苯、乙酸乙酯等。
FONTANA 等 [41] 通过调整丙酮和水的混合比例使地塞米松完全溶解,并且加入丙酮后,溶液黏度降低,使得振动喷雾的流速更高,缩短了处理时间。TIOZZO FASIOLO 等 [29] 报道,在 70 ℃下用 5%异丙醇溶液为有机溶剂,氟比洛芬颗粒的收率仅约为46%,而使用乙醇为有机溶剂时可最大程度地提高粉末产量。此外,由于有机溶剂的沸点较低,入口温度可设置在较低水平,如含二氯甲烷 (40 ℃)或丙酮 (56 ℃ ) 的样品在较低温度即可快速干燥,并可防止颗粒粘壁、结块。同时,保持低于某些聚合物熔融温度或玻璃化转变温度的环境,有利于维持药物结构,这也是保护热敏性药物的方法之一。
有机溶剂选择时要基于对药物和载体的溶解作用。另外,需考虑有毒溶剂 ( 如甲醇或氯仿 ) 在终产品中的残留量。
2.2.3 料液浓度
料液浓度包括药物浓度以及载体材料浓度 ( 原辅料配比 ),是喷雾干燥工艺的重要参数之一,主要体现为对颗粒粒径和分布、产率、形貌、稳定性等方面的影响。
纳米喷雾干燥喷雾器的振动网筛直径比传统喷嘴孔径小得多,因此该工艺不适用于黏度较大的料液,否则会造成喷嘴堵塞、颗粒结块 / 沉积,反而会降低产率。文献 [13,28,36] 证明随着添加剂浓度的增加,所得颗粒的粒径会明显增加,而降低药液浓度,可避免喷雾帽的孔道被堵塞。这些结果均说明料液浓度与颗粒粒径有较大的相关性。
不仅如此,料液浓度还影响纳米喷雾干燥颗粒的外观、产率与稳定性。LEE 等 [42] 报道料液浓度由 0.5%升至 2%时,所得颗粒的形状由不规则变为球形。ABDEL-MAGEED 等 [26] 提出浓度对颗粒收率( 可从 75%升至 94% ) 有重大影响。KYRIAKOUDI等 [24] 报道保持恒定的筛孔尺寸、增加原料药与辅料比例,可导致包封效率降低;在咖啡酸存在的情况下,以 1 ∶ 20 的原辅料配比获得的纳米颗粒具有更高的稳定性。
对于不同物质,料液浓度的具体影响也不同,因此需要根据试验目的和要求选择合适的浓度,通常的推荐浓度为 1%~ 2%,此范围内的制品具有较高的产率和较窄的粒度分布。
Part.03结语
自 2009 年纳米喷雾干燥器推出以来,纳米喷雾干燥技术在药物制剂领域的应用受到了国内外广泛关注。纳米喷雾干燥技术在制备药物颗粒方面的优势主要体现在:①使颗粒纳米化,增大比表面积,有利于提高药物的溶出速率、吸收率和生物利用度,减小药品在血液中的浓度波动,提高药品疗效;②操作条件温和,能较好地保持药物的结构和活性,是目前较适合制备热敏性生物大分子纳米颗粒的技术手段,有望在创新药物制剂领域发挥重要作用 [43]。
与传统喷雾干燥工艺相比,纳米喷雾干燥技术创新性地应用了压电驱动的喷雾头、层流加热系统,以及静电颗粒收集器,可制备得到 200 nm 至 5 μm的颗粒。这些载药微粒可通过多种途径给药,包括肺 [44—46]、口服 [47—48]、静脉 [16,49]、局部 [50]、 眼部 [30]、腹腔 [51]、膀胱内 [52]、脑内 [53]。此外,该技术还适于处理小量样品,收率可达 90%,操作相对简单,工业化潜力巨大。对于具体品种,纳米喷雾干燥可通过调节工艺参数 ( 入口温度、干燥气体流速、喷雾筛孔尺寸等 ) 和处方参数 ( 溶剂、料液浓度以及赋形剂等 ),依据处方组分及物料的理化性质,并结合药品特性与需求,进行产品开发。
总体来说,纳米喷雾干燥技术是对传统喷雾干燥技术的优化与改进,但也存在一定的局限性,如:喷雾器的振动网筛孔径小,不适用于黏度较大的料液;样品收集时需要将收集器取出,用刮刀手动收集,增加了产品与外界的接触时间,同时,用刮刀处理时,可能会破坏产品的结构。今后希望能通过静电放电等原理,使粉末颗粒自动进入样品收集器,移除手动操作的步骤。另外,相比于传统喷雾干燥,纳米喷雾干燥处理样品的速度较慢,泵流量约为 0.2 L/h,仅适合用于实验室前期研究。未来应进一步改良纳米喷雾干燥技术,拓展其工业化应用场景,也期待国产纳米喷雾干燥器的早日出现。
参考文献
[1] BAGHDAN E, RASCHPICHLER M, LUTFI W, et al.Nanospray dried antibacterial coatings for dental implants [J].EurJ Pharm Biopharm, 2019, 139: 59-67.
[2] 周铁桩 , 王 磊 , 黄 帅 , 等.喷雾干燥技术研究进展和展望 [J].辽宁化工 , 2019, 48(9): 907-910.
[3] WEERS J G, MILLER D P, TARARA T E.Spray-driedPulmoSphere™ formulations for inhalation comprisingcrystalline drug particles [J].AAPS PharmSciTech, 2019,20(3): 103.
[4] XU Y, DONG M, XIAO H, et al.Advances in spray-driedprobiotic microcapsules for targeted delivery: a review [J].Crit Rev Food Sci Nutr, 2023, 63: 1-17.
[5] ARPAGAUS C.PLA/PLGA nanoparticles prepared by nanospray drying[J].J Pharm Investig, 2019, 49(4): 405-426.
[6] 胡 慧 , 陈晶晶 , 王 琴 , 等.磷脂包覆技术制备布地奈德吸入气雾剂及体外性质评价 [J].中南药学 , 2023, 21(6):1459-1464.
[7] 郑 秀 , 贾铭 , 王成龙 , 等.治疗类风湿性关节炎的天然仿生纳米递药系统最新研究进展 [J].西南医科大学学报 ,2023, 46(5): 438-442.
[8] 谢锦珊 , 滕萱铭 , 杨 峥 , 等.纳米药物制备技术与装备及其在纳米农药中的应用 [J].现代农药 , 2023, 22(2): 19-27.
[9] ARPAGAUS C.A novel laboratory-scale spray dryer toproduce nanoparticles [J].Dry Technol, 2012, 30(10): 1113-1121.
[10] 郭 静 , 李浩莹.纳米喷雾干燥技术在药物研究中的应用进展 [J].中国医药工业杂志 , 2013, 44(4): 399-403.
[11] ZIMMERMANN C M, BALDASSI D, CHAN K, et al.Spray drying siRNA-lipid nanoparticles for dry powderpulmonary delivery [J].J Control Release, 2022, 351: 137-150.
[12] DA SILVA JÚNIOR M E, ARAÚJO M V R L, MARTINS AC S, et al.Microencapsulation by spray-drying and freezedrying of extract of phenolic compounds obtained fromciriguela peel [J].Sci Rep, 2023, 13(1): 15222.
[13] MIRANKÓ M, TÓTH J, FODOR-KARDOS A, et al.Topicalformulation of nano spray-dried levocetirizine dihydrochlorideagainst allergic edema [J].Pharmaceutics, 2022, 14(12):2577.
[14] ROTHBERG H S, PIETSCH S, HEINRICH S, et al.Using nano spray drying for the fabrication of hierarchicalcomposites and investigation of their mechanical properties[J].Chem Ing Tech, 2020, 92: 1189.
[15] PIÑÓN-BALDERRAMA C I, LEYVA-PORRAS C, TERÁNFIGUEROA Y, et al.Encapsulation of active ingredientsin food industry by spray-drying and nano spray-dryingtechnologies [J].Processes, 2020, 8(8): 889.
[16] ÖZTÜRK A A, NAMLI İ, GÜLEÇ K, et al.Design oflamivudine loaded nanoparticles for oral application by nanospray drying method: a new approach to use an antiretroviraldrug for lung cancer treatment [J].Comb Chem HighThroughput Screen, 2020, 23(10): 1064-1079.
[17] SHEHATA T M, IBRAHIMA M M.BÜCHI nano spray dryerB-90: a promising technology for the production of metforminhydrochloride-loaded alginate-gelatin nanoparticles [J].Drug Dev Ind Pharm, 2019, 45(12): 1907-1914.
[18] SOSNIK A, SEREMETA K P.Advantages and challenges ofthe spray-drying technology for the production of pure drugparticles and drug-loaded polymeric carriers [J].Adv ColloidInterface Sci, 2015, 223: 40-54.
[19] 宋祖坤 , 张万尧 , 安亚中 , 等.喷雾干燥技术的研究现状与发展趋势 [J].广东化工 , 2023, 50(22): 63-66.
[20] CAL K, SOLLOHUB K.Spray drying technique.Ⅰ :hardware and process parameters [J].J Pharm Sci, 2010,99(2): 575-586.
[21] ARPAGAUS C, JOHN P, COLLENBERG A, et al.10-Nanocapsules formation by nano spray drying [M]// JAFARIS M.Nanoencapsulation technologies for the food andnutraceutical industries [S.l.]: Academic Press, 2017: 346-401.
[22] ALMANSOUR K, ALI R, ALHEIBSHY F, et al.Particleengineering by nano spray drying: optimization of processparameters with hydroethanolic versus aqueous solutions[J].Pharmaceutics, 2022, 14(4): 800.
[23] ARPAGAUS C.Pharmaceutical particle engineering via nanospray drying - process parameters and application examples onthe laboratory-scale [J].Int J Med Nano Res, 2018, 5(1): 26.
[24] KYRIAKOUDI A, TSIMIDOU M Z.Properties ofencapsulated saffron extracts in maltodextrin using the Büchi B-90 nano spray-dryer [J].Food Chem, 2018, 266: 458-465.
[25] BOURBON A I, PINHEIRO A C, CARNEIRO-DA-CUNHAM G, et al.Development and characterization of lactoferrinGMP nanohydrogels: evaluation of pH, ionic strength andtemperature effect [J].Food Hydrocoll, 2015, 48: 292-300.
[26] ABDEL-MAGEED H M, FOUAD S A, TEAIMA M H,et al.Optimization of nano spray drying parameters forproduction of α-amylase nanopowder for biotheraputicapplications using factorial design [J].Dry Technol, 2019,37(16): 2152-2160.
[27] STROJEWSKI D, KRUPA A.Spray drying and nano spraydrying as manufacturing methods of drug-loaded polymericparticles [J].Polim Med, 2022, 52(2): 101-111.
[28] SCHMID K, ARPAGAUS C, FRIESS W.Evaluation of theNano Spray Dryer B-90 for pharmaceutical applications [J].Pharm Dev Technol, 2011, 16(4): 287-294.
[29] TIOZZO FASIOLO L, MANNIELLO M D, BORTOLOTTI F,et al.Anti-inflammatory flurbiprofen nasal powders for noseto-brain delivery in Alzheimer’s disease [J].J Drug Target,2019, 27(9): 984-994.
[30] BASARAN E.Ocular application of dirithromycinincorporated polymeric nanoparticles: an in vitro evaluation[J]. Turk J Pharm Sci, 2017, 14(2): 191-200.
[31] BELOTTI S, ROSSI A, COLOMBO P, et al.Spray driedamikacin powder for inhalation in cystic fibrosis patients: aquality by design approach for product construction [J].Int JPharm, 2014, 471(1/2): 507-515.
[32] CHEN R, ZHANG T, BAO S, et al.Formulation andcharacterization of voriconazole nanospray dried powders[J].Pharm Dev Technol, 2020, 25(7): 815-822.
[33] RACANIELLO GF, LAQUINTANA V, SUMMONTE S,et al.Spray-dried mucoadhesive microparticles based onS-protected thiolated hydroxypropyl-β-cyclodextrin forbudesonide nasal delivery [J].Int J Pharm, 2021, 603:120728.
[34] 冉 欢 , 夏晓霞 , 赵吉春 , 等.纳米喷雾干燥法制备食品生物活性成分微胶囊研究进展 [J].食品与发酵工业 , 2024,50(1): 318-325.
[35] KADOTA K, TSE JY, FUJITA S, et al.Drug-facilitatedcrystallization of spray-dried CD-MOFs with tunablemorphology, porosity, and dissolution profile [J].ACS ApplBio Mater, 2023, 6(9): 3451-3462.
[36] LI X, ANTON N, ARPAGAUS C, et al.Nanoparticles by spray drying using innovative new technology: the Büchi nanospray dryer B-90 [J].J Control Release, 2010, 147(2): 304-310.
[37] BEBER T C, ANDRADE D F, KANN B, et al.Submicronpolymeric particles prepared by vibrational spray-drying:Semisolid formulation and skin penetration/permeation studies[J].Eur J Pharm Biopharm, 2014, 88(3): 602-613.
[38] MIRANKÓ M, TRIF L, TÓTH J, et al.Nanostructuredmicronized solid dispersion of crystalline-amorphousmetronidazole embedded in amorphous polymer matrixprepared by nano spray drying [J].Adv Powder Technol,2021, 32(7): 2621-2633.
[39] MIRANKÓ M, MEGYESI M, MISKOLCZY Z, et al.Encapsulation of metronidazole in biocompatible macrocyclesand structural characterization of its nano spray-driednanostructured composite [J].Molecules, 2021, 26(23):7335.
[40] SURYAPRAKASH R C, LOHMANN F P, WAGNER M, etal.Spray drying as a novel and scalable fabrication methodfor nanostructured CsH2PO4, Pt-thin-film composite electrodesfor solid acid fuel cells [J].RSC Adv, 2014, 4: 60429-60436.
[41] FONTANA M C, DURLI T L, POHLMANN A R, et al.Polymeric controlled release inhalable powder produced byvibrational spray-drying: one-step preparation and in vitro lungdeposition [J].Powder Technol, 2014, 258: 49-59.
[42] LEE S H, HENG D, NG W K, et al.Nano spray drying: anovel method for preparing protein nanoparticles for proteintherapy [J].Int J Pharm, 2011, 403(1/2): 192-200.
[43] PLATI F, PAPI R, PARASKEVOPOULOU A.Characterization of oregano essential oil (Origanumvulgare L.subsp.hirtum) particles produced by the novelnano spray drying technique [J].Foods, 2021, 10(12):2923.
[44] EL-SHERBINY IM, HEFNAWY A.Methods of fabricationof chitosan-based nano-in-microparticles (NMPs) [J].Methods Mol Biol, 2019, 2000: 85-91.
[45] ALMANSOUR K, ALFAGIH I M, ALI R, et al.Inhalablemicroparticles containing terbinafine for management of pulmonary fungal infections: spray drying process engineeringusing lactose vs.mannitol as excipients [J].J Drug DelivSci Technol, 2020, 60: 101991.
[46] ZHU M, ZHANG D, ZHANG L, et al.Spray-dried inhalablepowder formulations of gentamicin designed for pneumonicplague therapy in a mouse model [J].Pharmaceutics, 2022,14(12): 2646.
[47] LIGARDA-SAMANEZ C A, CHOQUE-QUISPE D,MOSCOSO-MOSCOSO E, et al.Nanoencapsulationof phenolic extracts from native potato clones (Solanumtuberosum spp.andigena) by spray drying [J].Molecules,2023, 28(13): 4961.
[48] ÖZTÜRK A A, ARPAGAUS C.Nano spray-dried drugs fororal administration: a review [J].Assay Drug Dev Technol,2021, 19(7): 412-441.
[49] ANZAR N, MIRZA M A, ANWER K, et al.Preparation,evaluation and pharmacokinetic studies of spray dried PLGApolymeric submicron particles of simvastatin for the effectivetreatment of breast cancer [J].J Mol Liq, 2018, 249: 609-616.
[50] ÖZTÜRK A A, ÇEVIKELLI T, TILKI E K, et al.Ketorolactromethamine loaded nano-spray dried nanoparticles:preparation, characterization, cell viability, COL1A1 genesimulation and determination of anti-inflammatory activityby in vivo HET-CAM assay [J].Curr Drug Deliv, 2023,20(6): 830-840.
[51] ZERNOV A L, BONARTSEV A P, YAKOVLEV S G,et al.Low molecular weight poly(3-hydroxybutyrate)microparticles synthesized by piezoelectric spray drying forthe sustained release of paclitaxel [J].Nanotechnol Russ,2017, 12: 218-225.
[52] DENORA N, LOPEDOTA A, PERRONE M, et al.Spraydried mucoadhesives for intravesical drug delivery usingN-acetylcysteine- and glutathione-glycol chitosan conjugates[J].Acta Biomater, 2016, 43: 170-184.
[53] BEGE N, RENETTE T, ENDRES T, et al.In situ formingnimodipine depot system based on microparticles for thetreatment of posthemorrhagic cerebral vasospasm [J].Eur JPharm Biopharm, 2013, 84(1): 99-105.
邵丽竹
何发
相关推荐
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多