AAV基因治疗药物生产车间工艺设计探讨及案例分析
Part
1
Part
2
2.1
生物安全定级
2.2
生物安全防护措施

表1 AAV 基因治疗药物生产车间生物安全防护要求
Part
3
3.1
主要功能间的划分
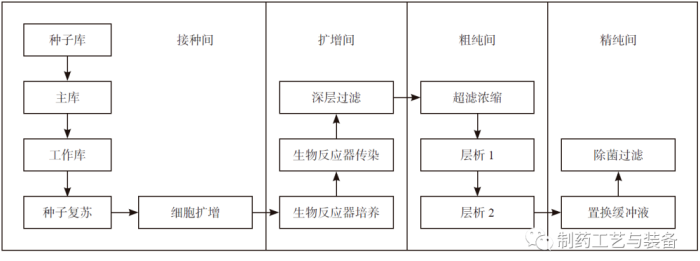
图1 工艺流程框图
3.2
主要功能间布局及工艺流线
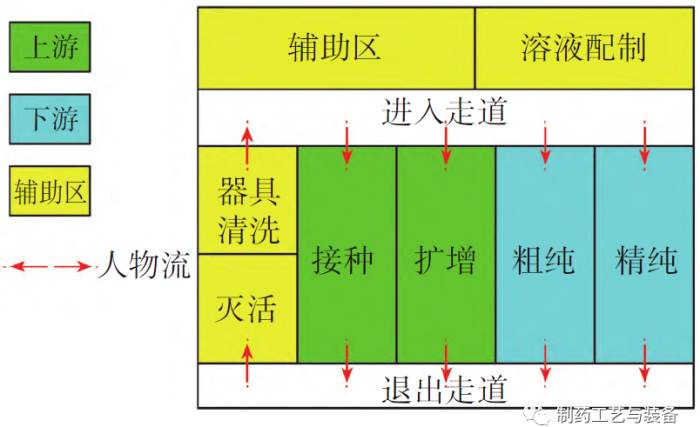
图2 功能间分区及人物流
3.3
洁净区的划分
3.4
人员净化策略
3.5
物品净化策略
3.6
产品退出策略
3.7
污物退出策略
Part
4
4.1
功能区划及人物流组织
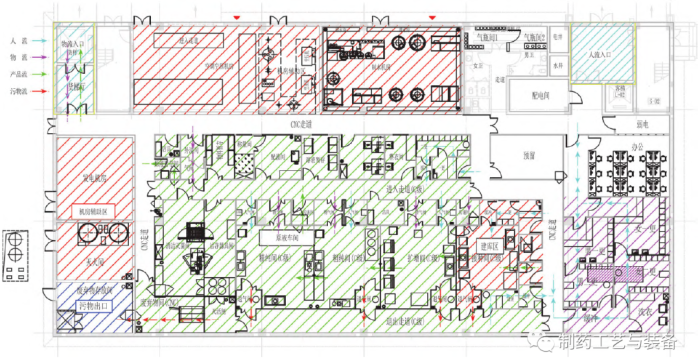
图3 A车间功能区划及人、物流组织
4.2
洁净分区及压差设计
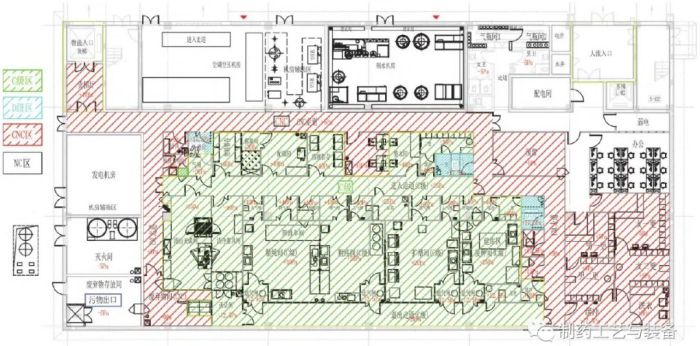
图4 车间洁净分区及压差布置
4.3
生物安全防护设计
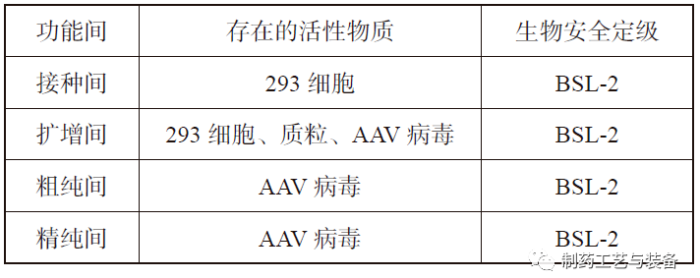
表4 功能间生物安全定级表
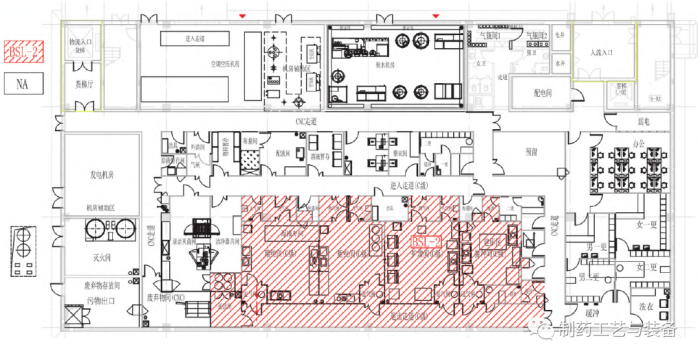
图5 车间生物安全分区
Part
5
参考文献
[1] 中国药典委员会 . 中国药典 [S]. 2020.
[2] 中华人民共和国卫生部 . 人间传染的病原微生物名录 [S].2006.
[3] NIH_Guidelines for Research lnvolving Recombinant DNA Molecules[S]. 2021.
[4] GB 50346—2011, 生物安[4] 全实验室建筑技术规范 [S]. 2011.
[5] GB 19489—2008, 实验室 生物安全通用要求 [S]. 2008.
[6] T—CECS+662—2020, 医学生物安全二级实验室建筑技术标准[S]. 2020.
[7] WS 233—2017, 病原微生物实验室生物安全通用准则 [S].2017.
[8] WHO Laboratory Biosafety Manual[S]. 2004.
[9] 国家药品监督管理局. 药品生产质量管理规范附录-生物制品(2020 修订)[S]. 2020.
[10] GB 50457—2019, 医药工业洁净厂房设计标准 [S]. 2019.
[11] ISPE-V6-Biopharmaceutical manufacuruing facilities 2nd[S].2013.
[12] 国家药品监督管理局. 药品生产质量管理规范附录-细胞治疗产品(2022 年征求意见稿)[S]. 2022.
[13] Guidelines on Good Manufacturing Practice specific to Advanced Therapy Medicinal Products [S]. 2017.
[14] ISPE-V3-Sterile Product Manufacturing Facilities [S]. 2018.
撰稿人 | 罗贤宇
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多