大而不同:简述IgM及其纯化策略
免疫球蛋白M (IgM)
基于免疫球蛋白重链恒定区编码基因的不同,参与哺乳动物体液免疫的抗体类型主要包括了IgM、IgD、IgG、IgE与IgA。纵观免疫球蛋白的进化史,IgM是其中最古老的一种抗体类型。在宿主抵御病原入侵的免疫响应过程中,每种类型的抗体都有其独特的功能效应,IgM最初表达于B淋巴细胞表面,参与构成B细胞表面受体 (BCR) ,B细胞活化后可由浆细胞产生分泌型IgM (sIgM) 参与早期体液免疫应答。
IgM概述
IgM的单体大小在190 kDa左右,重链由一个可变区 (Vμ) 和四个恒定区 (Cμ1-4) 组成,轻链由一个可变区和一个恒定区组成 (Vκ‐Cκ/Vλ‐Cλ) ,在重链的C端还有一条18个氨基酸短肽对于IgM的多聚化至关重要,且将该序列整合至其他类型的抗体分子也能促使其产生多聚体。在哺乳动物血清中,sIgM通常以五聚体 (pentamer) 或六聚体 (hexamer) 的形式存在,两者的分子量分别在900 kDa与1,050 kDa左右,其中五聚体是一个非正五边形结构,内含一个50°左右的缺口由J链 (J-chain) 占据以保持构象稳定(图1)。
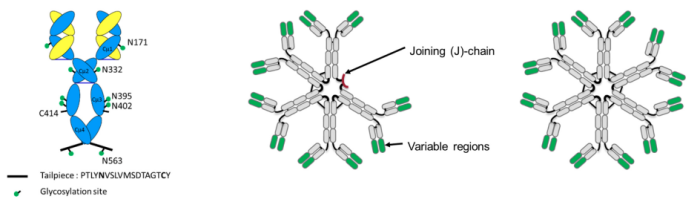
图1:IgM单体、五聚体、六聚体结构示意图
由于IgM是体液免疫应答早期的主要抗体,通过在患者血清中检测特异性IgM已被广泛应用于许多传染性疾病的早期诊断工具。另一方面,虽然IgM不能介导抗体依赖的细胞介导的细胞毒性作用 (ADCC) ,但相比于IgG,多聚体结构使sIgM能够多价结合抗原并且更加高效稳定地结合补体C1q(图2),启动补体依赖的细胞毒效应 (CDC) 。同时,五聚体IgM中的J链还能够与上皮细胞表面的多聚免疫球蛋白受体 (pIgR) 结合,进而将IgM转运至黏膜表面参与黏膜免疫。
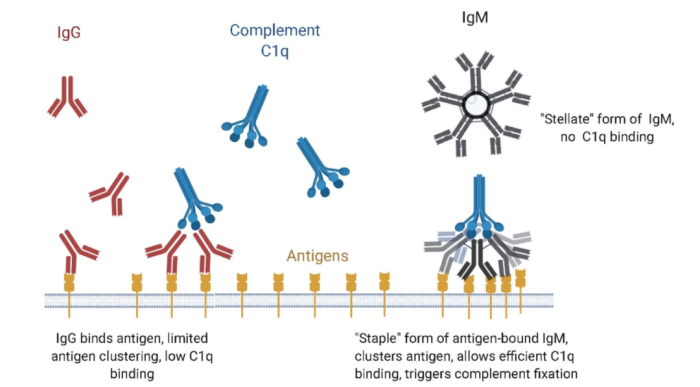
图2:IgM与IgG的补体结合活性差异
综上,IgM同样具有作为抗体药物的开发潜力,但相关的临床管线无论是在数量还是进度上仍与IgG存在很大差距(图3)。由于早期的IgM项目几乎使用的都是未经历抗体亲和力成熟天然抗体,具有较低的亲和力与特异性,因此效果大多不尽人意,但这些临床试验至少证明了IgM的安全性。通过对IgM的工程化改造,例如在J链处引入CD3抗体或其他配体分子使其发挥细胞桥接作用,能够使IgM的临床价值进一步提升。
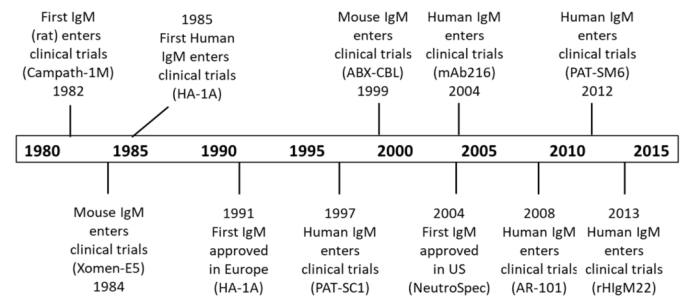
图3:IgM药物临床试验历史
IgM纯化策略
无论是应用于病原感染的早期诊断还是疾病治疗,如何有效获得高纯度IgM抗体是我们必须要解决的问题。相较于IgG,IgM的分子量更大、溶解度更低且更易降解,盐浓度、pH、温度都会在很大程度上影响IgM的稳定性。因此在遵循CIPP纯化策略的基础上,对IgM的纯化需要有更多考量。
01
捕获 (Capture)
在捕获阶段,亲和层析仍然是IgM纯化的首选。
由于IgM的Fc段存在较大的空间位阻,通常认为Protein A难以用于IgM的亲和捕获,但这并非是绝对的,Protein A除了能够结合抗体Fc段,还可与VH3基因参与编码的重链可变区序列结合实现对抗体的捕获。因此对于IgM的纯化,以MabSelect PrismA为代表的高载量、高耐碱Protein A填料仍然是个值得尝试的选择。
在Protein A效果不理想的情况下,可以着眼于Fab段的其他结构域进行亲和填料的选择。其中Protein L具有广谱的抗体结合活性,能够特异性结合抗体kappa轻链可变区。Capto L目前已被广泛应用于天然或重组IgM的纯化,新推出的Mabselect VL通过对Protein L配基的改造,实现了载量、分辨率以及耐碱性的进一步提升。此外,针对轻链恒定区,可以尝试使用KappaSelect或LambdaFabSelect进行捕获(图4)。
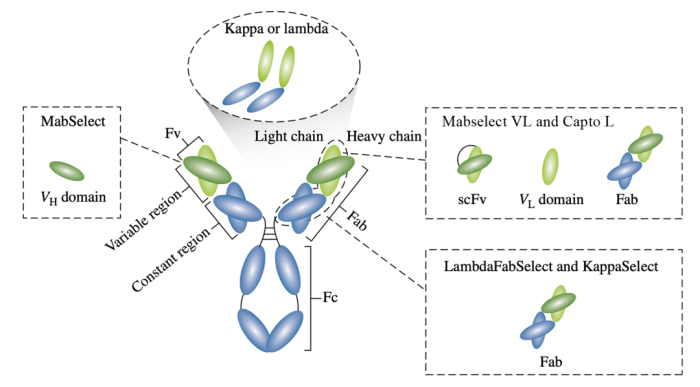
图4:具有Fab片段结合活性的填料种类及结合位点
考虑到IgM的稳定性,Protein A/L低pH的洗脱条件对于部分IgM可能有些剧烈,这种情况下可以选择其它类型的亲和介质。由于IgM具有大量的二硫键,基于嗜硫亲和原理的PlasmidSelect系列填料也非常适用于IgM的纯化,针对重组IgM,使用HiTrap IgM Purification HP 进行一步层析可同时实现高纯度与高收率(图5)。
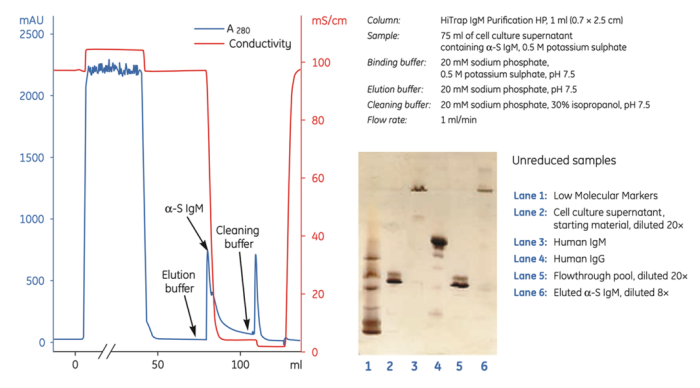
图5:HiTrap IgM Purification HP纯化重组IgM
02
中度纯化 (Intermediate Purification)
多数情况下,仅依靠一步亲和层析难以达到对纯度的要求,尤其是对于血清或腹水来源的天然IgM样品,上述亲和介质难以区分IgM与其他类型的抗体分子。鉴于IgM具有分子量大的特点,可以通过分子量差异对IgM进行第二步纯化。传统的凝胶过滤由于上样量小且流速低,层析过程比较耗时,不利于维持IgM的稳定。同样基于尺寸排阻原理开发的Capto Core 400/700两款填料外部包裹了一层惰性多孔外壳,分别能将分子量大于400与700 kDa排阻在外直接流穿,内部偶连了强吸附的多模式配基,能够将进入内孔的杂质全部截留(图6)。经清洁再生后,填料可重复使用。相较于传统的凝胶过滤,采用流穿模式的Capto Core能够支持更大的上样体积和更高的流速,综合效率提升了100倍,更加适合IgM的纯化。
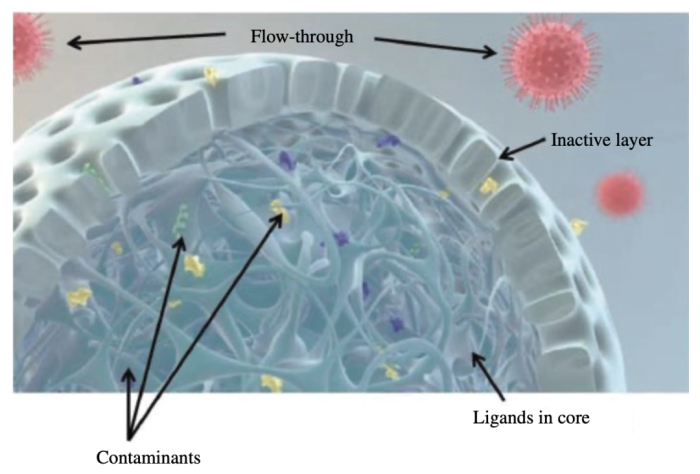
图6:Capto Core结构示意图
03
精纯 (Polishing)
阴离子交换层析能够有效去除样品中的HCP、HCD、内毒素以及病毒。人IgM的等电点分布范围大致在5.5-7.4之间,根据不同IgM分子的实际等电点,可灵活采用流穿模式 (FT) 或结合洗脱模式 (B/E) 。针对流穿模式,Capto Q系列以及Capto Adhere系列均能满足杂质去除需求。"另外,基于离子交换膜材料 Mustang Q 开发的系列产品具有吸附效率高、流速快的特点,适合以流穿模式去除痕量杂质。"但如果采用结合洗脱模式,就需要考虑填料载量的问题,这时以Capto Q XP为代表的大孔径阴离子填料会更加合适。
表1:IgM纯化策略汇总
|
纯化阶段 |
填料选择 |
|
捕获 |
Mabselect PrismA、Mabselect VL、Capto L、KappaSelect、LambdaFabSelect Capto PlasmidSelect、PlasmidSelect Xtra、HiTrap IgM Purification HP |
|
中度纯化 |
Capto Core 700、Capto Core 400 |
|
精纯 |
FT:Capto Q、Capto Q ImpRes、Capto Adhere、Capto Adhere ImpRes、Mustang Q (PALL) B/E:Capto Q XP |
如想了解更多产品相关资讯,欢迎拨打热线电话400-810-9118。
相关阅读:
参考文献:
1. Keyt, Bruce A et al. Structure, Function, and Therapeutic Use of IgM Antibodies. Antibodies vol. 9,4 53. 13 Oct. 2020
2. Gautam, Satyen, and Kai-Chee Loh. Immunoglobulin-M purification--challenges and perspectives. Biotechnology advances vol. 29,6 (2011): 840-9.
3. Cabanne, C. , and X. Santarelli . PURIFICATION OF IgM and IgA. John Wiley & Sons, Ltd, 2017.
内容来源:Wang Hongxiang Cytiva 思拓凡
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多