长久以来,对于中度至重度的AD,传统的免疫抑制药物一直是唯一的治疗选项。然而,近些年来,AD治疗有了令人瞩目的发展,许多新药物已经上市、获得许可,或处于临床开发的最后阶段。生物制剂和小分子药物的登场大大丰富了中度至重度AD的治疗武器库。例如,靶向IL-4/13通路的单克隆抗体(如dupilumab、tralokinumab、lebrikizumab)和JAK抑制剂(如abrocitinib、upadacitinib、baricitinib)等新药物。
目前,AD的治疗模式主要分为两大类:一是靶向IL-4/13轴,二是瞄准JAK/STAT通路。这两种方式都成效显著,并且在临床前和临床试验中都拥有着坚实有力的证据。正因如此,在这二者之间抉择治疗方法往往让人倍感棘手,这对于皮肤科医生而言,无疑是一项重大的挑战。这样的选择当中,必须要斟酌一些关键因素,比如AD的异质性、表型特征、患者所患的其他病症、年龄以及个人的偏好等。
AD的主要表型根据年龄相关的临床表现、IgE水平、疾病阶段和身体部位进行分类。此外,各种种族群体中AD的表型和免疫学差异也很重要(图1)。
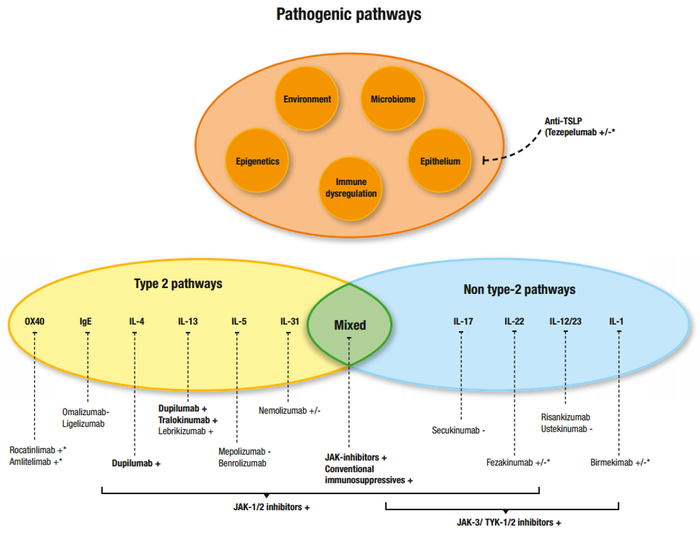
图1. AD所涉及的复杂且异质性的致病途径、疾病表型、内型和免疫学途径
AD的表现随着年龄的变化而有所不同,可以分为以下几个阶段:
在婴儿期(1岁以下),AD常常局限于面部区域,呈现出红色的斑块和强烈的瘙痒。皮肤常常会出现潮湿和渗出的丘疹,有时会形成痂或鳞屑。面部尤其是口周、脸颊和头皮是主要受累部位。
随着年龄增长进入儿童期,AD的表现变得更加局限,通常影响到肘部、膝盖等屈侧表面。这些区域的皮肤容易出现渗出和结痂现象。这一阶段的AD表现出明显的免疫学特征,特别是Th2细胞因子的强烈表达,如IL-5和IL-13,这些因子与嗜酸性粒细胞的增加和IgE水平升高有关。
在青少年和成人期,AD的表现可能会更加局限化。有些人可能只经历慢性手部湿疹,而其他人则可能出现头颈部、上胸部和肩部的皮炎。此阶段的皮损可能呈现出急性渗出和苔藓样病变。随着年龄的增加,AD患者的Th1和Th17相关标志物(如IFNG和IL17A)的表达逐渐增加,反映出免疫反应的复杂性。
在老年期,AD的皮肤表现与成人期相似,但“反向苔藓化”现象更为常见,尤其是在未受影响的肘部和膝盖褶皱周围。
AD还可以根据血清IgE水平分为外在性和内在性两种类型。
外在性
AD是最常见的表型,占AD病例的80%。这种类型的特征是血清IgE水平升高、嗜酸性粒细胞增多,以及个人和家族过敏背景。此外,外在性AD患者通常具有更高的FLG突变率,这是AD发病的最强遗传风险因素。
相比之下,内在性AD较为少见,占AD病例的20%。内在性AD患者的IgE水平正常,女性患者居多,并且通常在成年后期发病。内在性AD与金属接触过敏增加有关。尽管两种类型的AD患者均表现出Th2标志物的增加,但内在性AD患者表现出更显著的Th1信号和Th17/Th22活化,甚至显示出与银屑病免疫特征的重叠。
AD的表现随着疾病阶段的变化而有所不同,可以分为急性和慢性两个阶段。
急性
AD病变通常呈现为红斑、水样和高度炎症性的皮肤表现。基因表达谱显示,急性阶段与Th22和Th2细胞因子显著增加相关,而IL-17的增加较小。急性期的免疫反应主要通过IL-22的作用引发,IL-17和IFN-γ的贡献较小。
随着疾病的进展,急性病变逐渐变干、苔藓化、增厚,并出现色素沉着,表现为慢性阶段。慢性AD病变中观察到Th1相关产物的显著增加。此外,慢性期还伴随着Th2和Th22细胞因子的进一步增加,以及Th1和Th17反应的更高活化。
新的研究表明,AD在不同种族背景下表现出不同的临床、遗传和免疫病理学特征。
与白人AD患者中的经典临床表现相比,亚洲AD患者通常表现为边界更加明确的病变,有时与银屑病斑块非常相似,并伴有较多的鳞屑和苔藓化。这种表现与亚洲AD患者中强烈的Th17特征有关,具有类似银屑病的临床和组织学特征。
非洲AD患者
的表现主要集中在伸肌表面,有时伴有毛囊周围的突出和躯干上的明显丘疹。免疫反应表现为强烈的Th2/Th22偏向,Th2和Th22标志物与疾病严重程度显著相关。相比之下,Th1和Th17轴在欧洲裔美国人中有所减弱。
随着研究的进展,一些新的药物作为中度至重度AD的治疗方法已被开发和批准。当前批准的药物主要属于两大类,具有不同的作用机制:靶向IL-4/13通路的单克隆抗体和广谱小分子抑制剂(JAK抑制剂)。
由于IL-4和IL-13在AD病理生理学中的多种作用,包括破坏皮肤屏障、招募炎症细胞等,使这些细胞因子和及其受体成为理想的治疗靶标。
目前,三种靶向IL4/IL-13轴的单克隆抗体获批用于治疗AD:Dupilumab 、Tralokinumab和Lebrikizumab(图2)。
 图2. 获批用于治疗AD的靶向IL4/IL-13轴的单克隆抗体示意图
图2. 获批用于治疗AD的靶向IL4/IL-13轴的单克隆抗体示意图
-
Dupilumab是一种完全人源化的单克隆抗体,通过结合IL-4Rα来阻断IL-4和IL-13的信号传导。它是第一个被批准用于中度至重度AD成年和青少年的特定药物,并已在全球多个国家获得批准。
真实世界的数据支持其在III期临床试验中的疗效。作为首个获批治疗AD的药物,dupilumab的长期疗效和安全性数据也被广泛研究。在长达76周的III期开放标签扩展研究中,该药物显示出持续的疗效,并且没有发现新的安全信号,最常见的不良事件为咽喉炎、结膜炎和注射部位反应。
然而,尽管dupilumab在AD治疗中是一个重要里程碑,但只有35%至40%的患者在使用dupilumab时能够达到清晰或几乎清晰的皮肤状态(IGA评分0/1),因此仍需额外的治疗选择。
在dupilumab进入市场几年后,tralokinumab被批准用于治疗中度至重度AD。这是一种完全人源化的IgG4单克隆抗体,特异性结合IL-13,从而抑制其与IL-13受体复合物的相互作用,进而中和IL-13的生物活性。在两个设计相同的52周多国随机双盲安慰剂对照试验(ECZTRA 1和2)中,第16周达到IGA评分0或1和EASI 75的患者比例显著高于安慰剂组。在ECZTEND开放标签扩展试验中,长期疗效和安全性数据表明,tralokinumab能够在为期两年的治疗中长期控制AD的症状和体征。
Lebrikizumab:另一个针对IL-13的具有不同MOA的单克隆抗体
最近,lebrikizumab被批准用于治疗中度至重度AD。这是一种高亲和力的IgG4单克隆抗体,靶向IL-13。该药物的批准是基于两个III期临床试验(ADvocate 1和ADvocate 2)的结果。在这些试验中,患者按2:1比例随机接受lebrikizumab 250 mg(基线和第2周的500 mg负荷剂量)或安慰剂,每两周皮下注射一次。结果显示,ADvocate 1中lebrikizumab组43.1%的患者达到IGA 0或1,而安慰剂组为12.7%;ADvocate 2中lebrikizumab组为33.2%,安慰剂组为10.8%。
尽管tralokinumab和lebrikizumab都与IL-13结合,但其作用机制略有不同。具体而言,tralokinumab阻止其与IL-13Rα1和IL-13Rα2的接触,而lebrikizumab则只干扰IL-13与IL-13Rα1的结合,而不干扰IL-13Rα2,从而通过IL-13Rα2的内源性调节保持体内IL-13水平。这两个不同作用机制的治疗药物谁更胜一筹尚待阐明。
JAK/STAT通路是受体介导的信号转导范式,参与许多关键的生物过程,如细胞增殖、分化、凋亡和免疫调节。
该通路已在多种慢性炎症性皮肤病中扮演了重要角色,并在一些疾病中通过抑制该通路取得了成功的治疗效果,如AD、银屑病、白癜风和斑秃。
许多参与AD病理生理学的关键细胞因子,如IL-4、IL-13、IL-31和TSLP都通过激活JAK/STAT通路发挥作用。
此外,JAK/STAT通路还与皮肤免疫中的其他关键通路(如TNFα信号传导)相互作用。
目前,批准了三种不同选择性的JAK抑制剂用于治疗AD:upadacitinib、abrocitinib和baricitinib(图3)。
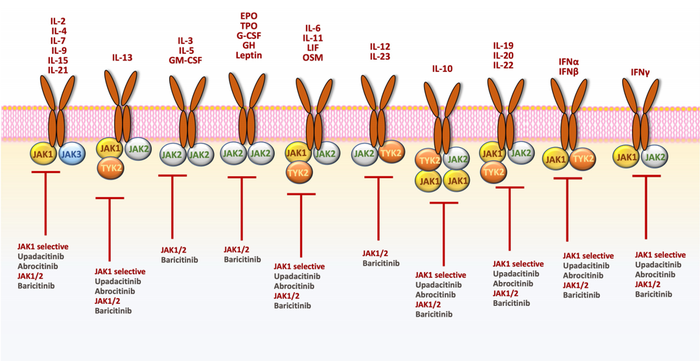
图3. JAK/STAT通路的主要细胞因子和获准用于治疗AD的JAK抑制剂示意图
Upadacitinib(UPA):高度选择性的JAK1抑制剂
UPA是一种口服选择性JAK1抑制剂,专门用于治疗中度至重度AD。这种药物是一种可逆的ATP竞争性抑制剂,对JAK1的选择性远高于对JAK2、JAK3和TYK2。在MeasureUp 1和MeasureUp 2这两项III期临床试验中,患者被随机分配接受UPA 15mg、UPA 30mg或安慰剂,每日一次,持续16周。结果显示,第16周时UPA组达到主要终点IGA0/1的患者比例显著高于安慰剂组:
MeasureUp 1:UPA 15mg(48%);UPA 30mg(62%)vs安慰剂(8%)
MeasureUp 2:UPA 15mg(39%);UPA 30mg(52%)vs安慰剂(5%)
长期治疗UPA显示其在52周内具有持续的疗效反应。此外,来自III期临床试验的安全性数据表明,UPA治疗期间不良事件(AE)的发生率较低,显示出良好的风险收益比。
Abrocitinib(ABRO):另一个选择性的JAK1抑制剂
ABRO是一种口服选择性JAK1抑制剂,最近获得EMA和FDA的批准,用于治疗中度至重度AD成人患者。在JADE MONO-1和JADE MONO-2这两项III期临床试验中,ABRO在第12周时均达到主要终点:
JADE MONO-1:ABRO 100mg(24%);ABRO 200mg(44%)vs安慰剂(8%)
JADE MONO-2:ABRO 100mg(28.4%);ABRO 200mg(38.1%)vs安慰剂(9.1%)
48周疗效和安全性数据表明,ABRO在AD治疗中具有持续的临床反应和可控的安全性。
Baricitinib(BARI):JAK1和JAK2的双重抑制剂
BARI是一种口服选择性JAK1和JAK2抑制剂,最近在欧洲和日本获批用于治疗中度至重度AD成人患者,口服每日剂量为4 mg和2 mg。在III期临床试验项目中,BARI的疗效和安全性得到了充分验证。在BREEZE-AD1和BREEZE-AD2试验中,BARI单药治疗(4mg、2mg或1mg)与安慰剂在年龄≥18岁的中度至重度AD成人中进行了比较。结果显示:
BREEZE-AD1:BARI 4mg(16.8%);BARI 2mg(11.4%)vs安慰剂(4.8%)
BREEZE-AD2:BARI 4mg(13.8%);BARI 2mg(10.6%)vs安慰剂(4.5%)
Baricitinib联合外用皮质类固醇(TCS)的长期疗效显示,在连续治疗68周内,两种剂量的BARI均具有临床意义的持续疗效。此外,对八项BARI临床试验数据的综合分析表明,治疗AD患者的3.9年期间未发现新的安全信号,显示其安全性良好。
随着中度至重度AD治疗选择的增加,需要对特定患者群体选择全身药物提供更精确的指导。然而,选择最适合用于中度至重度AD管理的全身药物并不容易,必须考虑几个重要因素,如AD的异质性及其表型分类、患者的共病、年龄和个人偏好等因素(图4)。
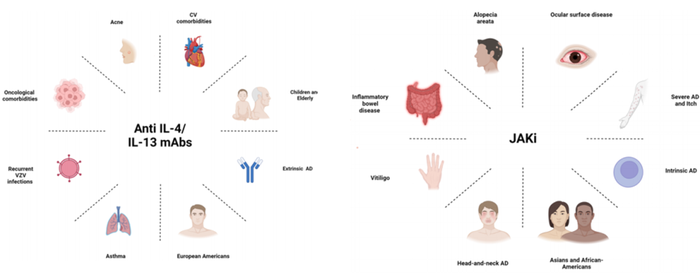
图4. 影响AD人群选择IL-4/13抗体和JAK抑制剂的主要因素
AD的临床表型多种多样。Chovatiya等人在最近的一项研究中,根据瘙痒和病变的严重程度,将AD分为四种表型:轻度至中度瘙痒和病变(MI-ML)、轻度至中度瘙痒和严重病变(MI-SL)、严重瘙痒和轻度至中度病变(SI-ML)、严重瘙痒和病变(SI-SL)。针对瘙痒主导型AD的研究显示,JAK1抑制剂如Abrocitinib(ABRO)和Upadacitinib(UPA)在改善瘙痒症状方面表现优异。特别是在与Dupilumab的对比试验中,UPA和ABRO都在起效速度和皮肤清除水平上显示出更高的优势。
对于需要快速缓解瘙痒的患者,JAK抑制剂也可能是更好的选择。尽管尚无JAK抑制剂之间的直接比较试验,但现有分析显示,UPA 30mg每日的疗效最高,其次是ABRO 200mg每日。然而,由于这些分析存在局限性,需谨慎解读结果。
另一方面,JAK抑制剂的安全性仍是关注的重点。虽然选择性JAK1抑制剂在AD患者中的安全性尚未被全面验证,但在其他免疫介导疾病中的应用数据提示,其可能带来感染、静脉血栓和恶性肿瘤风险。特别是在65岁以上、心血管疾病患者中,应优先选择IL-4/13单克隆抗体,如Dupilumab。Dupilumab已被证实在老年AD患者中是安全有效的。此外,研究显示,与JAK1抑制剂相比,Dupilumab在中度至重度AD患者中引起带状疱疹的风险较低。
值得注意的是,AD在“头颈部”表现出对Dupilumab的治疗抵抗性。
一项长达104周的研究发现,Dupilumab治疗后,头颈部AD症状仍然在较高比例的患者中存在。
然而,当患者转用JAK抑制剂后,症状有所改善。
此外,Dupilumab可能引发面部红斑,而这一副作用在使用JAK抑制剂后得到缓解。因此,对于主要局限于头颈部的AD患者,JAK抑制剂可能是更好的选择。
对于肿瘤或心血管共病,临床医生倾向于选择单克隆抗体治疗,如Dupilumab。而当AD与其他免疫介导的皮肤病(如银屑病、斑秃、白癜风、化脓性汗腺炎)共存时,JAK抑制剂可能是更好的选择,因为JAKi在这些疾病中也显示了疗效。例如,除了AD外,Upadacitinib(UPA)还被批准用于治疗类风湿关节炎(RA)、轴性脊柱关节炎、克罗恩病(CD)和溃疡性结肠炎(UC)。类似的,Baricitinib(BARI)已用于治疗斑秃和RA,因此在AD与这些疾病共存时,JAK抑制剂可能是最佳选择。
另一方面,AD常与过敏性疾病(如哮喘)相关联,在这种情况下,Dupilumab应优先被选择。Dupilumab已被批准用于哮喘、伴鼻息肉的慢性鼻窦炎等多种疾病,并在这些共病患者中表现良好。
AD的异质性不仅体现在临床特征上,还在分子特征上有所体现。
临床表型不一定与疾病的机制或分子标志物相关,因此,识别不同分子内型的生物标志物有助于更好地表征和分层AD患者,并指导治疗选择。
研究表明,通过血清和组织生物标志物可以识别AD患者的内型。例如,Thijs等人通过血清生物标志物将成年AD患者分为四个群体。Bakker等人的蛋白质组学分析也识别了四个群体,包括"皮肤趋向趋化因子/IL-1R1主导、“Th1/Th2/Th17主导”、“Th2/Th22/PARC主导”和“Th2/嗜酸性粒细胞劣性”群体。
Sekita等人通过对115名AD患者和14名健康对照的皮肤和外周血单个核细胞样本的RNA-seq数据分析,发现了AD皮肤表现与不同免疫特征之间的相关性,并描述了三种患者群体,表现出不同的疾病进程和病史。
此外,组织或血液生物标志物可能有助于预测患者对某种疗法的反应。Glickman等人发现,AD患者皮肤中Th17相关细胞因子CXCL2的基线基因表达水平与Dupilumab治疗反应之间存在强关联性,提出该分子可作为预测性生物标志物。
这些研究表明,内型信息对个性化治疗选择具有重要意义。例如,IL-4/IL-13抗体可能对Th2主导的AD亚型,如外在性AD、欧裔美国人AD或儿童AD有效,而内在性AD、亚洲和非洲裔美国人AD患者可能更适合广谱的JAK抑制剂。
尽管目前临床实践中尚缺乏验证的生物标志物,但基于当前研究可以做出一些假设。未来的研究将帮助验证这些假设,并促进更精准地分层AD患者以及识别新的表型-内型关联。
随着中度至重度AD治疗选择的增加,了解疾病的异质性和患者分层成了个性化医学诊疗的关键任务。靶向IL4/13的抗体和JAK抑制剂不仅是治疗的突破,还为AD发病机制提供了新的见解。由于AD的临床进程和治疗反应高度异质,某些疾病亚型可能对某种疗法反应更好,从而指导临床实践。此外,AD的共病情况也可能影响药物选择。
目前的研究和临床试验数据表明,瘙痒主导型AD、头颈部AD、OSD或免疫介导的共病患者可能更适合JAK抑制剂;而老年人、肿瘤、心血管或过敏共病、复发性带状疱疹感染或痤疮的患者则可能更适合IL4/13抗体。
下一步的方向将是基于患者的分子特征在IL-4/IL-13抗体或JAK抑制剂之间做出选择。
随着我们进入更精准的治疗时代,分子生物标志物将帮助更好地表征和分层患者,从而定制基于内型的治疗方案。
近年来还研究了各种新的机制针对多种T细胞群体,如Th1、Th2、Th17和Th22。例如,靶向OX40受体(如rocatinlimab)及其配体OX40L(如amlitelimab)的单克隆抗体在II期研究中显示出优异的疗效,目前正在进行III期临床试验用于中度至重度AD治疗。
无疑,我们正走向一个更精准、个性化的治疗时代,有望使每位AD患者都能得到最适合的治疗方案。
参考资料:
1. Blocking the IL-4/IL-13 Axis versus the JAK/STAT Pathway inAtopic Dermatitis: How Can We Choose?
2. Biomarkers in atopic dermatitis.
3. Targeting Interleukin 13 for the Treatment of Atopic Dermatitis.
4.The Epidemiology and Global Burden of Atopic Dermatitis: A Narrative Review.

 图2. 获批用于治疗AD的靶向IL4/IL-13轴的单克隆抗体示意图
图2. 获批用于治疗AD的靶向IL4/IL-13轴的单克隆抗体示意图














评论
加载更多