中药来源miRNA在疾病治疗中的作用
张鸿立、刘子奇、马心怡、杨高山
2024-03-15
微小RNA(microRNA,miRNA)是一类非编码RNA,可通过与mRNA 3′UTR互补配对降解mRNA或阻断mRNA翻译,导致基因表达下调。中药来源miRNA已被证实是中药有效成分和关键物质基础之一,其跨物种调控可能是中药发挥抗病作用的潜在机制。本文就中药来源的miRNA在疾病治疗中的作用及研究进展作一综述,为基于中药来源miRNA疾病治疗研究提供新的思路。
微小RNA(microRNA,miRNA)是一类不编码蛋白质的单链小分子RNA,其能够与动物体内的靶mRNA碱基配对,导致靶mRNA降解或抑制其翻译,进而对细胞生物学行为进行调节。中药中含有大量的miRNA,尽管中药来源的miRNA在疾病治疗领域具有重要潜力,但当前相关研究较少,且作用形式和分子机制尚不明确。本文旨在通过对中药来源miRNA在体内运输、发挥跨物种调控及疾病治疗等方面的作用研究进行总结,期望能深入探讨中药来源的miRNA在不同疾病中的药理作用机制,为中药小核酸类药物在生物医药领域中的开发利用提供支撑。
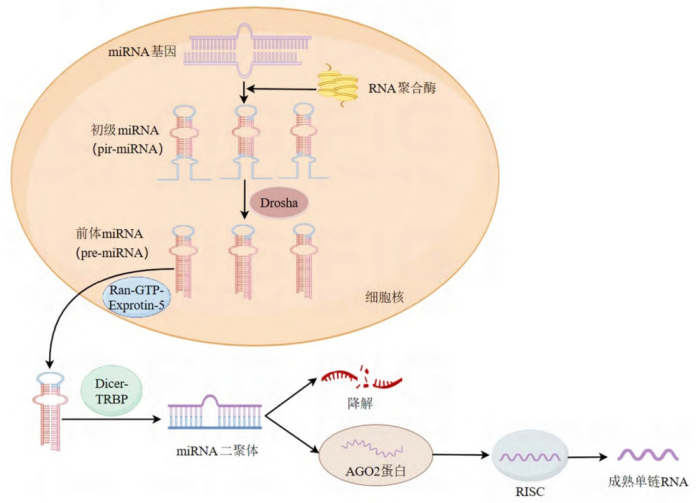
miRNA是一类小分子非编码RNA,其长度通常为19~24个核苷酸,参与转录后基因表达调控。编码miRNA的基因经RNA聚合酶识别后进行转录形成初级miRNA(pri-miRNA),进一步在核糖核酸酶Drosha RNase Ⅲ的作用下,初级miRNA被切割形成70个碱基的茎环结构,即前体miRNA(premiRNA)[1]。pre-miRNA在细胞核转运蛋白EXP5(exportin 5)的协助下,从细胞核转运到细胞质,并被细胞质中的Dicer-TRBP复合物识别,通过对茎环结构的剪切和修饰,在细胞质中形成miRNA二聚体。其中一条链被快速降解,而另一条链会转载到真核翻译起始因Argonaute蛋白2(Argonauteprotein 2,AGO2)中,形成RNA诱导沉默复合体(RNA-induced silencing complex,RISC),最终生成成熟的单链miRNA[2],如图1所示。
 中药是中华民族的瑰宝。许多中药材都来自药用植物,这些中药材的药效物质基础不仅仅是次级代谢产物,如多酚、生物碱、单宁和皂苷等,还可能是miRNA等核酸类物质。最初在秀丽隐杆线虫中发现了miRNA[3],有研究表明,miRNA在人类多种疾病中扮演着重要的角色[4,5]。植物来源的miRNA和动物体内miRNA在进化过程中是相互独立演化的,因此它们在序列、前体结构和成熟过程等方面都有所差异。首先,在动物体内很少有与植物miRNA的同源序列;其次,植物miRNA的pre-miRNA相比动物更长,动物pre-miRNA的长度通常在65~70个核苷酸之间,而植物的premiRNA可以长达数百个核苷酸,并且其长度也更加多变;此外,动物体内的Drosha酶在植物中缺乏同源蛋白,导致植物pri-miRNA的两次剪切均在植物细胞核中,且由RNaseⅢ型核酸内切酶(dicer-like1,DCL1)完成;更重要的是,植物miRNA的3′端会经过HEN1甲基转移酶的甲基化修饰,而动物体内的miRNA则缺少这种甲基化修饰[6]。以上因素决定了植物来源的miRNA在结构和功能上与动物体内的miRNA存在很大差异。2012年,南京大学张辰宇团队研究发现,稻米中富含一类丰富的miRNA分子miR-168a,其可以通过人体消化系统进入血液和其他多种器官,并且具有靶向调控体内低密度脂蛋白受体衔接蛋白1(low-densitylipoprotein receptor related protein 1,LDLRAP1)基因表达的能力,进而影响人体血脂水平[7]。这一发现开启了植物来源miRNA跨物种调节动物体内基因发挥疾病治疗作用的研究热点。这与我国传统观念中所谓“吃啥补啥”“以形补形”,特别是以饮食调节身体状态、治疗疾病,即“食疗”的理念相契合,为研究传统中草药的有效成分提供了新的研究思路,为小核酸类新药的开发与应用提供了新的方向。
miRNA是广泛存在于真核生物中的一类核酸分子,在进化过程中相对保守。一直以来,由于RNA易于降解和不稳定的特点,对miRNA的研究都只限于在各自的物种之中,很难想象不同物种来源的miRNA可以进行跨界调控[8]。要实现中药来源miRNA跨物种调节发挥抗病作用,需要满足多个前提条件。首先,在炮制和加工过程中要保持中药来源miRNA的稳定性,避免其降解和结构破坏。Wang等[9]实验证实,经高温煎煮后,人参提取液中的miRNA仍可稳定存在。西兰花经过高温烹煮后,miR-159的表达仍可以被检测到[10]。经膨化处理后,玉米中仍可检测到18种miRNA[11]。以上实验都提示了植物来源的miRNA可以在高温环境下保持结构和功能的稳定,这为miRNA发挥跨物种调控作用提供了前提。其次,中药来源miRNA需要顺利进入消化系统和循环系统,并保持结构稳定。研究表明,外源miRNA主要是通过摄食途径在不同物种之间传播,并且能够免受在体内核酸酶的分解,稳定进入循环系统。如服用生地黄水煎剂后,生地黄来源的miR-5140、miR5137、miR-5141等miRNA通过消化道稳定地进入人体血液当中[12]。有研究发现,将金银花水煎液喂食小鼠后,金银花来源的miR-2911能稳定存在于小鼠的外周血和肺中,并呈现较高的表达水平[13]。植物来源miRNA因其3′端的甲基化修饰,相对于动物来源miRNA更加稳定不易分解。因此,中药来源miRNA在消化系统中的运输和稳定性得到了保证。最后,中药来源miRNA需要依赖适配介质进行稳定运输,靶向结合到体内特定基因。已有研究表明,外源miRNA可以通过细胞外囊泡包裹的方式进入体细胞,从而调节受体细胞的基因转录[14]。有研究表明,中药来源miRNA还可以通过脂质汤剂体和本草体的形式实现稳定递送[15,16]。李之清等[17]从植物汤剂中分离鉴定出一类植物来源的外泌体样纳米颗粒(exosome-likenanoparticles,ELNs),称为汤剂体,此成分可能是植物药汤剂发挥治疗作用的主要成分。在对红景天汤剂有效成分研究中,采用差速离心法分离鉴定到了新型组分汤剂体,并将分离出的汤剂体作用于转化生长因子-β1(transforming growth factorβ1,TGF-β1)诱导的肺纤维化细胞模型中。与红景天汤剂作用相比,两者虽然都能降低人胚肺成纤维细胞模型中纤维化蛋白的表达,但是汤剂体表现出更好的抑制效果。在蒲公英有效成分的研究过程中,同样在蒲公英汤剂中分离出了特定的汤剂体,与蒲公英汤剂相比,汤剂体能够更有效降低由聚肌酐多胞苷酸诱导的人非小细胞肺癌细胞系(A549)促炎因子的产生。上述实验研究表明,通过脂质汤剂体的形式,可以将中药来源的miRNA进行包裹递送进入细胞内,发挥治疗效果[18]。还有一些植物来源miRNA无法被脂质体包裹,而是依赖胃黏膜顶细胞的跨膜蛋白(systemic RNAinterference-deficient-1 transmembrane familymember 1,SIDT1)进行转运,提示SIDT1是介导外源miRNA吸收的关键蛋白质。有趣的是,在极低pH胃酸环境的刺激下,SIDT1的胞外结构域(extracellular domain,ECD)与miRNA的亲和力增加,且这种结合进一步引发了ECD的寡聚化,为外源miRNA的转运提供核酸孔道的潜力,极大程度地促进外源miRNA的吸收。这是中药miRNA发挥跨界调控的另一条重要的理论依据[19,20]。同时,植物代谢物中的活性成分也能抑制RNases的活性,起到保护外源性miRNA完整性的作用。有研究证明,从雷公藤中提取的活性成分——雷公藤内酯醇,能够抑制RNA聚合酶的表达[21],从而起到对外源性miRNA完整性的保护作用。综上所述,中药来源的miRNA要实现跨物种调节基因表达的作用,需要能够顺利通过消化系统,保持结构的稳定,依赖适配介质经循环系统靶向运输到作用细胞,与特定基因发生靶向结合。这些条件的满足为中药miRNA发挥抗病作用提供了基础。
有研究证明,部分miRNA具有抑制病毒复制的能力,可用于治疗由病毒感染引起的疾病,如冠状病毒、轮状病毒、登革热病毒、疱疹病毒、白斑综合征病毒、丙型肝炎病毒、呼吸道合孢病毒和人体免疫缺陷病毒等[22]。传统中药忍冬,也被称为金银花,已证实对多种病毒具有较强的抑制效果。有研究发现,金银花中含有多种有效成分,如有机酸类、黄酮类、挥发油类、三萜皂苷类等,可发挥抗炎、降血糖、抗病毒、增强免疫力等作用[23]。有研究发现,金银花中的miR-2911作为有效成分可以直接靶向多种病毒基因。研究表明,miR-2911可以直接靶向水痘-带状疱疹病毒的IE62基因抑制其蛋白合成,从而对水痘-带状疱疹病毒感染有治疗作用[24]。研究还发现,从金银花汤中提取的miR-2911可以阻止肠道病毒71型的复制,通过靶向抑制肠道病毒71型的外壳蛋白1(viral protein 1,VP1)合成基因,阻止病毒外壳形成,从而抑制病毒繁殖[25]。此外,miR-2911还可以与埃博拉病毒中的基质蛋白(viral protein 40,VP40)和糖蛋白(glycoprotein,GP)基因结合,抑制其翻译过程,对埃博拉病毒感染起到治疗效果[20]。有研究表明,miR-2911在2019新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)基因组中有28个结合位点,能够抑制几乎所有SARS-CoV-2蛋白的翻译。实际临床观察发现,将miR-2911应用于SARS-CoV-2患者治疗中能够加速康复进程[26]。综上所述,通过靶向病毒基因,中药来源的特定miRNA展现了抑制病毒复制和治疗相关疾病的潜力。
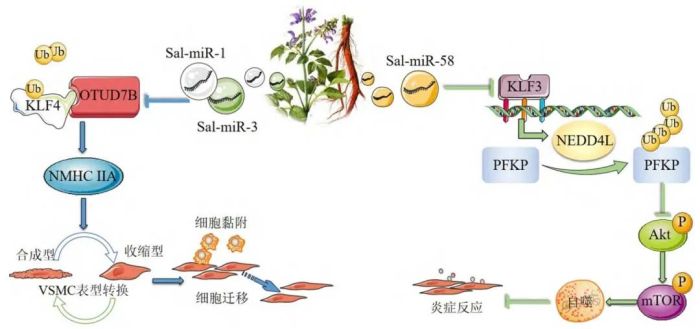
我国心血管疾病的发病率持续上升,在各类疾病中也是死亡率最高的一种[27]。有研究证明,多种心血管类疾病的发生与体内miRNA的异常表达相关[28]。本课题组在前期对丹参miRNA进行高通量测序鉴定的研究中发现,丹参中存在一定的特异性miRNA,这些miRNA在哺乳动物体内经消化道被吸收和利用。其中,丹参来源的Sal-miR-1和Sal-miR-3能够跨物种发挥调控作用,通过与小鼠体内含有卵巢肿瘤结构域的去泛素酶7B(OTUdeubiquitinase 7B,OTUD7B)的3′UTR端结合,消除凝血酶对含有卵巢肿瘤结构域的去泛素酶7B基因的上调作用,而含有卵巢肿瘤结构域的去泛素酶7B下调促进了转录因子4(kininogens leukocyteantigen-related family 4,KLF4)的泛素化,降低其蛋白表达水平,进而促进下游非肌肉肌浆球蛋白重链ⅡA(non-muscle myosin heavy chain ⅡA,NMHCⅡA)基因表达提高,这有助于抑制血管平滑肌细胞(vascular smooth muscle cell,VSMC)表型转换,缓解了VSMC的迁移和对单核细胞的黏附,从而有效改善血管内膜增生[29]。此外,丹参来源Sal-miR-58可通过调控KLF3/NEDD4L/PFKP轴诱导自噬并减轻VSMC的炎症反应,具体机制为SalmiR-58能够与Krüppel样转录因子3(Krüppel-likefactor 3,KLF3)的3′UTR段结合,降低KLF3的表达水平,达到解除KLF3对神经元前体细胞表达发育下调4样蛋白(neural precursor cell expressed,developmentally down-regulated 4-like,NEDD4L)表达抑制作用,间接提高NEDD4L的表达水平。高表达的NEDD4L可增强血小板型磷酸果糖激酶(recombinant phosphofructokinase platelet,PFKP)的泛素化水平,加快PFKP的分解,从而降低PFKP的水平,影响Akt/mTOR信号通路的激活,引起细胞自噬,减轻VSMC炎症反应[30],如图2所示。
中药是中华民族的瑰宝。许多中药材都来自药用植物,这些中药材的药效物质基础不仅仅是次级代谢产物,如多酚、生物碱、单宁和皂苷等,还可能是miRNA等核酸类物质。最初在秀丽隐杆线虫中发现了miRNA[3],有研究表明,miRNA在人类多种疾病中扮演着重要的角色[4,5]。植物来源的miRNA和动物体内miRNA在进化过程中是相互独立演化的,因此它们在序列、前体结构和成熟过程等方面都有所差异。首先,在动物体内很少有与植物miRNA的同源序列;其次,植物miRNA的pre-miRNA相比动物更长,动物pre-miRNA的长度通常在65~70个核苷酸之间,而植物的premiRNA可以长达数百个核苷酸,并且其长度也更加多变;此外,动物体内的Drosha酶在植物中缺乏同源蛋白,导致植物pri-miRNA的两次剪切均在植物细胞核中,且由RNaseⅢ型核酸内切酶(dicer-like1,DCL1)完成;更重要的是,植物miRNA的3′端会经过HEN1甲基转移酶的甲基化修饰,而动物体内的miRNA则缺少这种甲基化修饰[6]。以上因素决定了植物来源的miRNA在结构和功能上与动物体内的miRNA存在很大差异。2012年,南京大学张辰宇团队研究发现,稻米中富含一类丰富的miRNA分子miR-168a,其可以通过人体消化系统进入血液和其他多种器官,并且具有靶向调控体内低密度脂蛋白受体衔接蛋白1(low-densitylipoprotein receptor related protein 1,LDLRAP1)基因表达的能力,进而影响人体血脂水平[7]。这一发现开启了植物来源miRNA跨物种调节动物体内基因发挥疾病治疗作用的研究热点。这与我国传统观念中所谓“吃啥补啥”“以形补形”,特别是以饮食调节身体状态、治疗疾病,即“食疗”的理念相契合,为研究传统中草药的有效成分提供了新的研究思路,为小核酸类新药的开发与应用提供了新的方向。
miRNA是广泛存在于真核生物中的一类核酸分子,在进化过程中相对保守。一直以来,由于RNA易于降解和不稳定的特点,对miRNA的研究都只限于在各自的物种之中,很难想象不同物种来源的miRNA可以进行跨界调控[8]。要实现中药来源miRNA跨物种调节发挥抗病作用,需要满足多个前提条件。首先,在炮制和加工过程中要保持中药来源miRNA的稳定性,避免其降解和结构破坏。Wang等[9]实验证实,经高温煎煮后,人参提取液中的miRNA仍可稳定存在。西兰花经过高温烹煮后,miR-159的表达仍可以被检测到[10]。经膨化处理后,玉米中仍可检测到18种miRNA[11]。以上实验都提示了植物来源的miRNA可以在高温环境下保持结构和功能的稳定,这为miRNA发挥跨物种调控作用提供了前提。其次,中药来源miRNA需要顺利进入消化系统和循环系统,并保持结构稳定。研究表明,外源miRNA主要是通过摄食途径在不同物种之间传播,并且能够免受在体内核酸酶的分解,稳定进入循环系统。如服用生地黄水煎剂后,生地黄来源的miR-5140、miR5137、miR-5141等miRNA通过消化道稳定地进入人体血液当中[12]。有研究发现,将金银花水煎液喂食小鼠后,金银花来源的miR-2911能稳定存在于小鼠的外周血和肺中,并呈现较高的表达水平[13]。植物来源miRNA因其3′端的甲基化修饰,相对于动物来源miRNA更加稳定不易分解。因此,中药来源miRNA在消化系统中的运输和稳定性得到了保证。最后,中药来源miRNA需要依赖适配介质进行稳定运输,靶向结合到体内特定基因。已有研究表明,外源miRNA可以通过细胞外囊泡包裹的方式进入体细胞,从而调节受体细胞的基因转录[14]。有研究表明,中药来源miRNA还可以通过脂质汤剂体和本草体的形式实现稳定递送[15,16]。李之清等[17]从植物汤剂中分离鉴定出一类植物来源的外泌体样纳米颗粒(exosome-likenanoparticles,ELNs),称为汤剂体,此成分可能是植物药汤剂发挥治疗作用的主要成分。在对红景天汤剂有效成分研究中,采用差速离心法分离鉴定到了新型组分汤剂体,并将分离出的汤剂体作用于转化生长因子-β1(transforming growth factorβ1,TGF-β1)诱导的肺纤维化细胞模型中。与红景天汤剂作用相比,两者虽然都能降低人胚肺成纤维细胞模型中纤维化蛋白的表达,但是汤剂体表现出更好的抑制效果。在蒲公英有效成分的研究过程中,同样在蒲公英汤剂中分离出了特定的汤剂体,与蒲公英汤剂相比,汤剂体能够更有效降低由聚肌酐多胞苷酸诱导的人非小细胞肺癌细胞系(A549)促炎因子的产生。上述实验研究表明,通过脂质汤剂体的形式,可以将中药来源的miRNA进行包裹递送进入细胞内,发挥治疗效果[18]。还有一些植物来源miRNA无法被脂质体包裹,而是依赖胃黏膜顶细胞的跨膜蛋白(systemic RNAinterference-deficient-1 transmembrane familymember 1,SIDT1)进行转运,提示SIDT1是介导外源miRNA吸收的关键蛋白质。有趣的是,在极低pH胃酸环境的刺激下,SIDT1的胞外结构域(extracellular domain,ECD)与miRNA的亲和力增加,且这种结合进一步引发了ECD的寡聚化,为外源miRNA的转运提供核酸孔道的潜力,极大程度地促进外源miRNA的吸收。这是中药miRNA发挥跨界调控的另一条重要的理论依据[19,20]。同时,植物代谢物中的活性成分也能抑制RNases的活性,起到保护外源性miRNA完整性的作用。有研究证明,从雷公藤中提取的活性成分——雷公藤内酯醇,能够抑制RNA聚合酶的表达[21],从而起到对外源性miRNA完整性的保护作用。综上所述,中药来源的miRNA要实现跨物种调节基因表达的作用,需要能够顺利通过消化系统,保持结构的稳定,依赖适配介质经循环系统靶向运输到作用细胞,与特定基因发生靶向结合。这些条件的满足为中药miRNA发挥抗病作用提供了基础。
有研究证明,部分miRNA具有抑制病毒复制的能力,可用于治疗由病毒感染引起的疾病,如冠状病毒、轮状病毒、登革热病毒、疱疹病毒、白斑综合征病毒、丙型肝炎病毒、呼吸道合孢病毒和人体免疫缺陷病毒等[22]。传统中药忍冬,也被称为金银花,已证实对多种病毒具有较强的抑制效果。有研究发现,金银花中含有多种有效成分,如有机酸类、黄酮类、挥发油类、三萜皂苷类等,可发挥抗炎、降血糖、抗病毒、增强免疫力等作用[23]。有研究发现,金银花中的miR-2911作为有效成分可以直接靶向多种病毒基因。研究表明,miR-2911可以直接靶向水痘-带状疱疹病毒的IE62基因抑制其蛋白合成,从而对水痘-带状疱疹病毒感染有治疗作用[24]。研究还发现,从金银花汤中提取的miR-2911可以阻止肠道病毒71型的复制,通过靶向抑制肠道病毒71型的外壳蛋白1(viral protein 1,VP1)合成基因,阻止病毒外壳形成,从而抑制病毒繁殖[25]。此外,miR-2911还可以与埃博拉病毒中的基质蛋白(viral protein 40,VP40)和糖蛋白(glycoprotein,GP)基因结合,抑制其翻译过程,对埃博拉病毒感染起到治疗效果[20]。有研究表明,miR-2911在2019新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)基因组中有28个结合位点,能够抑制几乎所有SARS-CoV-2蛋白的翻译。实际临床观察发现,将miR-2911应用于SARS-CoV-2患者治疗中能够加速康复进程[26]。综上所述,通过靶向病毒基因,中药来源的特定miRNA展现了抑制病毒复制和治疗相关疾病的潜力。
我国心血管疾病的发病率持续上升,在各类疾病中也是死亡率最高的一种[27]。有研究证明,多种心血管类疾病的发生与体内miRNA的异常表达相关[28]。本课题组在前期对丹参miRNA进行高通量测序鉴定的研究中发现,丹参中存在一定的特异性miRNA,这些miRNA在哺乳动物体内经消化道被吸收和利用。其中,丹参来源的Sal-miR-1和Sal-miR-3能够跨物种发挥调控作用,通过与小鼠体内含有卵巢肿瘤结构域的去泛素酶7B(OTUdeubiquitinase 7B,OTUD7B)的3′UTR端结合,消除凝血酶对含有卵巢肿瘤结构域的去泛素酶7B基因的上调作用,而含有卵巢肿瘤结构域的去泛素酶7B下调促进了转录因子4(kininogens leukocyteantigen-related family 4,KLF4)的泛素化,降低其蛋白表达水平,进而促进下游非肌肉肌浆球蛋白重链ⅡA(non-muscle myosin heavy chain ⅡA,NMHCⅡA)基因表达提高,这有助于抑制血管平滑肌细胞(vascular smooth muscle cell,VSMC)表型转换,缓解了VSMC的迁移和对单核细胞的黏附,从而有效改善血管内膜增生[29]。此外,丹参来源Sal-miR-58可通过调控KLF3/NEDD4L/PFKP轴诱导自噬并减轻VSMC的炎症反应,具体机制为SalmiR-58能够与Krüppel样转录因子3(Krüppel-likefactor 3,KLF3)的3′UTR段结合,降低KLF3的表达水平,达到解除KLF3对神经元前体细胞表达发育下调4样蛋白(neural precursor cell expressed,developmentally down-regulated 4-like,NEDD4L)表达抑制作用,间接提高NEDD4L的表达水平。高表达的NEDD4L可增强血小板型磷酸果糖激酶(recombinant phosphofructokinase platelet,PFKP)的泛素化水平,加快PFKP的分解,从而降低PFKP的水平,影响Akt/mTOR信号通路的激活,引起细胞自噬,减轻VSMC炎症反应[30],如图2所示。
图2 丹参miRNA的调控机制
另外,我们还在蒙药尖叶假龙胆中也筛选鉴定出特定的miRNA,发现尖叶假龙胆来源的GenmiR-1可靶向抑制心肌成纤维细胞中HAX1/HMG20A/Smads通路激活,从而降低炎症反应和心肌纤维化的发生。Gen-miR-1可以直接结合HCLS1关联蛋白X-1(HCLS1 associated protein X1,HAX1)的3′UTR段,降低HAX1基因的表达,从而降低HAX1对高迁移率组蛋白20A(high mobilitygroup protein 20A,HMG20A)的相互作用。同时,HMG20A的表达下调则抑制TGF-β1/Smads信号通路的激活,降低心肌纤维化的发生。在TGF-β1诱导心肌成纤维细胞激活过程中,Gen-miR-1发挥了抑制心肌成纤维细胞炎症的作用[31]。综上所述,活血化瘀、清热解毒类中药来源的特定miRNA将引领抗心血管重构性疾病新型中药的研发,为逆转和防治心血管重构性疾病提供前瞻性的新方法。
现代医学广泛认为,十字花科植物西兰花具有抗癌功效。实验发现,西兰花中的天然化合物吲哚-3-甲醇能够与WWP1基因靶向结合,降低抑癌基因PTEN(phosphatase and tensin homolog deleted onchromosome ten)泛素K27(ubiquitin-K27,K27)多聚泛素化水平,从而抑制肿瘤增殖[32]。有研究还表明,西兰花来源的两种miRNA(miR-156a和miR159)同样具有一定的抗肿瘤作用[33]。实验发现,经过高温烹饪处理后,西兰花中的miR-159仍可以保持活性,并且能够抑制乳腺癌细胞的增殖。具体机制是miR-159在乳腺癌细胞中与转录因子7(transcription factor 7,TCF7)结合,降低了肿瘤基因MYC活性,从而抑制乳腺癌细胞的增殖,而miR-159在非肿瘤细胞中与转录因子7靶向结合,并没有显示出抑制细胞增殖的作用[34]。在体外实验中,人工合成的miR-156a可与人鼻咽癌细胞中的连接黏附分子A结合,降低了人鼻咽癌细胞转移的风险[35]。这些研究结果均表明,西兰花来源的miRNA也是西兰花发挥抗肿瘤效应的有效生物学活性成分之一。另外,传统中草药金银花也对肿瘤具有一定的治疗作用。研究发现,金银花来源的miR-2911可与TGF-β1基因靶向结合,促进淋巴T细胞对肿瘤组织的浸润,降低TGF-β1的表达水平,可以降低肿瘤微环境中产生的免疫抑制作用,从而抑制小鼠结肠癌的恶化进程。此外,miR-2911还可以通过抑制TGF-β信号通路,抑制食管癌、结直肠癌和胰腺癌等多种常见肿瘤细胞迁移。这些研究证实了金银花中的miR-2911对多种肿瘤的发生和发展具有潜在的治疗作用[36]。除植物药外,动物药也是传统中药中的重要组成部分。传统中药壁虎在临床治疗中已被证明对癌症具有治疗效果,并且具有广谱抗肿瘤活性。研究发现,壁虎能够增加癌细胞中自噬相关蛋白的表达量,从而加速肝癌细胞(HepG2 cell,Hepg2)的细胞死亡速率[37]。但动物中药的有效成分复杂,作用机理不明,同时存在一定的不良反应,这限制了动物中药及其活性成分在疾病治疗中的应用。因此,如何寻找更加稳定、有效且安全的有效成分,并阐明其作用机制,已经成为了动物药治疗疾病开发过程中亟待解决的问题。通过高通量测序技术,目前在壁虎中已鉴定出137种miRNA成熟体,其中包括24种新型特异的miRNA成熟体,研究已证实,壁虎来源的miR-10b-5p可靶向人类肝癌基因SRXN1,并降低其蛋白表达水平,从而抑制肝癌的发展。这一研究结果为寻找动物中药的有效成分及其作用机制提供了线索。综上所述,传统中药来源的miRNA为中药防治肿瘤提供了新的思路。
中药来源的miRNA同样还具有抗衰老、抑制炎症、增强免疫力、抗骨质疏松的作用。例如,来自灵芝的miRNA——Glu-miR-01和Glu-miR-03可以降低人体皮肤成纤维细胞 (human skinfibroblast,HSF)衰老细胞中关键基因p53、p21、p16的表达,并提高视网膜母细胞瘤肿瘤抑制蛋白的表达,从而延缓人体皮肤成纤维细胞的衰老[38]。草莓果实中的Fv-miR-168可以降低脂多糖和聚肌胞苷酸诱导的白细胞介素-1(interleukin-1,IL1)和肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)的形成,进而影响T细胞的增殖和分化,与正常树突状细胞相比,使用Fv-miR-168处理的树突状细胞,干扰素调节因子-3(interferon regulatory factor3,IRF-3)和干扰素-β(beta-interferon,IFN-β)的mRNA水平显著降低,这表明FvmiR-168可以通过影响β干扰素TIR结构域衔接蛋白(TIR-domaincontaining adaptor inducing interferon-β,TRIF)通路来抑制T细胞的增殖,从而影响树突状细胞对炎症的反应[39]。向静等[40]提取甘草中的miRNA,并研究甘草来源的miRNA对外周血单核细胞(peripheralblood mononuclear cell,PBMC)增殖的影响。他们的实验结果发现,PBMC经甘草来源的miR-156、miR-1511、miR-8155处理后,显著提高了B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)的表达,同时降低人细胞凋亡调节因子Bax(human apoptosisregulatory factor Bax,Bax)的表达,抑制了PBMC的凋亡,同时PBMC中的组织相容性复合体Ⅱ类细胞表面受体细胞增加,抗原提呈的能力明显增强,从而证明了甘草来源的miRNA具有调节机体免疫功能的作用。另外,牛乳外泌体的miRNA能直接作用于白介素-10(interleukin-10,IL-10)的mRNA来调节相应功能蛋白的表达,进而参与各种免疫调控反应[41]。Liu等[42]通过研究发现,牛乳中的miR-151-3p可以靶向结合到人体内的转录激活因子3的3′UTR端,抑制其表达,从而影响其下游信号转导,调控IL-6在体内的生成,从而对免疫应答产生影响。除此之外,牛乳中的miRNA在人体中也会带来负面影响,其中牛乳中的miR-148a可与脂肪内源性抑制剂靶向结合,抑制其表达,进而加速脂肪细胞的分化,引起机体的肥胖;而在小鼠过量摄入牛乳中的miR-29a之后,miR-29a可以直接靶向结合小鼠前脂肪细胞的富含半胱氨酸分泌蛋白导致其功能失调,进而导致小鼠对葡萄糖的摄取和转运量下降,引起其2型糖尿病的病情加重。枸杞来源的小核酸类物质miR-162a可以通过小鼠胃肠道吸收进入血液,发挥跨界调控的作用,枸杞来源的miR-162a能够直接靶向小鼠骨髓间充质干细胞,促进其分化为成骨细胞。这对阐明枸杞坚筋骨的作用原理提供新的依据,也为其对骨质疏松症的防治提供了新的思路[43]。综上所述,中药来源miRNA在抗衰老、抑制炎症、增强免疫力、防骨质疏松方面也具有潜在的应用价值。
miRNA可以被视为连接不同物种的一种媒介,类似于物种进行社会交往的媒介物,因此有人将它们称作“Social RNA”。随着高通量测序技术的发展和分子生物学与生物信息学的深入研究,miRNA的研究已经成为生物学研究的一大热点。鉴于内源性miRNA的特异性与稳定性,它已成为多种疾病的重要生物标记物[44],由于外源性miRNA具有跨物种调控的特性,也越来越受人们的重视[45]。miRNA具有低毒、高效、多靶点调控的特点,一方面可用于多基因疾病,例如肿瘤、心血管等疾病的治疗,它可以与化疗药物联合使用,增强化疗药物的敏感性,并有望成为新的更有效的临床治疗方法[46];另一方面植物来源miRNA能够通过胃肠道进入机体循环系统,不仅可以作为药食同源类物质对机体免疫平衡的调节因子,而且还可能成为中药活性成分的开发的新方向。尽管外源性miRNA具有跨物种调节机体的优势,但目前仍面临一些困难和挑战[47]。例如,如何保证外源性miRNA在进入机体后不被核酸酶降解,并能够有效地转运到靶细胞发挥一定的作用。此外,对外源性miRNA进行长期应用的毒性研究仍然缺乏,这也限制了其开发和应用[46]。可以期待的是,随着新的低毒性载体的研究和开发,中药来源miRNA有望成为小核酸类药物在生物医学领域新的治疗手段。在众多的基因表达调控中,中药来源miRNA扮演了重要作用,由于中药来源miRNA的功能逐渐被发现,其研究前景非常广阔,但目前利用中药来源miRNA的治疗应用仍面临困难和瓶颈[48]。目前有关中药来源miRNA的研究还存在许多空白,需要进行更深入探究,充分利用中药资源,扩展中药来源miRNA在抗病毒、治疗心血管疾病、抗肿瘤、抗衰老、抗炎症和增强免疫能力等方面的功能,将为生物医学诊断和药物开发提供新的思路和策略。然而,尽管中药中的miRNA显示出许多有希望的药理学特性,但其在临床应用中的潜力和机制仍需进一步研究和验证。首先,需要深入了解这些miRNA的作用机制,以确定它们对靶点基因和信号通路的调控方式。其次,需要研究这些miRNA的稳定性和药代动力学特性,以确保其在体内有效存在和发挥作用。此外,还需要进行更多的临床试验,以评估中药中miRNA的安全性和有效性,并确定其与其他治疗手段的联合应用策略。综上所述,中药来源的miRNA具有广泛的潜力和应用前景。深入研究中药来源miRNA,可以更好地理解中药药理作用,并为研究更精确的药效提供新的思路和策略。中药miRNA的开发和应用将为临床治疗和生物医学研究提供新的机会和可能性。
[1] Yu Y, Jia T, Chen X. The ‘how’ and ‘where’ of plantmicroRNA s. New Phytol, 2017, 216(4): 1002-1017
[2] 梁文权. 精神分裂症相关miR-501-3p表达下调通过mGluR5介导的谷氨酸能传递亢进导致小鼠社交与记忆异常[D]. 广州: 南方医科大学, 2023
[3] 李小凡, 冀蒙蒙, 翟晓巧. 植物中miRNA的研究进展. 河南林业科技, 2019, 39(2): 21-24
[4] 于瑶, 刘建华, 吴丽娜. miRNA在原发性肾小球疾病诊断及治疗中应用的研究进展. 中国免疫学杂志, 2023,39(1): 220-224
[5] 代禹美, 杜文雅, 马枫茜, 等. 外泌体miRNA在感染性疾病治疗中的应用研究进展. 中国病原生物学杂志, 2023,18(8): 987-990
[6] 孟桂智, 刘宝宝, 李雅辉, 等. 动植物miRNA实现跨物种基因调控的研究进展. 畜牧与饲料科学, 2022, 43(2): 7-13
[7] 陈真真, 蔡军. osa-miR168a-5p靶向调节人源ADD1及E2F2基因表达的研究. 医学信息, 2020, 33(11): 64-66
[8] 彭朦媛, 王颖芳. 植物microRNA跨界调控哺乳动物基因表达研究进展. 广东药科大学学报, 2019, 35(5): 714-718
[9] Wang Y, Peng M, Wang W, et al. Verification of miRNAsin ginseng decoction by high-throughput sequencing andquantitative real-time PCR. Heliyon, 2019, 5(4): e01418
[10] 田雪梅, 张君, 荣华, 等. 植物微小RNA跨界调控机制及其应用研究进展. 药学学报, 2020, 55(6): 1137-1146
[11] Luo Y, Wang P, Wang X, et al. Detection of dieteticallyabsorbed maize-derived microRNAs in pigs. Sci Rep,2017, 7(1): 645
[12] 王宇亮, 王颖芳, 杨泽民, 等. 丹参、生地黄中miRNA在人体血液中分离、鉴定及表达分析. 中国实验方剂学杂志, 2012, 18(19): 121-124
[13] 周祯. 中药金银花编码的MIR2911抗病毒作用的研究[D]. 南京: 南京大学, 2015
[14] 刘滢, 张力, 杨叶虹. 外泌体miRNAs在糖尿病微血管并发症中的作用研究进展. 复旦学报(医学版), 2023, 50(6): 897-905
[15] 郑依玲, 欧阳勇, 梅全喜, 等. 金银花在新型冠状病毒肺炎防治中的应用探析. 亚太传统医药, 2021, 17(7): 180-184
[16] Ni LQ, Chen LL, Huang X, et al. Combating COVID-19with integrated traditional Chinese and Western medicinein China. Acta Pharm Sin B, 2020, 10(7): 1149-1162
[17] 李之清, 王志清, 张艳丽, 等. 巨胞饮内吞途径介导蒲公英汤剂体进入细胞. 基础医学与临床, 2019, 39(7): 925-931
[18] Li X, Liang Z, Du J, et al. Herbal decoctosome is a novelform of medicine. Sci China Life Sci, 2019, 62(3): 333-348
[19] Zheng L, Yang T, Guo H, et al. Cryo-EM structures ofhuman SID-1 transmembrane family proteins and implications for their low-pH-dependent RNA transportactivity. Cell Res, 2024, 34(1): 80-83
[20] 鲁良胜. 哺乳动物胃肠道吸收外源microRNA的机制研究[D]. 南京: 南京大学, 2021
[21] 胡兰燕. 雷公藤内酯醇通过调控转录因子GLI抗上皮性卵巢癌的分子机制研究[D]. 南昌: 南昌大学
[22] 孙博, 林嘉杰, 王树松, 等. siRNA和microRNA用于抗病毒的研究进展. 中国医药生物技术, 2021, 16(1): 51-57
[23] 刘欣元, 盛德乔. 金银花有效成分的抗菌作用机制研究进展. 抗感染药学, 2023, 20(8): 783-789
[24] Huang Y, Liu H, Sun X, et al. Honeysuckle-derivedmicroRNA2911 directly inhibits varicella-zoster virusreplication by targeting IE62 gene. J Neurovirol, 2019,25(4): 457-463
[25] Li X, Huang Y, Sun M, et al. Honeysuckle-encodedmicroRNA2911 inhibits Enterovirus 71 replication viatargeting VP1 gene. Antiviral Res, 2018, 152: 117-123
[26] Zhou LK, Zhou Z, Jiang XM, et al. Absorbed plantMIR2911 in honeysuckle decoction inhibits SARS-CoV-2replication and accelerates the negative conversion ofinfected patients. Cell Discov, 2020, 6(1): 54
[27] 胡盛寿, 高润霖, 刘力生, 等. 《中国心血管病报告2018》概要. 中国循环杂志, 2019, 34(3): 209-220
[28] Ding Y, Zhang Y, Lu J, et al. MicroRNA-214 contributesto Ang II-induced cardiac hypertrophy by targeting SIRT3to provoke mitochondrial malfunction. Acta PharmacolSin, 2021, 42(9): 1422-1436
[29] Yang G, Zheng B, Qin Y, et al. Salvia miltiorrhiza-derivedmiRNAs suppress vascular remodeling through regulatingOTUD7B/KLF4/NMHC IIA axis. Theranostics, 2020, 10(17): 7787-7811
[30] Qin Y, Zheng B, Yang G, et al. Salvia miltiorrhiza-derivedSal-miR-58 induces autophagy and attenuates inflammation in vascular smooth muscle cells. Mol Ther NucleicAcids, 2020, 21: 492-511
[31] Zhang T, Zhang Y, Li S, et al. Gentianella acuta-derivedGen-miR-1 suppresses myocardial fibrosis by targetingHAX1/HMG20A/Smads axis to attenuate inflammation incardiac fibroblasts. Phytomedicine, 2023, 118: 154923
[32] Lee YR, Chen M, Lee JD, et al. Reactivation of PTENtumor suppressor for cancer treatment through inhibitionof a MYC-WWP1 inhibitory pathway. Science, 2019, 364(6441): eaau0159
[33] 陶涵金, 陈冉, 高崎. 植物microRNA跨界调控作用. 中国生物化学与分子生物学报, 2023, 39(12): 1685-1695
[34] Chin AR, Fong MY, Somlo G, et al. Cross-kingdominhibition of breast cancer growth by plant miR159. CellRes, 2016, 26(2): 217-228
[35] Tian Y, Cai L, Tian Y, et al. miR156a Mimic represses theepithelial-mesenchymal transition of human nasopharyngeal cancer cells by targeting junctional adhesionmolecule A. PLoS One, 2016, 11(6): e0157686
[36] 许梦珍. 金银花来源microRNA2911靶向TGF-β1抗肿瘤的疗效和机制研究[D]. 南京: 南京大学, 2021
[37] 朱文豪. 壁虎中调控人肝癌靶基因的外源性miRNA分析与鉴定[D]. 长沙: 湖南中医药大学, 2022
[38] 余雯斌, 徐晓渊, 盛清. 灵芝miRNA对人皮肤成纤维细胞衰老的作用研究. 浙江理工大学学报(自然科学版),2023, 51(1): 120-129
[39] Cavalieri D, Rizzetto L, Tocci N, et al. Plant microRNAsas novel immunomodulatory agents. Sci Rep, 2016, 6(1):25761
[40] 向静, 黄洁嫦, 徐畅, 等. 甘草水提物中miRNA对人免疫细胞基因表达的影响. 中国中药杂志, 2017, 42(9):1752-1756
[41] Amit S, Manish K, Jyotirmoi A, et al. Correction:posttranscriptional regulation of interleukin-10 expressionby hsa-miR-106a. Proc Natl Acad Sci USA, 2020, 117(22): 12498-12499
[42] Liu X, Su X, Xu S, et al. Correction to: MicroRNA in vivoprecipitation identifies miR-151-3p as a computationalunpredictable miRNA to target Stat3 and inhibits innateIL-6 production. Cell Mol Immunol, 2020, 17(1): 110
[43] 唐校柱, 闵捷, 吕昕予, 等. 枸杞子功效物质的药理作用研究进展. 交通医学, 2023, 37(4): 345-348
[44] 李颖, 张再伟. miRNA在急性心肌梗死早期诊断中的作用及其机制研究. 医学信息, 2022, 35(5): 40-43
[45] 张萌, 孙芮, 张楠, 等. 药用植物miRNA的研究进展. 中国现代中药, 2020, 22(12): 2103-2107
[46] 韩明, 张梦圆, 方盛泉. 外泌体中circRNA-miRNAmRNA网络在胃癌发生发展及其治疗中的作用. 中国肿瘤生物治疗杂志, 2024, 30(12): 1116-1122
[47] 牛捷, 杨婧, 赵耀伟, 等. 口服中药miRNA的跨界调控作用机制的思考与探讨. 中国药理学通报, 2022, 38(5):659-664
[48] 方路, 刘睿奇, 梁鹏, 等. 外泌体miRNAs在器官纤维化中作用的研究进展. 基础医学与临床, 2023, 43(9):1472-1476
撰稿人 | 张鸿立、刘子奇、马心怡、杨高山 生命的化学
责任编辑 | 邵丽竹
审核人 | 何发














评论 0
没有更多评论了