疫苗佐剂的发展现状和未来展望
疫苗接种无疑是人类历史上最引人注目的健康成就之一。在短短两个多世纪的时间里,疫苗使我们实现了非凡的目标,如彻底根除天花、消灭了世界大部分地区的脊髓灰质炎,并使许多传染病的死亡率和发病率大幅下降。
疫苗接种政策是公共卫生的基石,人们非常重视确保接种安全有效的疫苗。疫苗的效力不仅取决于抗原成分,还取决于经常使用的佐剂,以更有效的方式刺激免疫系统。佐剂是添加到疫苗中以改善对抗原免疫反应的成分。此外,佐剂还有几个好处,如可使每剂疫苗的抗原量和疫苗接种次数减少;在某些情况下,它们还增加了抗原成分的稳定性,延长了其半衰期,并间接提高了其免疫原性。
抗原与佐剂相关,它们能够通过激活先天免疫系统诱导局部促炎反应,导致免疫细胞募集到注射部位。抗原-佐剂复合物通过病原体相关分子模式(PAMP)来激活模式识别受体(PRR)途径。这导致先天免疫细胞的激活,产生细胞因子和趋化因子。
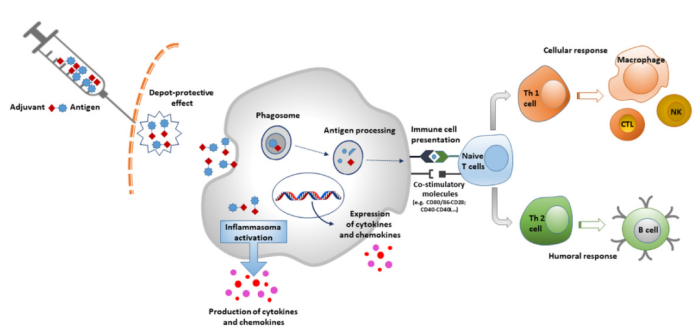
目前,欧洲药品管理局和美国食品药品监督管理局(FDA)批准的绝大多数人类使用的疫苗都使用铝盐作为佐剂,这是疫苗配方中使用最古老的佐剂。为了提高疫苗的安全性和有效性,增加新佐剂的种类和数量是非常必要的。纳米技术和分子生物学等现代技术的进步有力地促进了对佐剂成分的开发过程,从而提高了疫苗的效力。一种好的佐剂必须是安全的、有效的、易于生产的;具有良好的药用特性(pH值、渗透压、内毒素水平等)和耐用性;最后,在经济上也可承受。微粒、乳液以及免疫刺激剂在疫苗生产中显现出巨大的潜力。
佐剂可以根据不同的标准进行分类,例如它们的物理化学性质、来源和作用机制。最受关注的分类系统之一是基于其作用机制,将其分为两大类:递送系统佐剂和免疫增强佐剂。
铝盐
铝盐的佐剂特性是在20世纪20年代发现的,自1926年以来,这些化合物一直被用作疫苗佐剂。作为使用时间最长、疫苗中使用频率最高的佐剂,目前获得许可的疫苗中约有三分之一含有铝佐剂。
在疫苗中,铝以结晶氢氧化铝(AlH)或无定形羟基磷酸铝(AlP)的复合聚合物的形式存在,形成聚集的纳米颗粒。AlH具有针状纳米颗粒的外观,而在透射电子显微镜下观察时,AlP呈现为网状。这两种铝佐剂形式通常都溶解在柠檬酸盐中,但AlP比AlH更可溶。抗原通过静电相互作用和配体交换吸附在佐剂颗粒表面。铝盐/抗原结合增强抗原呈递细胞(APC)的抗原摄取和呈递。此外,铝盐刺激NLRP3炎症小体的激活,导致IL-1β和IL-18的产生,从而引起局部炎症和APC的募集。
许多疫苗使用铝佐剂,例如针对白喉和破伤风、百日咳、乙型肝炎以及肺炎球菌和脑膜炎球菌的疫苗。在欧洲,《欧洲药典》将疫苗中的铝含量设定为每剂最多1.25 mg。在美国,《美国联邦法规》将生物产品(包括疫苗)中的铝含量设定为0.85mg/剂。与食品中主要以可溶性柠檬酸盐或氯化物盐形式存在的铝不同,用作佐剂的无机铝化合物的可溶性较差;这是它们辅助作用模式的一部分。因此,由于这种在生理pH下较差的溶解性,肌肉内或皮下注射后疫苗中所含铝的吸收率将非常缓慢。
一些研究评估了肌肉注射后铝的动力学。一项实验研究了基于肌内注射用26Al标记的AlH和AlP,铝的总剂量为0.85 mg。结果显示,在实验的28天内,AlH和AlP的吸收率分别为17%和51%。26Al的最大血清浓度(Cmax)为2μg/L。此外,铝的神经毒性已经在体外、离体和动物模型和人类体内进行了研究。对细菌进行的一些体外研究显示没有致突变性。而一些体内研究结果往往不一致和互相矛盾,可能存在方法上的缺陷。因此,迄今为止,尽管铝盐或多或少地产生强烈的氧化应激,但仍无法确定用作佐剂的铝盐(按推荐剂量)是否会产生毒性作用。
弗氏佐剂
弗氏佐剂包括完全和不完全的弗氏佐剂。这两种佐剂都是油包水乳液,能够携带抗原并刺激先天免疫系统。完全弗氏佐剂(CFA)在其结构中包括热杀死的分枝杆菌,其增强免疫反应的刺激。然而,CFA能够诱导强烈、持久的局部炎症,这可能会带来显著的疼痛,并可能在注射部位出现溃疡。不完全弗氏佐剂(IFA)不含分枝杆菌,在20世纪50年代被用作人类流感疫苗的佐剂;与没有佐剂的相同疫苗相比,它可以诱导更强、持久的抗体反应。
IFA的佐剂活性是基于其作为油性抗原沉积物的特征,抗原在注射部位从中连续释放。这同时导致抗原半衰期的增加,以及通过吞噬作用、白细胞募集和浸润以及细胞因子产生强烈的局部先天免疫刺激。然而,IFA在人类疫苗配方中的常规使用引发强烈的副作用。世界卫生组织2005年进行的一项调查显示,约100万IFA受试者的免疫接种有40000名接种者出现严重副作用(如无菌脓肿)。
MF59
MF59是一种油包水乳液,由角鲨烯、Span 85和Tween 80在pH 6.5的10mM柠檬酸钠缓冲液中组成,平均粒径约为165nm。这是1997年意大利批准用于人类疫苗的第一种水包油乳液。目前,它被用于三价和四价(TIV和QIV)流感疫苗Fluad(Seqirus)中。研究表明,MF59的存在提高了流感疫苗在2岁以下儿童中的有效性。MF59也被用做HBV疫苗的佐剂,能够引发强烈的免疫反应,比铝诱导的免疫反应更好。
关于作用机制,MF59具有与铝盐类似的效果。注射部位的贮库活性可以忽略不计,研究表明其半衰期为42小时。相反,MF59具有诱导细胞和体液免疫反应的强大能力,包括产生高滴度的功能性抗体。MF59的存在刺激局部先天免疫细胞分泌趋化因子,如CCL4、CCL2、CCL5和CXCL8,进而通过触发适应性免疫反应来驱动白细胞募集、抗原摄取并迁移到淋巴结。MF59安全且耐受性良好的,在超过35个国家已接种数百万剂。
AS03
AS03是一种水包油佐剂乳液,由表面活性剂聚山梨醇酯80和两种可生物降解的油组成,即在磷酸盐缓冲液中的角鲨烯和DL-α-生育酚。这种佐剂已用于流感疫苗,引发类似于MF59的免疫反应,也用于疟疾疫苗。欧盟于2009年批准销售AS03佐剂疫苗Pandemrix,而AS03佐剂甲型流感(H5N1)单价疫苗于2013年获得FDA的批准。
与MF59相比,α-生育酚的抗氧化和免疫刺激特性似乎更强。此外,研究表明,AS03能够通过激活NF-κB来刺激免疫系统,从而诱导肌肉和淋巴结中的细胞因子和趋化因子分泌,并促进先天免疫细胞的迁移。AS03还可以刺激CD4+T细胞特异性免疫反应,这可以导致持久的中和抗体产生和更高水平的记忆B细胞。AS02在AS03的基础上进一步补充了两种强大的免疫刺激剂,QS-21(一种从黄芪中提取的皂苷)和3-O-去酰基-4′-单磷酸脂质a(MPL),以增强其免疫原性。
病毒样颗粒
病毒样颗粒(VLP)是由自组装衣壳蛋白的外壳组成的二十面体或杆状纳米颗粒(Å20–200 nm);其已被长期研究用于疫苗开发。它们是非传染性颗粒,不包括任何遗传物质。VLP是是由具有重复表位的外部病毒外壳形成的,这些表位会立即被免疫系统识别为非自身,从而产生强大的免疫反应。除了这些重复的结构基序外,VLP的大小与病毒相似(通常在20–800 nm之间),并经过快速有效的处理,即使在没有佐剂的情况下,也能产生快速持久的免疫反应。
目前,有两种重要的疫苗使用病毒样颗粒佐剂诱导免疫:乙型肝炎和乳头瘤病毒(HPV)疫苗。目前使用的乙型肝炎疫苗是一种含有乙型肝炎表面抗原(HBsAg)的重组DNA疫苗,其形式为VLP,用于预防乙型肝炎感染,该疫苗接种于15岁以下的婴儿、儿童和青少年,或感染乙型肝炎的高危人群,在乙型肝炎携带者母亲出生的新生儿中也显示出良好的免疫原性(95-99%的有效性)。
HPV疫苗也是基于VLP平台的疫苗。目前的九价HPV疫苗可预防九种不同的病毒基因型,这九种病毒基因型可导致90%的宫颈癌和80-95%的肛门生殖器癌。九价HPV疫苗含有九种不同基因型HPV(6、11、16、18、31、45、53、58)的L1蛋白,形成VLP,并通过重组DNA技术合成。
病毒体
病毒体是一种与天然病毒结构非常相似的疫苗平台。从结构上讲,它们是由缺乏病毒遗传物质的血凝素(HA)、神经氨酸酶(NA)和磷脂(磷脂酰乙醇胺和磷脂酰胆碱)组成的重组流感病毒包膜形成的VLP。病毒体首次用于制造流感疫苗是在1975年,流感病毒是一种适用于所有年龄组的佐剂流感疫苗,对健康和免疫功能低下的儿童、成人和老年人都有良好的疗效。它能够诱导B细胞反应并产生特异性抗体。病毒体保留了病毒HA的受体结合能力和膜融合活性,但由于缺乏病毒RNA,它们在结合后无法在细胞中诱导感染。
病毒体是一个完美的递送系统,能够将抗原转移到抗原呈递细胞的胞质中,并诱导细胞毒性T淋巴细胞(CTL)反应。然而,由于其弱佐剂特性,病毒体在激活APC和促进交叉呈递方面不是很有效。这种内在的限制可以通过添加更强的佐剂来消除。如最近开发了一种基于病毒体的新型流感疫苗,该病毒体补充有Toll样受体4(TLR4)配体单磷酰脂质a(MPLA)和吸附到膜中的金属离子螯合脂质DOGS NTA-Ni。用了这些MPLA佐剂的病毒体对小鼠进行体内免疫可以诱导特异性CTL。
病毒体递送系统佐剂的显著优点是它们能够通过疏水性脂质相互作用将抗原吸附到其表面和管腔上。将抗原吸附到病毒体的流体磷脂双层表面会刺激与宿主细胞受体的相互作用。FDA已批准病毒体作为人类使用的纳米载体,它们具有非常高的耐受性和安全性。与亚单位疫苗对病毒入侵反应不佳相反,病毒体能够以与自然感染和其他强效佐剂非常相似的方式诱导强大的体液和细胞免疫。
迄今为止,除了上述两种针对流感和甲型肝炎的基于病毒体的疫苗外,还有几种基于病毒体疫苗正在研究中,包括针对艾滋病病毒、人乳头瘤病毒、呼吸道合胞病毒和疟疾的疫苗。
TLR1/2激动剂
在TLR1/2激动剂中,L-pampo是一种强效佐剂系统,由Pam3Csk4(Pam3)和聚肌苷酸:聚胞苷酸(polyI:C)组成。在一项研究中,L-pampo诱导了比铝佐剂更强的抗HBV抗体的产生,还涉及细胞介导的免疫反应,如增加的多功能CD4+T细胞。
此外,细菌脂蛋白是TLR2识别的最有效的配体。研究表明,源自细菌脂蛋白的合成脂肽是B细胞和巨噬细胞的强激活剂,可用作疫苗佐剂。来自发酵支原体的巨噬细胞活化脂蛋白-2(MALP-2)显示通过TLR2-和MyD88依赖性信号通路激活免疫细胞。除了MALP-2外,Pam2CSK4和Pam3CSK4也是公认的TLR2激动剂,它们已被评估为对抗传染性疾病如利什曼原虫、疟疾和流感的治疗药物。
TLR3激动剂
TLR3是一种检测病毒dsRNA的内涵体受体,它识别poly(I:C),因为它在结构上模拟病毒RNA,从而诱导I型IFN和III型IFN的产生,并引发Th1细胞因子反应。TLR3-poly(I:C)相互作用后产生的I型IFN对于传统树突状细胞(cDC)有效激活CD8+T细胞反应特别重要。此外,poly(I:C)产生的I型IFN刺激T细胞的克隆扩增,增加效应T细胞比率和抗原特异性B细胞的数量。
poly(I:C)作为一种潜在的佐剂已被广泛研究。然而,poly(I:C)对人体有毒性作用。因此,科学家的注意力集中在poly(I:C)的衍生物上,如poly(ICLC)和poly(IC12U),以及其他合成的TLR3激动剂,如ARNAX、IPH3102和RGC100。
迄今为止,一些研究已经使用poly(ICLC)作为传染病的候选疫苗,如恶性疟原虫和HIV,以及癌症。研究表明,与LPS和CpG等其他TLR激动剂相比,poly(ICLC)能够引发更强的Th1免疫反应。一种新的具有佐剂潜力的TLR3激动剂是ARNAX,这是一种TLR3特异性配体,其毒性比poly(I:C)低。ARNAX研究的最重要的两个领域是癌症免疫疗法和流感疫苗。
TLR4激动剂
作为疫苗佐剂研究的TLR4激动剂包括AS01、AS02和AS04,它们都含有内体TLR4的配体MPLA。AS01已被用于开发针对疟疾、艾滋病毒和结核病的疫苗。AS01是一种联合佐剂系统,由两种不同的免疫刺激分子MPLA和QS-21组成,包裹在脂质体结构中。这两种化合物使用脂质体作为载体,通过胆固醇依赖性内吞作用到达细胞内。在细胞内,QS-21引起溶酶体不稳定,并促进蛋白激酶SYK的激活。MPLA作用于内涵体TLR4,诱导TRIF依赖性信号通路。AS01激活胱天蛋白酶-1,从而促进NLRP3炎症小体的激活以及IL-1β和IL-18从APC的释放。IL-18的释放导致IFN-γ的快速产生,尤其是淋巴结中的自然杀伤细胞,从而促进DC的成熟和Th1型免疫反应的诱导。
TLR5激动剂
TLR5是一种识别细菌鞭毛蛋白的受体,由几种免疫细胞表达。与配体的连接导致炎症途径的激活和许多炎症介质的释放,如TNF-α、IL-1β、IL-6和一氧化氮。此外,鞭毛蛋白能够引起Th1和Th2反应,而不像其他TLR配体,它们只能诱导Th1反应。鞭毛蛋白通过激活NLRC4炎症小体诱导IL-1β的产生和释放。迄今为止,至少有三种使用鞭毛蛋白作为佐剂的疫苗处于临床试验阶段:两种针对流感病毒,一种针对鼠疫耶尔森菌。
TLR7/8激动剂
一些研究表明,TLR7/8的激动剂能够强烈诱导Th1免疫反应。配体与TLR7/8结合能够产生高水平的I型IFN、IL-12、TNF-α和IL-1β。此外,TLR7/8和TLR9激动剂是唯一能够激活和促进cDC和浆细胞样树突状细胞(pDC)克隆扩增的激动剂分子,还能够动员CD14+CD16+炎性单核细胞和CD14dimCD16+巡逻单核细胞。
最具代表性的TLR7/8激动剂是一些合成的小分子,如咪喹莫特(R837)和雷基莫特(R848),属于咪唑喹啉类。咪喹莫特目前已被批准用于治疗生殖器疣、浅表基底细胞癌和光化性角化病,而雷喹莫特已被研究用于抗病毒和抗癌治疗。
然而,这些小分子具有一些内在的局限性。特别是,它们可以远离给药部位扩散,从而远离抗原,导致疗效降低并诱导全身副作用。已经表明,这些分子与铝佐剂的直接结合能够提高疫苗的效力。此外,与合成聚合物支架、脂质聚合物两亲物、聚乙二醇(PEG)、纳米凝胶、明矾和各种其他合成聚合物的结合显著增加了咪唑喹啉的递送,并改善了DC和抗原特异性T细胞的成熟。此外,先前使用咪唑喹啉与一种或多种其他TLR激动剂(如MPLA和MPLA+CpG ODN)的研究表明,这种组合增加了先天免疫反应,显著产生了抗原特异性中和抗体,并改善了Th1反应。所有这些创新都突出了TLR7/8激动剂作为候选佐剂的卓越潜力。
TLR9激动剂
TLR9自然识别由非甲基化胞嘧啶磷酸鸟嘌呤(CpG)二核苷酸代表的细菌DNA基序,通过MyD88依赖性途径驱动先天免疫系统的激活。CpG-ODNs在NK细胞、B细胞和pDC中引起强大的趋化因子、细胞因子和抗体产生,从而驱动强烈的Th1型免疫反应。到目前为止,已经开发出三类(A-C)不同类别的CpG-ODN,但只有B类的分子在临床试验中用作佐剂。B型CpG-ODN可以诱导pDCs的成熟,并直接与B细胞相互作用,以增强抗体的产生。
最近获得许可的CpG 1018是一种具有高化学稳定性,并能够引发Th1型免疫反应佐剂能力的寡核苷酸,被用作乙型肝炎疫苗Heplisav-B的佐剂。Heplisav-B中的CpG 1018提高了疫苗的效力,与需要三剂才能获得最佳保护的传统乙型肝炎疫苗相比,只需要两剂疫苗。另一种CpG-ODN,CpG 7909,也在临床评估中,并在HBV和疟疾疫苗接种中显示出令人鼓舞的结果。
此外,其他下一代TLR9激动剂也在开发中。MGN1703,是一种小的DNA分子,包括CG基序,但在结构上与CPG-ODN不同。MGN1703由一段反向互补DNA组成,该DNA在中间是双链的,两头的单链环包括三个非甲基化CG基序,形成哑铃形结构。MGN1703已被测试用作癌症疫苗的佐剂,发现它能够激活先天和适应性免疫反应,仅产生轻微或暂时的副作用。
疫苗接种一直是且将继续是人类抗击传染病的最有力武器之一。由于这些有效和安全的预防工具,人类得以从世界许多地区铲除人类历史上最可怕的敌人。最近的新冠肺炎大流行充分强调了疫苗接种的重要性,疫苗研究必须取得进一步进展,为未来可能得传染病大流行做好准备。疫苗的效力取决于佐剂的基本特性和作用。关于疫苗接种的未来,必须更多地关注这些分子,以生产出越来越安全有效的疫苗,造福人类。
参考文献:
1. An Overview of Vaccine Adjuvants: Current Evidence and Future Perspectives. Vaccines (Basel).2022 May 22;10(5):819
撰稿人 | 小药说药
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多