GMP中间体生产厂房验证URS的编写要点
Part
1
概述
在原料药的生产过程中,GMP 的要求随着工艺的进行,从原料药生产的早期步骤到最后的步骤、精制和包装,愈发严格[1]。对于化学合成的原料药,国际上一般把起始物料首次进入反应过程的时刻作为实施GMP 的起点[2],随后的步骤包括中间体的生产、分离和纯化、物理过程和包装,GMP 的要求不断增加。根据ICH Q7 的定义,中间体是原料药(Active pharmaceutical ingredients,API)生产阶段中获得的产品,在成为API 前,需经进一步的分子改变或纯化。在实践中,医药中间体根据对最终原料药质量的影响程度,可分为非GMP中间体和GMP 中间体。ICH Q7 中提及的“中间体”是指企业确定的原料药生产开始以后所生产的中间体,即GMP 中间体。GMP 中间体应在GMP 条件下生产,当中间体和原料药由不同的企业进行生产时,应由原料药企业对GMP 中间体生产企业进行质量审计,以确保最终原料药的质量。
GMP 中间体需在GMP 的条件下生产。GMP 实施的四个要素包括硬件、软件、人员和工作现场。硬件设施是药品生产的基本条件,用于药品生产的厂房设施能否被合理设计,与药品质量息息相关。硬件设施的“质量”应通过确认与验证活动进行控制。我国2010版《药品生产质量管理规范》(简称《规范》,下同)第一百三十九条规定,“企业的厂房、设施、设备和检验仪器应当经过确认”。“确认”是指“证明厂房、设施、设备能正确运行并可达到预期结果的一系列活动”。在实施过程中,验证V- 模型中的用户需求说明(User Requirement Specification,URS)是验证生命周期的起点。2010版《规范》附录11“确认与验证”要求企业“对新的或改造的厂房、设施、设备按照预定用途和本规范及相关法律法规要求制定用户需求”。制定URS的目的是达到符合GMP 规范、安全及环保等要求,符合国际通用标准及国家相关标准要求,符合生产工艺或产品要求等。
GMP 中间体的质量关系到最终API 的质量。GMP 中间体通常在一般生产区即非洁净厂房内进行生产,鉴于中间体生产工艺复杂、易燃易爆、有毒有害等的特点[3],对中间体生产厂房设计的探讨大多关注于EHS 方面,但GMP 要求同样重要。本文基于GMP 中间体生产的特殊性,对GMP 中间体生产厂房URS 的编写进行探讨,以指导GMP 中间体生产企业开展工作,保障最终原料药的质量。
Part
2
厂房验证的URS 是从用户角度对厂房所提出的要求或期望。厂房验证URS 的编写需结合GMP 要求、EHS 要求、项目功能定位、工艺、产能等因素综合考虑,要点如下:①项目背景(项目的功能定位、设计依据标准等);②产品和工艺要求;③厂址选择;④总平面布置;⑤车间布置(包括各工序洁净等级;火灾危险性类别;耐火等级;生产、辅助生产、生活和行政部分布局;工艺设备的平、立面布置;人流物流规划等);⑥管道布置;⑦建筑结构;⑧室内装修;⑨电气设计;⑩给水排水;11 暖通系统;12 气动工程;13 消防;14 仓储区设计;15质控区设计;16辅助区设计;17系统施工要求;18系统验证要求;19文件要求。
下文针对GMP 中间体生产的特点,对厂址选择要求、厂区总体布局要求、车间布置要求进行讨论。
Part
3
3.1
厂址选择要求
厂区位置的选择是企业实施GMP 的基础,它是一项较为复杂的、需要考虑多种因素的工作,需对技术经济方案进行比较后才能确定。厂房所处的环境应当能够最大限度地降低物料或产品遭受污染的风险,符合区域总体规划和环境影响评价的要求,符合国家现行土地管理、环境保护、水土保持等法规有关规定,满足安全生产与卫生需求。
对于厂区自然环境条件的选择,可以从空气环境、水质、气候、虫害等角度提出要求。环境空气功能应达到《环境空气质量标准》(GB 3095)二类区标准。由于制药用水的品质要求是根据药品质量的工艺要求确定的,因此,厂区位置的水质条件要求与产品工艺和制水系统的处理能力有关。一般应要求具备自来水管网系统,其水质应符合国家“生活饮用水卫生标准(GB 5749)”。在气候方面,厂址尽量选在气候适宜,温湿度不会过高或过低的地方。如在湿度比较大的地方建厂可能会给厂房设施的防霉工作带来挑战。另外,选址应能尽量避免鼠害和虫害。
对于厂区社会环境条件的选择,首先根据医药工业总图运输设计规范(GB 51047)的要求,厂址应位于城镇或居住区的全年最小频率风向的上风侧。通过评估生产过程中是否可能散发有害气体,以及事故状态下是否会泄漏或散发有毒、有害、易燃、易爆气体或液体,进一步缩小厂址的选择范围。
在振动和噪声控制方面,由于厂区周围环境产生的振动和噪声可能影响拟采购的仪器或设备的使用,或影响产品的生产过程,因此应给出相关仪器或设备的振动和噪声控制要求,并要求对拟定厂址周围振源和噪声源的影响作出评价,以确定该场地用于建设的适宜性。
在交通道路方面,选址宜使物料供应和产品运输交通便利、通讯方便,具备人流、物流分开的道路,尽量靠近原料来源和用户。在动力供给方面,选址应确保水、电、气和其他动力的供给(两路进电确保电源)。在安全生产方面,厂区应保持和相邻企业及其他设施的安全距离(包括卫生要求距离,防火、防爆要求距离等)。此外,应要求选址尽量保证消防通道顺畅便捷,便于消防车辆及时到达。洪水、潮水和内涝威胁以及企业长远发展的余地等也可纳入考量。
3.2
厂区总体布局要求
厂区的总体布局要求可以从总平面布置、竖向设计、厂区道路设计、管线综合设计以及绿化设计五个方面进行考虑。基于中间体及API 生产过程中的特点,厂房的总体布局、道路设置,包括建筑高度和建筑间距等,应首先考虑满足消防安全的要求。
厂区一般按照生产、仓储、质量控制、行政、生活和辅助功能进行划分和总体布局。运输量大的车间、仓库等布置在货运出入口及主干道附近。在满足生产、操作、安全和环保的基础上,工艺流程应集中布置和控制。经过评估,中间控制实验室可设在生产区内。接着可对生产设施、仓储设施、公用设施、生产管理及其他设施的布置提出要求。原料仓库应靠近生产车间,按物料流向布置,缩短原料及成品的运送距离,尽量避免原材料和产成品的二次倒运。化学危险品库应设于厂区安全位置,并有防冻、降温、消防措施;贮存化学危险品的建筑物不得有地下室或其他地下建筑。易制毒品应设专用仓库,并有防盗措施。公用设施的布置,宜接近负荷中心或靠近主要用户,也可布置在生产厂房内,包括变电站、循环水冷却设施、三废处理区、雨水收集池和消防水收集池、压缩空气站、冷冻站、氮氧气站等。注意三废处理等有较严重污染的区域应置于厂区全年最小频率风向的上风侧。生产管理、生活服务设施应位于厂区全年最小频率风向的下风侧。厂区出入口数量不宜少于2 个并应分开设置人流、货流出入口。总体布局还应考虑各类振源振动对仪器、设备等的影响。
竖向设计要求可以考虑建筑物室内外地坪高差。对于厂区道路设计的要求应注意人流物流分开,尽量避免折返迂回运输,并给出全厂年运输量需求。管线综合设计的需求应考虑有可燃性、爆炸危险性、毒性及腐蚀性介质的管道敷设问题,此类管道宜采用地上敷设,且不应穿越与其无关的建筑设施等。
厂区绿化对于净化空气、调节温湿度和日晒、防止水土流失等具有重要意义。根据《医药工业总图运输设计规范》(GB51047),厂内绿地率一般不应小于15%,且不应大于20%。不同建筑或设施周围的绿化要求有所不同,因此树种选择、种植方式、最小间距等方面应注意区分。
3.3
车间布置要求
车间布置首先需要根据实际生产的产品特性、工艺等因素,评估厂房设施设备能否多产品共用。综合考虑产品的爆炸性、光/ 紫外线敏感度、吸湿性、流动性、可清洁性、化学反应能力和EHS 高风险等提出细化的设计需求。生产区和贮存区都应留有足够的空间,以避免污染、交叉污染、混淆、差错等的发生。车间布置应满足《工业企业设计卫生标准》(GBZ1)、《工业企业噪声控制设计规范》(GB/T 50087)、《化工企业安全卫生设计规范》(HG 20571)、《建筑设计防火规范》(GB50016)等规范和标准要求。以下从人流物流规划、平面布局设计、设备布置三个方面进行探讨。
3.3.1 人流物流规划
车间布置首先应防止人流物流的混杂和交叉污染。在物料的流动性允许的情况下,物料的传输推荐利用重力作用在密闭的系统或管路中进行,以减少或避免生产工序间的操作。URS 中可给出车间客梯和货梯的设置需求,并说明其用途。
3.3.2 平面布局设计
在平面布局设计方面,工艺布局应按生产流程要求做到布置合理、紧凑、便于操作,操作单元的逻辑流安排合理,避免交叉往返。GMP 的核心在于防止污染和交叉污染,因此生产防护级别的确定是车间布置的一项重要工作。ICH Q7 5.15规定,“应尽量使用封闭或密闭的设备。当使用开放性设备或设备处于开放状态时,应当采取适当的预防措施将污染的危险性降至最低。”我国2010版《规范》附录1“原料药”第七条也有类似的规定。另外,“原料药”附录第三条要求,“非无菌原料药精制、干燥、粉碎、包装等生产操作的暴露环境应当按照D 级洁净区的要求设置”。GMP 中间体通常在一般生产区(非洁净区)进行生产,但其生产过程是可能存在暴露工序的,对于GMP 中间体生产过程的防护级别,各国法规未做出具体要求。建议可以参考ISPE指南Volume1-Active Pharmaceutical Ingredients(Second Edition/June 2007)[4] 结合具体的产品生产过程,对潜在污染进行风险评估,以判断防护级别并确定具体的防护措施。
ISPE 指南将原料药生产的防护级别分为三级,分别为一级—— 一般的(general)、二级—— 保护的(protected)和三级—— 受控的(controlled)。防护级别需要根据外部污染评估的结果确定。外部污染来自于原料药或中间体暴露时所处的外部环境。生产操作可能暴露的(exposed/open)、密闭的(not exposed/closed)或者短时暴露的(briefly exposed/briefly open)。如果在操作过程中工艺容器仅仅敞开了非常短的时间(几秒钟),比如取样或者投料等,可以认为这种操作属于短时暴露。外部污染评估流程见图1(针对非无菌原料药)。
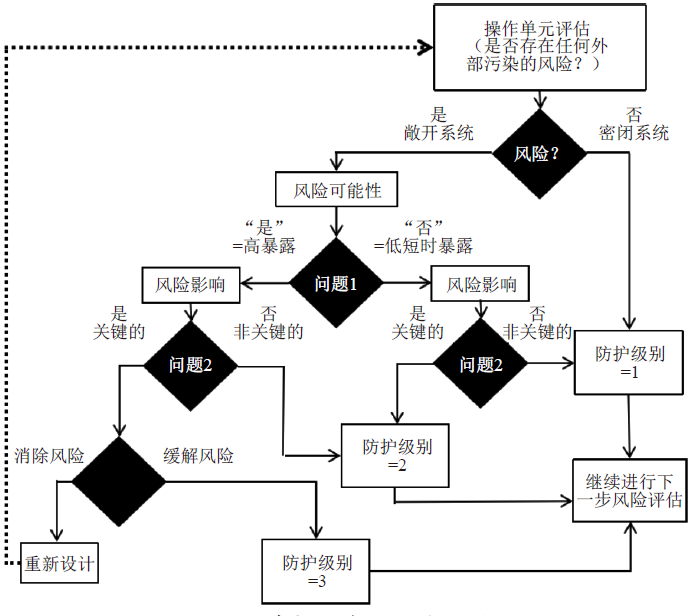
图1 外部污染评估流程图
污染评估问题1 用于判断风险发生的可能性(表1),在表1 中只要有一个问题回答为“是”意味着风险发生的可能性较高。投料、转移物料、取样、托盘干燥器出料等是比较常见的可能暴露的操作。
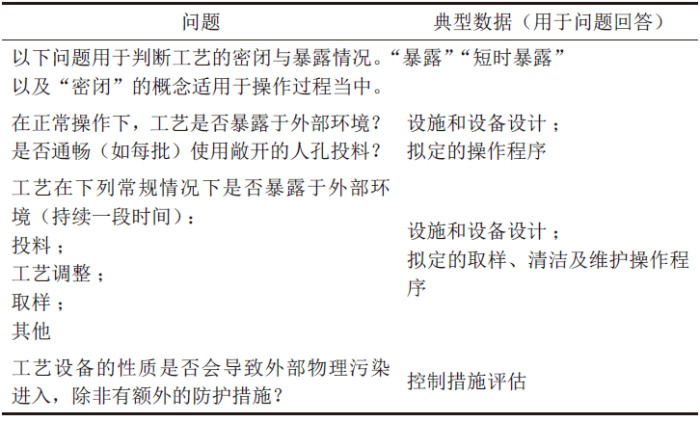
表1 污染评估问题1——判断风险发生的可能性
任何外部污染都可能对API 的质量造成影响,污染评估问题2 用于判断风险影响(关键的还是非关键的)(表2)。若表2 中的Q3 回答为“是”,意味着风险影响为“关键的”;若对Q1 或Q2 的回答为“是”,意味着风险影响为“关键的”的可能性较高。对于外部污染,关键性操作往往发生在或紧随着最终API 的分离过程。
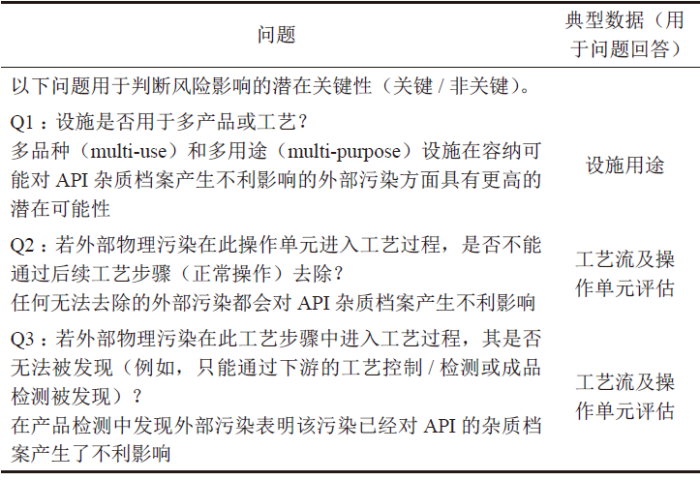
表2 污染评估问题2——判断风险影响
若风险影响为“关键的”的可能性较高,应考虑通过重新设计等方式消除风险(比如通过引入能够去除外部污染的工艺)。若风险无法消除,应通过使用恰当的防护级别(措施)等方式尽量减缓风险带来的影响。
判断出的保护级别将被用于确定采用何种保护措施(如车间布置考虑、建筑材料选择考虑等)对生产过程进行保护。下文仅讨论对车间布置的要求。暴露工序可以采取的保护措施包括:在产品暴露的同一区域内只进行同一产品的同一操作;空间隔离;在敞开系统中采用防护设施(遮盖物、隔离操作箱、隔离装置等);合理的管路设计(若无适当的保护措施,管道不直接位于敞开的人孔或出料口的上方);过滤工艺气体和工艺溶剂等。对于辅助区域的布置要求:①若在生产区内设置中间控制区域,应进行充分评估,确保生产操作不影响检验结果的准确性,检验操作对生产也不应有不利影响。应在中间控制区域与二级/ 三级防护区域之间设置中间区域。②物料分配间要求:若待分配物料将用于关键工艺步骤,且分配操作未在密闭系统中进行,则分配间应至少为二级防护。③取样间要求:若未使用封闭系统取样,则取样间的保护级别应等于或大于其生产阶段所需的保护级别。④盥洗室不得与生产区和仓储区直接相通,但应便于到达。⑤维修间应当尽可能远离生产区。⑥办公室、休息室与二级防护的工艺流程区域之间应至少分隔一个中间区域(房间、走廊等)(三级为两个,下同)。但需注意,办公室、休息室等不应设置在甲、乙类厂房内。⑦非洁净电梯与二级防护的工艺流程区域之间应至少分隔一个中间区域(房间、走廊等)。
需要说明的是,上述防护级别仅从GMP 的角度讨论问题,需要综合EHS 等需求最终确定防护措施。
平面布局设计还应根据各物料OEB 级别(职业暴露等级)等数据确定职业防护措施。对于有爆炸危险的甲、乙类生产部位,宜布置在单层厂房靠外墙的泄压设施或多层厂房顶层靠外墙的泄压设施附近。甲乙类生产厂房不应设置在地下或半地下,员工宿舍严禁设置在厂房内。URS 中还应给出车间定员表(行政管理、技术人员、车间分析人员、岗位操作工人、辅助工人;最大班人数;男女比例)、各功能间名称及数量需求等。
3.3.3 设备布置
设备布置应当满足设备的使用、清洁、消毒(如有)和维护等要求。若采用重力流设计,设备可采用三层式布置,比如将主要设备(如反应器)布置在上层,主要分离设备(如离心机)布置在中层,贮槽及干燥设备布置在下层,或其他类似设计[5]。设备布置应充分考虑工业卫生要求,应能创造良好的采光条件,尽可能做到使工人背光操作;高大设备尽量避免靠窗设置,以免影响采光;在满足工艺流程要求的前提下,高噪声设备宜相对集中布置等。另外,为满足虫害控制要求,设备布置应能尽量避免灰尘在设备下方和周围积累。
Part
4
质量源于设计。一个良好的URS 是进行后续验证工作的基础。GMP 中间体的质量与最终API 的质量密切相关,中间体生产厂房的验证工作是GMP 实施的重要一环。对于GMP中间体的生产,应尽可能采用密闭化设备及操作,减少敞口式或打开设备进行操作的方式,以有效避免人员操作及环境对产品造成的污染。厂房验证过程中应兼顾GMP 要求、EHS要求、项目功能定位、工艺、产能等要求,最大限度地保障产品质量。
参考文献
[1] ICH.Harmonized tripartite guideline Q7 :good manufacturing practice guide for active pharmaceutical ingredients[EB/OL].https://database.ich.org/sites/default/files/Q7%20Guideline.pdf.
[2] 王宏亮,陈震. 化学合成原料药起始物料国内外相关要求的比较[J].中国新药杂志,2014,23(9):998-1003.
[3] 蔡江,李一鑫. 医药中间体合成多功能车间设计探析[J]. 化工与医药工程,2020,41(1):42-46.
[4] ISPE.Volume1-Active Pharmaceutical Ingredients(Second Edition/June 2007)[EB/OL].https://ispe.org/publications/guidancedocuments/baseline-guide-volume-1-active-pharmaceutical-ingredients.
[5] 赵晓旭,秦朝燕. 典型原料药车间工艺布置与设计要点[J]. 化工管理,2019(25):190-191.
[6] 徐健. 原料药合成车间工艺设计讨论[J]. 医药工程设计,2012,33(2):8-11.
撰稿人 | 杨睿雅、梁毅
责任编辑 | 胡静
审核人 | 何发
热点文章
-
中国GMP|2025年新版无菌药品附录(征求意见稿)到底有哪些变化?
2025-04-10
-
案例研究:FD820C嵌入式微型差压变送器在制药洁净室中的卓越应用
2025-02-27
-
科普 | 一文读懂什么是合成生物学
2025-02-14
-
抗体偶联药物的偶联技术全面梳理
2025-03-04
-
一文读懂GMP文件管理全生命周期合规要求
2025-02-14
-
替尔泊肽制备工艺过程
2025-03-11
-
阿斯利康掏10亿美元腰包! EsoBiotec的体内CAR-T究竟是何方神圣?
2025-03-27
-
药品密封性检测 :用户需求与优化
本文从用户角度出发,全面而深入地剖析了无菌药品密封性检测技术。通过分析用户在实际应用过程中的需求、体验和遇到的问题,为制药企业选择合适的检测技术提供科学且实用的参考依据,同时为检测技术供应商改进和创新产品提供方向指引,促进无菌药品密封性检测技术的不断优化和发展,从而更好地保障无菌药品的质量安全。
作者:付沛林、王明建、王亮
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
-
洁净服 :材料、设计与行业应用解析














评论
加载更多