浅谈:创新药物IND申请之药学研究
美国FDA&创新药IND阶段-药学研究
1. FDA关于IND阶段药物的审评指南
早在1995年,美国食品药品监督管理局的CDER和CBER便发布了关于IND阶段的药物指南“Content and Format of Investigational New Drug Applications (INDs) for Phase 1 Studies of Drugs, Including Well-Characterized, Therapeutic, Biotechnology-derived Product”,该指南阐明了21 CFR中312.22和312.23关于最初进入美国临床研究试验药物的数据要求,允许IND阶段提交的各种研究的数据及深度,具有极大的灵活性。
2003年,FDA又发布了指南“INDs for Phase 2 and Phase 3 Studies”,该指南进一步提供申请人(IND阶段)关于II期/III期临床化学、生产、CMC信息等内容的相关建议和要求。
2008年,FDA发布指南“CGMP for Phase 1 Investigational Drugs”,该指南详细阐述了Ⅰ期临床试验样品生产落实cGMP的问题,建议采用药物质量控制(QC)原则作为cGMP的一部分,从而保证Ⅰ期临床试验样品的质量和安全性。
2013年,FDA再次发布指南“Investigational New Drug Applications (INDs) - Determining Whether Human Research Studies Can Be Conducted Without an IND”,该指南旨在帮助临床申请人确定新药IND申请下,涉及相关的研究是否必须被研究,如21 CFR 312部分;并详细说明了何时需要IND申请,何种情况不需要IND申请,确定了一定的适用范围。
表1:FDA关于新药申请IND内容的相关指南
时间 |
指南内容 |
下载网址 |
1995 |
Content and Format of Investigational New Drug Applications (INDs) for Phase 1 Studies of Drugs, Including Well-Characterized, Therapeutic, Biotechnology-derived Products |
https://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm071597.pdf |
2003 |
INDs for Phase 2 and Phase 3 Studies |
https://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm070567.pdf |
2006 |
Investigators, and Reviewers Exploratory IND Studies |
https://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm078933.pdf |
2008 |
CGMP for Phase 1 Investigational Drugs |
https://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm070273.pdf |
2013 |
Investigational New Drug Applications (INDs)-Determining Whether Human Research Studies Can Be Conducted Without an IND |
https://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm229175.pdf |
2. IND药学部分-分块细述
根据美国FDA发布的相关指南的详细内容,在不同临床申报阶段,其对创新药物-药学部分的原料药、稳定性、质量、制剂等内容,具有详细的分段研究要求,详情如下:
☆原料药部分
☆☆I期临床
制备工艺~提供合成工艺研究的简要总结,说明现有试制规模,合成路线图中建议明确各步骤的反应条件、所用试剂、溶剂、催化剂等,建议开始关注对关键起始原料的质量数据积累;因精制工艺的不同可能影响产品的杂质谱、晶型、粒度等,需注意说明粗品的纯化/精制方法。
特性鉴定~此阶段提供支持化学结构的初步研究数据即可;说明可能影响安全性的理化性质,如溶解性(不同pH溶液中)、粒度、晶型等。建议在早期临床阶段即确定药用晶型,但粒度还需要结合临床研究的推进不断积累数据。
☆☆II/III期临床
制备工艺~提交制备工艺的变化及相关研究资料,评估变更对产品的质量和安全性的影响;对于保证产品安全性的生产步骤(如发酵产物的纯化步骤)的过程控制应有清晰描述;提供起始原料的质量控制信息(来源、分析方法、检测结果),对于结构复杂的关键起始原料应提供详细生产工艺信息;提供关键步骤、中间体的控制信息。
特性鉴定~提供合理支持药物化学结构的证明,单晶X衍射、构象分析等可在III期提供;结合临床试验制剂的剂型特点和药物特性,提供进一步完善的原料药理化性质信息,包括溶解性、晶型、粒度、渗透性、旋光性、引湿性、分配系数、电离常数等,对于口服固体制剂,建议尽早研究其原料药的渗透性,了解其BCS分类,对制剂处方工艺开发以及体外释放方法的建立很有帮助。
☆稳定性研究
☆☆I期临床
提供已有的稳定性试验结果、后续的稳定性研究计划;对于复溶、稀释或混合后多次应用的制剂,应开展使用中的稳定性研究;建议开展影响因素等试验,以了解药物的内在稳定性情况、潜在的降解途径,帮助稳定性试验条件的选择、分析方法的考察。已有的稳定性研究结果应支持拟进行的临床研究,保证拟定临床试验期间药品质量的稳定。
☆☆II/III期临床
总结已获得代表性批次的稳定性试验数据;描述原料药化学和物理敏感性,如光敏感性、吸湿性等,潜在的降解途径。I、II期临床试验通常周期较长,而拟用于临床试验样品的稳定性考察时间很有限,建议可提交相关的支持性研究数据,例如临床前或早期临床试验的处方、工艺相似批次以及批量较小批次等的稳定性研究结果。进入III期临床后通常应按照指导原则要求开展稳定性试验,以方便NDA的申报。
☆质量部分
☆☆I期临床
列出质量标准的项目、方法和可接受限度。建议对涉及安全性的有关物质、遗传毒性杂质等检测方法的适用性进行初步验证,初步界定杂质谱;拟定限度应基于已有批分析数据的积累,临床样品的杂质水平不得超出动物安全性试验数据所支持的相应杂质的水平;提供已有批次(如安全性评价、稳定性试验等)和拟进行临床试验批次(如有)的批分析数据。
☆☆II/III期临床
提供分析方法部分验证结果摘要(可列表,如专属性、精密度、准确度、线性、定量限/检测限等);继续进行杂质谱的鉴定;对原料药合成工艺变更产生的新杂质和制剂中新发现的降解产物进行定性和定量研究,建议申报I、II期临床时确定原料药主要杂质以及制剂的主要降解产物;重新评估先前I期或II期的质量标准和可接受限度,根据当前的研究阶段进一步评估和调整。对于难溶性口服固体制剂,建议积累制剂所用原料药的粒度分布数据,建立药物开发早期、后期获得数据与体内疗效的相关性;建立溶出度/释放度方法,结合药物特性选择介质和试验方法,建议对临床前试验样品、各期临床试验样品、稳定性试验样品的溶出/释放行为进行考察,建立药物开发早期、后期获得数据与体内疗效的相关性。提交各项临床试验样品的批分析数据。
☆制剂部分
☆☆I期临床
通常采用的剂型比较简单,例如口服制剂采用粉末装胶囊,或者制备成混悬液、溶液等,以方便剂量探索,此阶段的剂型和处方工艺还存在很大的不确定性,不是药学评价的重点,重点是保证临床试验样品的稳定、安全。但对于无菌制剂,出于安全性的考虑,应提供详细的灭菌/除菌工艺条件,制备工艺应能保证产品的无菌。应注意说明临床试验拟用制剂和毒理学试验所用制剂在生产、特性方面的差异,讨论这些差异对安全性可能的影响程度,总之,要保证用于临床前动物试验、临床试验等所用药物的质量具有可比性。此外要说明原料和制剂的制备过程是否显示出任何潜在的人体风险信号,如有,应对这些潜在的危险信号进行分析,阐述监测计划。
☆☆II/III期临床
提交I期或II期临床期间剂型、处方、工艺的变化及相关研究资料,溶出行为等质量特性可能具有潜在临床相关性,请关注变更对这些质量特性的影响,评价早期临床试验制剂与后续拟使用制剂的相关性。对于I、II期申报,如已明确关键生产步骤,应记录关键步骤的控制和中间体的控制信息。III期临床试验是确认药品安全性有效性最重要的试验部分,I、II期临床试验所用的样品是关联药品的安全有效性与产品质量属性的关键批次,对于将来新药上市申请(NDA)申报时制定全面的质量控制体系非常重要,建议高度关注I、II期临床试验样品的CMC相关信息。通常是根据拟定商业化生产来对 I、II期临床样品的生产和其他药学研究工作进行合理安排,尽量避免NDA之前再发生影响产品质量的重大变更,加强对工艺控制信息、关键质量信息的收集。
中国CFDA&创新药IND阶段-药学研究
1. CFDA对于创新药IND阶段审评的相关政策
2012年5月,制定《化学药IND申请(I、II期临床)药学研究信息汇总表》、《化学药IND申请药学研究年度报告》,目的为方便创新药的药学审评以及临床试验期间后续药学研究信息的滚动提交。
2013年2月,发布《关于深化药品审评审批改革,进一步鼓励药物创新的意见》(国食药监注[2013]37号),明确了鼓励以临床价值为导向的药物创新、调整创新药物临床试验申请的审评策略、优化创新药物审评流程。
2015年11月,发布《国家食品药品监督管理总局关于药品注册审评审批若干政策的公告》(2015年第230号),强调在I期、II期临床试验完成后,申请人应及时提交试验结果及下一期临床试验方案。未发现安全性问题的,可在与药审中心沟通后转入下一期临床试验。II/III期临床试验虽不再需要审批,但仍需申请人按照创新药的研发规律合理制定药学研发策略。
2016年6月,总局发布《药物研发与技术审评沟通交流管理办法(试行)》,其目的是建议申请人重视III临床前的药学沟通交流会,并充分讨论III期临床样品的生产要求及后续的药学研发计划,如此将有助于申请人在关键的III临床试验中获取充分的支持NDA的CMC数据。
2018年1月,发布《新药I期临床试验申请技术指南》,目的是明确新药I期临床试验的技术要求,提高I期临床试验申报资料的质量;通过规范I期临床试验资料的数据要求,缩短新药研发周期,加快新药上市进程;帮助新药注册申请人申请I期临床试验,提高新药研发与审评效率,保护受试者安全与权益,保证临床试验质量。
表2:近些年,我国CFDA对于创新药审评的相关政策
时间 |
内容 |
网址 |
2012年5月 |
《化学药IND申请(I、II期临床)药学研究信息汇总表》 《化学药IND申请药学研究年度报告》 |
http://www.cde.org.cn/news.do?method=largeInfo&id=312668 |
2013年2月 |
《关于深化药品审评审批改革,进一步鼓励药物创新的意见》 |
http://www.sda.gov.cn/WS01/CL0844/78576.html |
2015年11月 |
《国家食品药品监督管理总局关于药品注册审评审批若干政策的公告》 |
http://www.sda.gov.cn/WS01/CL0050/134665.html |
2016年2月 |
《总局关于解决药品注册申请积压实行优先审评审批的意见》 |
http://www.sda.gov.cn/WS01/CL0844/145260.html |
2016年6月 |
《药物研发与技术审评沟通交流管理办法(试行)》 |
http://www.sda.gov.cn/WS01/CL0087/155022.html |
2018年1月 |
《新药Ⅰ期临床试验申请技术指南》 |
http://www.sda.gov.cn/WS01/CL0050/223338.html |
2. 最新版《新药I期临床试验申请技术指南》~药学研究相关内容
2018年1月,总局发布了《新药Ⅰ期临床试验申请技术指南》,对申请Ⅰ期临床研究的化学药品,需要提供下列药学研究资料,同时,按照附件表格总结整理和提供化学药品Ⅰ期临床试验申请药学研究信息汇总表并电子提交。
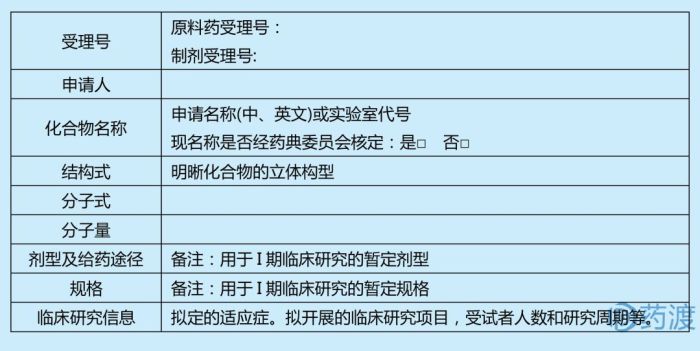
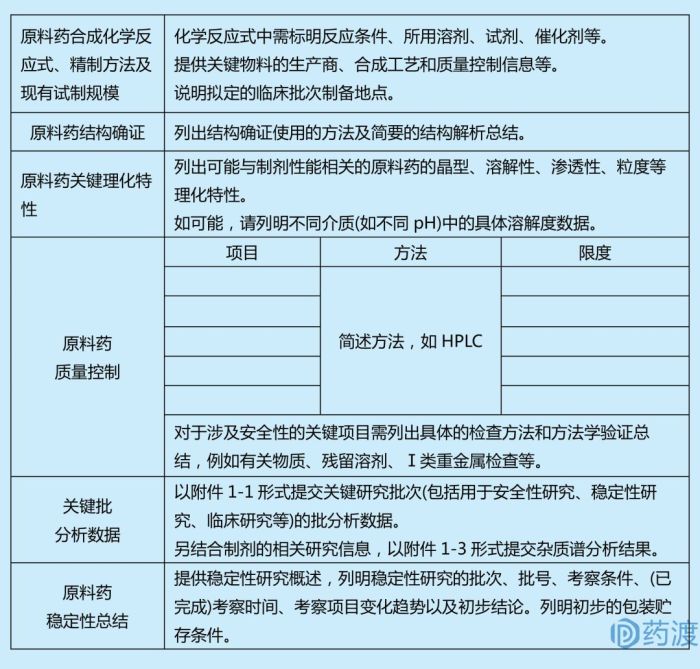
☆原料药信息
☆☆生产厂商
应递交原料药生产厂商(包括生产、检验)的完整地址。
☆☆制备工艺
应提供原料药制备工艺资料,包括反应流程图,注明工艺中使用的试剂、溶剂和催化剂等。对于采用发酵工艺、提取工艺制备以及多肽、小分子核酸药物等,需要提供更多的制备工艺信息。对于无菌原料药需提供灭菌/除菌工艺和无菌保证措施。
☆☆结构确证
应提供结构确证使用的方法、图谱及简要的结构解析总结。
☆☆理化性质
应列出已研究的可能与制剂性能相关的原料药的晶型、溶解度、渗透性、粒度等关键理化特性。如可能,列明不同介质(如不同pH)中的具体溶解度数据。
☆☆质量控制
应提供初步的质量标准,说明检查项目、可接受的限度、分析方法,提供代表性图谱。在药品开发初期,不需要提交全面完整的分析方法验证资料,但至少应提供方法的专属性、灵敏度等关键验证信息。应提供样品检验报告书。提供关键研究批次(如用于安全性研究、稳定性研究、临床研究等)的批分析数据。应提供初步的杂质谱分析结果、潜在遗传毒性杂质控制策略和分析信息。可参照ICH M7指南研究并提交报告。
☆☆稳定性
应提供原料药稳定性研究资料,列明采用的分析方法,可用列表形式递交代表性样品的初步数据及其他支持性稳定性研究数据,应提供关键项目的代表性图谱。稳定性数据应能支持新药的理化参数在计划的临床研究期间符合要求,如果计划的试验周期极短,可提供有限的支持性稳定性数据。在确保临床试验期间药物的稳定性的基础上,逐步积累稳定性数据,支持进一步的临床开发。
☆☆包装及贮存
应列明的直接接触包装材料及贮存条件。
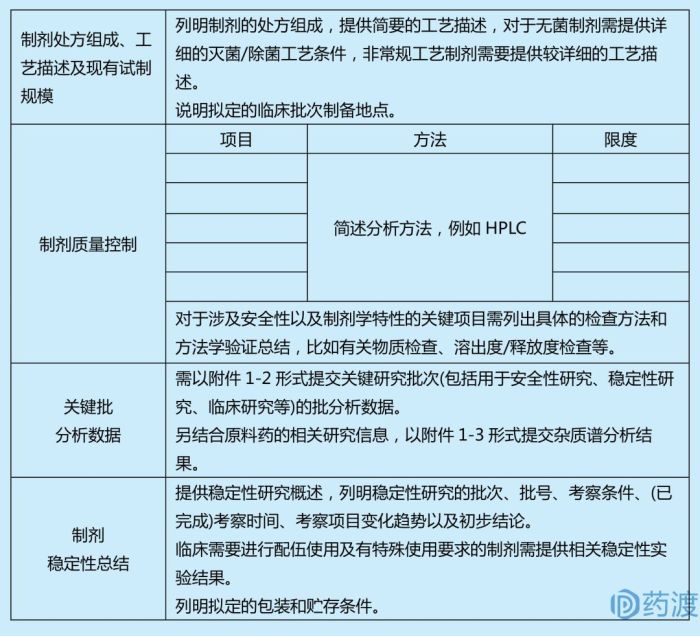
☆制剂信息
☆☆剂型及产品组成
应列表说明制剂的处方组成及用量,对于制剂工艺中使用但最终去除的组分也应列出。制剂中的辅料应符合药用要求;对于国内外制剂中尚未使用过的全新辅料,应进行关联申报。
☆☆生产厂商名称与地址
应递交临床试验用制剂生产厂商(包括生产、包装、检验)的完整地址。
☆☆生产工艺和工艺控制
应提供生产工艺信息,包括工艺流程图。对于无菌制剂应提供灭菌工艺和无菌保证措施;非常规工艺制剂应提供较详细的工艺描述。
☆☆质量控制
应提供初步的质量标准。说明检查项目可接受的限度、分析方法、代表性图谱。杂质报告方式可参照ICH Q3A和Q3B。应根据剂型、产品特点等设置适宜的质控项目和分析方法。对于以积累数据为目的,但不作为制剂放行条件的检测项目,应予以注明。在药品开发初期,不需要提交全面完整的分析方法验证资料,但至少应提供方法的专属性、灵敏度等关键项目的验证信息。提供关键研究批次(如用于安全性研究、稳定性研究、临床研究等)的检验报告书。应提供制剂降解途径、降解产物的初步研究结果。可参照ICH Q3B。
☆☆稳定性
应提供制剂稳定性研究资料,列明采用的分析方法,可用列表形式提交代表性样品(如动物药理毒理学研究样品、拟用于临床试验的样品)的初步数据及其他支持性稳定性研究资料,应提供关键项目的代表性图谱。稳定性数据应能支持制剂的理化参数在计划的临床研究期间符合要求,如果计划的试验周期极短,可提供有限的支持性稳定性数据。
☆☆包装和贮存条件
应列明直接接触包装材料的信息和贮存条件。对于新材料、新结构、新用途的药包材,需提供信息并按照要求进行关联申报。
☆☆其他
对于临床需要进行配伍使用及有特殊使用要求的制剂应提供相关稳定性实验结果。
☆安慰剂信息
如临床试验方案中需使用安慰剂,应提供安慰剂的处方、生产工艺及生产厂的相关信息、质量控制和检验结果等研究资料。
附:
化学药品Ⅰ期临床试验申请药学研究信息汇总表
1.基本信息
2.原料药信息
3.制剂信息
笔者感触:
在做科研的过程中,有时我们会不清楚一件事情到底做到什么程度,才是真正的适度...面对今天的审评态势,为了尽可能的满足审评中心的要求,我们往往会对某一阶段的药学研究,做出过度的投入。对此,无可厚非,毕竟面对前期巨额的投入,不能因为这“一点点”的药学研究数据,而耽误整个项目系统的进程...但笔者认为,过度的研发投入不仅是对人力、物力等资源的浪费,背后透露的更是对项目、对科研、对药物研发的理解不够。针对某一研发阶段,我需要得到怎样的数据支持,我又要投入多大量的试验数量,诸如此类的问题,真心需要多多对自己提问,然后去解决它,当疑问越来越少之时,相信才会对项目的理解更为透彻,也许那时,才能真正离科学更进一步吧!拙见~
内容来源:GMP行业药文
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多