化学原料药研发之流程介绍
质量源于设计,不同的工艺路线导致API的杂质谱会有较大的区别。故在工艺路线开发阶段,需要对路线全面的工艺分析(反应条件是否苛刻,是否用到有毒物料)。
工欲善其事,必先利其器。在开始工艺摸索之前,我们要比较全面的了解原料,试剂,溶剂,催化剂及各中间体的物理化学性质。例如化合物的溶解度,为选择适宜的反应介提供了参考。
后处理的目的, 一般原则就是尽可能的得到纯度较高的主产物。一个好的后处理方法,能使主产物和副产物、杂质有效的分离。
-
分析部门开发初步的分析方法
工艺杂质研究
工艺杂质的来源及API质量风险评价
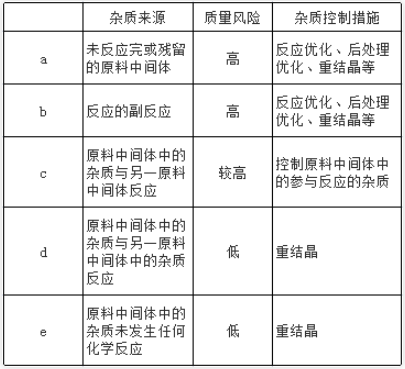
由于工艺路线一般不存在重大的改变,因此样品的杂质谱应该基本一致,唯一的差别在于杂质水平的高低。故个人认为,打通工艺的样品还可用于以下的研究。
盐型的研究
晶型的研究
对于me-too创新药来说,可根据阳性药的药理毒理文献资料,判断IND吸收过程的限速步骤。难溶性药物的溶出是吸收过程中的决速步骤,因此API的晶型直接影响着药物的溶出和在生物体体内的吸收。
一般来说,API晶型的溶解度顺序是:无定型>亚稳晶型>稳定晶型。
晶型研究的一般内容:晶型的摸索→→①晶体的熔点、溶解度、粒度等;②晶型的稳定性研究,影响因素条件下,考察晶型的稳定性;③拟定晶型的转晶研究→→拟定动物试验、临床试验用或拟上市API晶型→→拟定晶型的工艺研究:①搅拌方法,静置、搅拌 ②结晶方式(自然、冷却、晶种) ③干燥工艺(水份标准,结晶水的判断—TG、DSC、单晶培养,干燥方式,干燥温度) ④制剂工艺模拟(研磨、湿法制粒、压片等)→→建立拟定晶型的质量标准(熔点、溶解性、粒度;IR、x-ray、DSC、TG)。 (对于仿制药而言,不需要进行盐型的研究,但是晶型的研究还是必需的。如果是拟选用原研上市晶型,研究的工作重点应放在晶型工艺的考察上,确保自制晶型与原研晶型的一致性,以及批间的稳定性。如果开发新晶型,则需要进行更全面的考察) 影响因素预试验---降解杂质的研究 分析部门可用打通工艺的样品进行影响因素预试验。在预试验的基础上,进一步完善分析方法,合成部开始降解杂质研究(降解杂质的结构确证、杂质标准品的制备)。
工艺路线优化主要内容:摸索路线的最佳工艺条件,关键工艺参数,关键工艺步骤以及关键工艺参数和关键工艺步骤对API的质量风险评估。这部分研究包括:
-
在不产生杂质的条件下尽量合并反应步骤。 在不影响收率和质量的条件下尽量减少溶媒和其他辅助原料。
尽量避免采用无水、无氧、易爆炸、易中毒工艺。
尽量避免采用价格昂贵的原辅料,避免高污染的工艺。
尽量对原辅料回收套用。
对温度,压力,反应介质及其他参数挑战性试验。
结晶工艺的优化。
在工艺优化阶段后期,确定各步反应的工艺步骤和工艺条件,并在确定的工艺步骤和工艺参数下,小试生产一批。
起草,中试生产工艺规程 (试行)、岗位操作规程 (试行)、批生产记录 (试行) 和中试设备清洁方案 (试行)。
起草批检验记录 (试行)。
起草中试工艺验证方案,工艺规程,岗位操作SOP,岗位操作记录,批生产记录及批包装记录。
分析部实施生产设备清洁检测方法学验证,起草正式稳定性试验方案。
中试验证三批,分析部对成品全检,开始正式稳定性试验考察,制剂部门开始制剂中试研究工作。
原料药研发流程图
小 试 工 艺 研 究 阶 段 |
流程 |
研究工作 |
||
合成 |
分析 |
|||
工 艺 路 线 开 发 |
工艺路线选择 ↓ ↓ ↓ ↓ 工艺路线摸索 ↓ ↓ ↓ ↓ 样品 |
(1)工艺路线研究(包括工艺杂质的研究)
(2)盐型研究 (3)晶型研究 |
(1)起始原料的方法学研究
(2)分析方法的开发
(3)影响因素预试验---降解杂质的研究 |
|
小 试 工 艺 优 化 |
↓ ↓ ↓ ↓ 工艺优化 ↓ ↓ ↓ ↓ 样品 |
(4)工艺步骤,工艺参数优化,完成质量风险评估 (5)工艺杂质的分离制备(工艺杂质标准品) (6)降解杂质的分离制备(降解杂质标准品) (7)中间体对照品 ⑧API精制对照品 |
(4)准备开始质量研究 |
|
小 试 工 艺 验证
|
↓ ↓ ↓ ↓ 三批小试验证 ↓ ↓ ↓ ↓ 样品 |
(9)实施三批小试验证 |
(5)分析方法学验证 (6)原辅料,中间体,中间体控制,成品质量的初步验证 (7)起草质量标准(试行) (8)三批小试全检 |
|
中 试 工 艺 研 究 阶 段 |
流程 |
研究工作 |
||
合成 |
分析 |
|||
中试工艺研究
|
↓ ↓ ↓ ↓ 中试工艺研究准备 ↓ ↓ ↓ ↓ 中试研究实施 ↓ ↓ ↓ ↓ 样品 |
(10)起草工艺规程(试行),岗位操作规程(试行),批生产记录(试行)
(11)中试生产1-3批
|
(9)起草批检验记录
(10)验证并修订原辅料,中间体及中间体控制的质量标准(试行)
(11)验证修订成品质量标准 (12)初步稳定性试验 (13)确定包材和包装规格 |
|
中 试 工 艺 验证
|
↓ ↓ ↓ ↓ 中试验证准备 ↓ ↓ ↓ ↓ 三批中试验证 ↓ ↓ ↓ ↓ 样品 |
(12)修订工艺规程(试行),岗位操作规程(试行),批生产记录(试行),并起草批包装记录 (13)洁净区的空气净化验证方案,工艺用水验证方案,生产设备验证 (14)清洁验证,设备清洁操作规程 (15)实施三批中试验证 |
(14)设备清洁检测方法学验证 (15)起草正式稳定性试验方案
(16)成品全检 (17)稳定性试验放样 |
|
本文来源于全合成
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多