CIP清洗自控制系统在药品生产清洁中的应用
《药品生产质量管理规范(2010年修订)》中要求:清洁方法应当经过验证,证实其清洁的效果,以有效防止污染和交叉污染[1]。清洁验证应当综合考虑设备使用情况、所使用的清洁剂和消毒剂、取样方法和位置以及相应的取样回收率、残留物的性质和限度、残留物检验方法的灵敏度等因素。需采用经过验证或已知有效的清洁和去污染操作规程进行设备清洁;必要时,应当对与物料直接接触的设备表面的残留物进行检测。生产设备清洁的操作规程应当规定具体而完整的清洁方法、清洁用设备或工具、清洁剂的名称和配制方法、去除前一批次标识的方法、保护已清洁设备在使用前免受污染的方法、已清洁设备最长的保存时限、使用前检查设备清洁状况的方法,使操作者能以可重现且有效的方式对各类设备进行清洁。此外,在对设备进行消毒和灭菌时,应对消毒和灭菌的具体方法、消毒剂的名称及配制方法作出规定。结合法规相关要求,为考察CIP清洗自动控制系统的清洁效果,确保多产品共线生产的产品质量可控,保障药品的安全、有效、可及[2],现对CIP清洗自动控制系统在药品生产中的清洁效果予以考察,旨在为日常清洁消毒操作提供数据支持。
1 实验材料
1.1 设备
本次实验所用设备为CIP清洗自动控制系统。
1.2 物料
本次实验所用物料包括:碱液(氢氧化钠水溶液)、酸液(盐酸水溶液)、双氧水和过氧乙酸水溶液。
2 方法与结果
CIP清洗自动控制系统为自动控制系统[3],其清洗原理为:以流动的化学溶液、清洗液、清水作冲刷和循环,进入设备和或系统的表面后,对其自上而下地清洗。可将清洗模式设定为碱洗、酸洗和水洗,启动设定程序后,即可进入清洗过程,清洗结束,系统自动停止。这种清洗方式的优势在于,不必再拆开设备清洗。
2.1 实验方法
按照制定的CIP清洗自动控制系统SOP要求,实验步骤可分为三步:第一步,配制清洗液和消毒液;第二步,设定清洗温度、清洗时间等各项参数;第三步,按照CIP清洗SOP要求对设备进行清洗。本次实验的思路为通过CIP系统设定清洗温度和清洗时间,使得清洗温度和清洗时间与日常清洗温度和清洗时间一致。将CIP清洗用水取样作为对照组、CIP清洗最终的冲洗水取样作为实验组,重复3次以上步骤,以目视检查、消毒剂残留检查和微生物检查为考察指标,得到实验结果并进行统计分析,从而得出实验结论。
首先,应配制完成实验所需的各种清洗液。
碱液配制:向CIP罐注入50%的水,在小罐内加入100 kg浓度为32%的液体食品添加剂氢氧化钠,与水混合即可。
酸液配制:向CIP罐注入50%的水,在小罐内加入100 kg浓度为31%的食品添加剂盐酸,与水混合即可。
消毒液配制:食用级双氧水溶液配制,在化学品储罐内,每次加入50 kg浓度为30%的食用级双氧水,开泵输送到CIP罐即可;过氧乙酸溶液的配制,在化学品储罐内每次加入50 kg浓度为27.5%的过氧乙酸溶液,开泵输送到灭菌器CIP罐混合即可。
2.2 参数设定
2.2.1 清洗温度参数设定
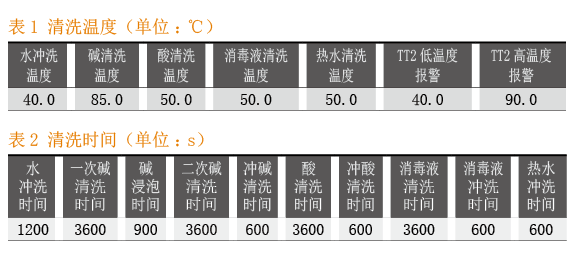
按照CIP清洗自动控制系统SOP要求,清洗温度参数见表1。
2.2.2 清洗时间参数设定
按照CIP清洗自动控制系统SOP要求,清洗时间参数见表2。
2.3 取样方法
取样点分为CIP清洗用水取样点和CIP终洗水取样点。
2.3.1 目视取样
用烧杯取样,CIP清洗用水每个样品取约100 ml,CIP终洗水每个样品取约100 ml。
2.3.2 消毒剂残留取样
用烧杯取样,CIP清洗用水每个样品取约100 ml,CIP终洗水每个样品取约100 ml。
2.3.3 微生物检验取样
用灭菌后的无菌螺口瓶取样,CIP清洗用水每个样品取约200 ml,CIP终洗水每个样品取约100 ml。
2.4 合格标准
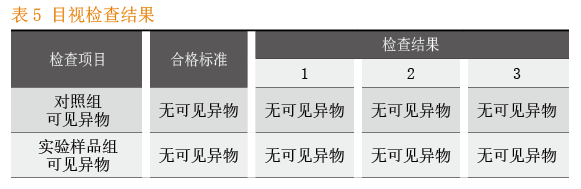
2.4.1 目视检查
CIP终洗水:无可见异物。
2.4.2 消毒剂残留检测
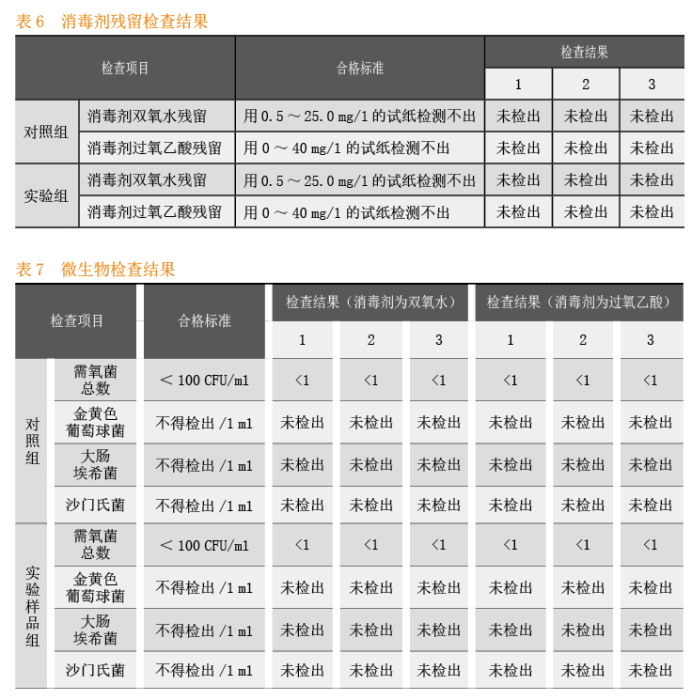
过氧化氢:用0.5~25.0 mg/l的试纸检测不出。
过氧乙酸:用0~40 mg/l的试纸检测不出。
2.4.3 微生物检测
需氧菌总数:<100CFU。
金黄色葡萄球菌:不得检出/1 ml。
大肠埃希菌:不得检出/1 ml。
沙门氏菌:不得检出/1 ml。
2.5 检查结果
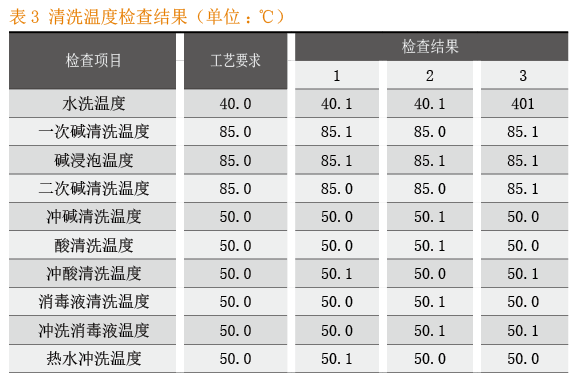
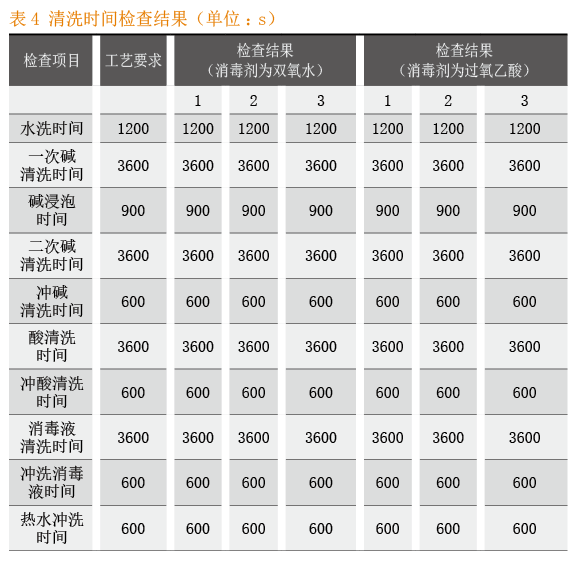
CIP清洗自动控制系统的关键工艺参数:清洗温度检查结果见表3,清洗时间检查结果见表4。CIP清洗自动控制系关键质量属性:目视检查结果见表5,消毒剂残留检查结果具体见表6,微生物检查结果见表7。
2.6 结果
本次实验完全按照CIP清洗自动控制系统SOP要求的操作执行。从中可以得出这样的实验结果:当关键工艺参数中的清洗温度、清洗时间的设定参数与运行参数保持一致时,清洁程序、清洁液与消毒液的配制均符合工艺要求;关键质量属性目视检查、消毒剂残留检查和微生物检查等各项考察指标均符合标准要求。
3 结论与探讨
通过对CIP清洗自动控制系统在药品生产清洁中的应用研究,既验证了CIP清洗自动控制系统SOP要求对清洁程序、清洁液与消毒液配制的适用性,也验证了清洗温度、清洗时间等关键工艺参数对工艺过程的影响,还进一步考察了目视检查、微生物检查以及为防止微生物产生抗体,消毒剂双氧水和过氧乙酸溶液交替使用的消毒剂残留检查等各项指标。
CIP清洗自动控制系统具有运行平稳、方法可靠、操作便捷等特点,各项检查均符合标准要求,可为药品生产日常清洁消毒操作提供数据支持。药品生产清洁活动中,可根据具体生产品种,选择采用合适的清洁剂与消毒剂种类,调整其配制浓度、清洗温度及清洁时间。为防止污染、交叉污染,可在本次实验的基础上,增加化学残留、电导率、TOC检查等措施,以确保多产品共线生产的产品质量可控以及药品的安全、有效、可及。
【参考文献】
[1] 国家药品监督管理局.药品生产质量管理规范(2010年修订)[S].第八十四条、第一百四十三条和第一百九十七条,2010.
[2] 中华人民共和国药品管理法(2019年修订)[EB/OL].第一章总则,第三条,2019.
[3] 尚海宾,邢俊加.小容量注射剂CIP在线清洗系统的概念设计[J].流程工业,2018(12):34-40.
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多