盐酸小檗碱糖衣片与薄膜 包衣片体外溶出度对比研究
本文目的在于对国内不同厂家生产的盐酸小檗碱糖衣片和薄膜包衣片进行体外溶出度比较并分析各溶出参数——依据中华人民共和国药典2020版第四部溶出度与释放度测定法(通则0931第一法)测定。以1 000 mL水为溶出介质,采用转篮法,转速为120 r/min,温度为37 ℃,进行累计溶出百分率测定,用紫外分光光度法在263 nm的波长处测定盐酸小檗碱片吸光度,C200H18CINO4·2H2O的吸收系数(E1%1 cm)为724。该研究中盐酸小檗碱糖衣片和薄膜包衣片的溶出度均符合中华人民共和国药典要求,可为不同包衣生产方法筛选提供依据。
文/ 李振豪,李顺仓,王杰
本文作者李振豪系山东齐鲁医药学院检验主管;李顺仓系安康正大制药有限公司技术工艺总监,制药工程师,药师;王杰系河南信心药业有限公司制药工程师,药师。审稿人王亚锴系河南牧业经济学院制药工程系讲师。
盐酸小檗碱[1]是一种异喹啉生物碱,又称黄连素。存在于小檗科等4科10属的许多植物中。其固体制剂盐酸小檗碱片为黄色薄膜衣片或糖衣片,止泻药类非处方药药品用于肠道感染,已广泛用于治疗胃肠炎、细菌性痢疾等疾病,同时对肺结核、猩红热、急性扁桃腺炎和呼吸道感染等也有一定疗效。抗菌谱广,体外对多种革兰阳性及阴性菌均具抑菌作用,其中对溶血性链球菌、金葡菌、霍乱弧菌、脑膜炎球菌、志贺痢疾杆菌、伤寒杆菌、白喉杆菌等有较强的抑制作用,低浓度时表现为抑菌,高浓度时表现为杀菌。对流感病毒、阿米巴原虫、钩端螺旋体、某些皮肤真菌也有一定抑制作用。盐酸小檗碱片[2]的使用在国内有近20年,生产厂家有900余家,经过对市售的盐酸小檗碱片糖衣片和薄膜衣片的相关文献以及市场调研发现:对糖衣片和薄膜包衣片的溶散、溶出度及生物利用度的认知存在较大争议。盐酸小檗碱片的主要检验项目为药物的溶出度[3],但几乎所有的厂家都是在45 min、限度75%定时进行终点取样检查。这种测定方法只反映了药物溶出的最后结果,未能反映出药物溶出的全过程。溶散时间和溶出度作为指标不仅可以进行生产处方的筛选,两者的溶出曲线是否相似也可用来作为评价盐酸小檗碱在体内生物利用度的重要依据,这能有效地降低盐酸小檗碱片糖衣片和薄膜衣片两者出现临床疗效的风险。故需经过实验研究两者在溶散时间和溶出度的比较结果,这对指导药物制剂的开发,严格控制制剂的内在质量,保证药物安全性和有效性,以及盐酸小檗碱片糖衣片和薄膜衣片质量一致性都具有十分重要的意义。
1 实验材料与仪器
1.1实验材料
盐酸小檗碱对照品,(中国食品药品检定研究院,批号:110713-201814,ID:WHJD-38NM);盐酸小檗碱片(安康正大制药有限公司:盐酸小檗碱糖衣片,批号:20200601.颐生堂药业有限公司薄膜衣片,批号:190910)所用试剂均为分析纯。
1.2仪器
双光束紫外分光光度计(北京普析通用仪器有限责任公司);ZRS-8G智能溶出试验仪(天津大学无线电厂)。
2 方法与结果
2.1溶出方法的选择
溶出度系指活性药物从片剂、胶囊剂或颗粒剂等普通制剂在规定条件下溶出的速率和程度,在缓释制剂、控释制剂、肠溶制剂及透皮贴剂等制剂中也称释放度。本次试验采用2020版《中华人民共和国药典》(第四部)[4](通则0931第一法)转篮法测定。
(1)转篮分篮体与篮轴2部分,均为不锈钢或其他惰性材料制成。其形状尺寸:篮体由方孔筛网(丝径为0.28±0.03 mm,网孔为0.40±0.04 mm)制成,呈圆柱形,转篮内径为20.2±1.0 mm,上下两端都有封边。篮轴的直径为9.75±0.35 mm,轴的末端连一圆盘,为转篮的盖子;盖上有一通气孔(孔径为2.0±0.5 mm);盖边系2层,上层直径与转篮外径相同,下层直径与转篮内径相同;盖上的3个弹簧片与中心呈120°。
(2)溶出杯一般为由硬质玻璃或其他惰性材料制成的底部为半球形的1000 mL杯状容器,内径为102±4 mm(圆柱部分内径最大值和内径最小值之差不得大于0.5 mm),高为185±25 mm;溶出杯配有适宜的盖子,盖上有适当的孔,中心孔为篮轴的位置,其他孔供取样或测量温度用。溶出杯置于恒温水浴或其他适当的加热装置中。
(3)篮轴与电动机相连,由速度调节装置控制电动机的转速,使篮轴的转速在各品种项下规定转速的±4%范围之内。运转时整套装置应保持平稳,不能产生明显的晃动或振动(包括装置所处的环境)。转篮旋转时,篮轴与溶出杯的垂直轴在任一点的偏离均不得大于2 mm,转篮下缘的摆动幅度不得偏离轴心1 mm。
(4)仪器一般配有6套以上测定装置。溶出杯为大杯;取样6片,每个转篮中放入1片,用1 000 mL纯化水作介质,转速为120 r/min,温度 37 ℃,依法操作,取样点为:10 min、15 min、20 min。
2.2.标准曲线
精密称取盐酸小檗碱对照品10 mg置于250 mL容量瓶中,加沸水溶解放冷并稀释至刻度,摇匀。精密量取0.25 mL、0.5 mL、1.0 mL、2.0 mL、3.0 mL置10 mL量瓶中,加溶出液稀释至刻度,摇匀。以溶出介质为空白对照,在263 nm的波长处分别测定溶液的吸光度。用最小二乘法,以溶液浓度(C,µg/mL)为横坐标,吸光度(Y)为纵坐标,得到标准曲线:Y=0.02853C+0.00712.r=0.9998,线性范围为25~30 μg/mL。
2.3溶出度考察
分别取盐酸小檗碱片糖衣片和薄膜包衣片,采用转篮法测定,溶出杯为大杯;取样6片,每个转篮中放入1片,用1 000 mL纯化水作介质,转速为120 r/min,温度为37 ℃,依法操作,取样点为:10 min、15 min、20 min时取溶出液10 mL,并补充溶出液10 mL。
取溶出液适量,滤过,精密量取续滤液适量,用水定量稀释制成每1 mL中约含盐酸小檗碱5 µg的溶液,摇匀。照紫外-可见分光光度法(通则0401),在263nm的波长处测定吸光度,按C20H18CINO4·2H2O的吸收系数(E1%1cm)为724计算每片的溶出量。限度为标示量的70%,应符合规定。
2种包衣不同时间点的累积溶出百分率数据(见表1)溶散程度(见图1)溶出曲线(见图2)。
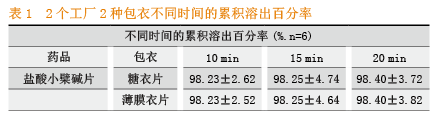

图1 溶散10 min溶散程度对比

图2 溶散15 min溶散程度对比
2.4溶出曲线相似因子的计算
从表1中看出虽然2个厂家20 min组累积溶出百分率均超过75%,达到98%以上,但从图3和图4不同时间累积溶出百分率从图中可以直观地看出,10 min后2个厂家的溶出曲线相近似,为了进一步定量地比较两厂家产品溶出曲线之间的差异,采用FDA推荐的方法相似因子法(f2因子),比较各厂家溶出曲线间累积溶出率的相似性[5]。相似因子:
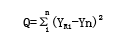
f2=50×lg[(1+Q/n)-0.5×100。
其中Tt:受试样品平均溶出度;Rt:参比样品平均溶出度;Q:试验药品与对照药品的平均溶出度的方差和;n:取样次数;f2:相似因子。

图3 溶散20 min溶散程度对比

图4 不同时间溶出曲
如果50≤f2≤100则表示2个制剂的溶出曲线相似,反之则两个制剂的溶出曲线不相似。
经过计算,2个厂家的f2分别为:56、56,57、57,均大于50,说明在任一取样点的溶出量平均差异不超过10%,糖衣片的药物溶出度和薄膜包衣片的药物溶出度相似。
3 结论
溶出度是指药物从片剂或胶囊剂等固体制剂在规定溶剂中溶出的速度和程度,是评价一种药物制剂不同品种、不同厂家产品、不同批次间质量的重要数据。体外溶出度在某种程度上与体内生物利用度呈现一定的相关性,根据体外溶出度的数据可估计药物动力学和药物生物利用度的特性。溶出度(溶出曲线)评价方法有多种,美国FDA在2000年的口服固体药品生物利用度和生物等效性研究指南中,推荐使用相似因子法评价其溶出度,以确定仿制品与对照品的溶出度差异,并确定试验药品的相似因子大于50为等效,其基本原理是根据生物等效性的基本假设进行体外溶出度的等效性评价,相似因子法计算的基本假设是试验药品与对照药品的累积溶出度差的最小平方和。该方法计算简便,能确定试验药品与对照药品的溶出度差异。
通过对市售2个厂家盐酸小檗碱糖衣片和薄膜包衣片药物溶出曲线的监测,更客观地反映了溶出的真实情况,显示了盐酸小檗碱片溶出全过程存在的差异、实验结果发现,不同厂家的糖衣片和薄膜包衣片的体外溶出度均符合一般规定,即10 min累积溶出百分率均超过75%。
由溶出曲线可以看出不同厂家使用的包衣制备工艺的不同,片剂质量不存在显著性差异。本实验实时、准确地监测药物固体制剂的动态溶出过程,对于药物制剂工艺研究、药品质量控制及生物利用度等方面具有重要的意义。
医疗体制改革后,一些疗效确切、不良反应小、质优价廉的国产药品将重新受到青睐。为了进一步保证质量,建议对同类产品处方、工艺做到合理控制,以提高质量,确保患者用药安全有效。
【参考文献】
[1] 何琳.22批盐酸小檗碱片质量分析[M].中国药业,中国医药科技出版社,2006,15(18):30-31
[2] 顾新,刁雨辉.江苏药学与临床研究[M].中华人民共和国新闻出版总署,2003.11(2):5-6.
[3] 中华人民共和国药典(二部)[S].中国医药科技出版社,2020,通则P1054.
[4] 中华人民共和国药典(四部)[S].中国医药科技出版社,2020,通则P132.
[5]封跃鹏.稳健统计技术及其在实验至能力验证数据处理中的应用[J].化学分析计量,2007,16(2):55-56.
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多