除病毒过滤可优化点探讨
单克隆抗体下游纯化步骤一般包括亲和捕获、低pH病毒灭活、中度纯化、精细纯化、除病毒过滤、超滤换液——其中,由于除病毒过滤器的价格昂贵和一次性使用的特性,导致除病毒过滤占用了整个生产工艺的很大一部分成本。因此,优化除病毒过滤器的载量显得格外重要。如今,白帆生物已经完成了2个项目的工艺优化实验,这两个项目都着重提高了除病毒过滤器的载量,且两个项目即将进行2 000 L的生产。本文从白帆生物优化除病毒过滤器载量经验而来。
文/ 李世燕
本文由白帆生物科技(上海)有限公司提供。
现行法规要求在生物制药制造过程中至少使用2种不同的方法去除病毒[1],我们常用的病毒去除/灭活的方法就是除病毒过滤和低pH病毒灭活法。低pH病毒灭活法主要灭活脂包膜病毒。而非清除脂包膜病毒,如小白鼠病毒(MMV),通常通过物理方法实现分离,因为其对化学失活具有很高的抵抗力,因此需要除病毒滤膜来去除在生物制药产品的纯化过程中产生的非脂包膜病毒。除病毒过滤滤膜既可以去除非脂包膜病毒,也可以去除脂包膜病毒。
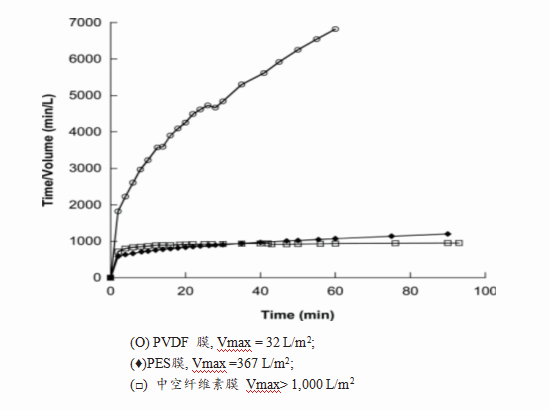
图 1 不同材质滤器过滤某一蛋白的载量
除病毒滤膜为死端过滤,截留大于孔径的病毒颗粒,一般对于小于170 kDa的蛋白产品,回收率大于98%。在病毒过滤过程中,常常有各种因素可能会导致过滤通量降低、滤器载量降低。本文探讨了从滤器选择、样品pH与电导优化、样品浓度选择和添加剂选择共4个方面来优化滤器的载量,以达到降低生产成本、节省过滤时间的目的。
滤器选择
不同厂家的滤器材质不同,适合的蛋白产品也不同。现有滤器材质一般分为3类:PES、PVDF和中空纤维素。在实验中,分别使用这3种材质的滤器过滤相同蛋白,且蛋白浓度相同,结果发现不同材质之间的过滤载量差别巨大[2]。如图1所示,中空纤维素膜载量>PES膜>PVDF膜,就此蛋白样品而言,使用中空纤维素膜材质的滤器最合适。但若换了其他不同性质的蛋白,结果可能就完全相反,因此,需针对不同蛋白样品选择不同的滤膜材质。
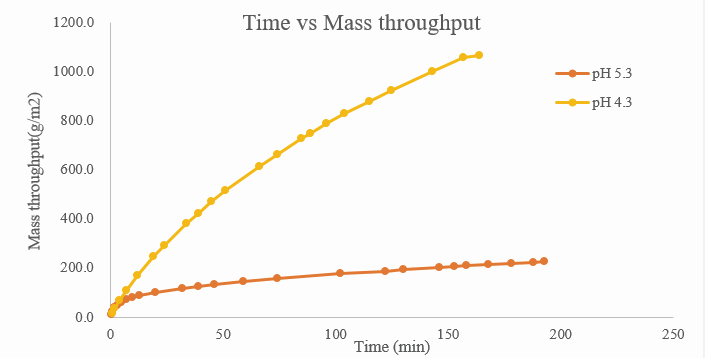
图 2 某样品在不同pH条件下的过滤载量
样品pH与电导率优化
样品的pH和电导率都有可能对除病毒滤器载量造成影响。如图2案例所示,对同一单抗产品使用相同滤器进行过滤,样品浓度一致,分别在pH为4.3和5.3的条件下进行实验。结果前者的过滤载量远远大于后者。电导率也同样能对除病毒滤器造成如此大的影响。因此,需从实际出发,对最适pH、电导率进行考察以降低成本。
样品浓度选择
生产过程中,在需要的蛋白量相同的情况下,蛋白浓度越高,样品体积就越小,需要的储液袋、储液罐体积就越小,工艺时间也会缩短,因此工艺都在往高浓度方向发展。一般情况下,较高的蛋白浓度会导致较低的过滤速率。如图3所示,蛋白浓度为10.25 mg/mL的通量从220 LMH迅速降低至10 LMH,而浓度为6.895 mg/mL的蛋白样品在此时仍有150 LMH的通量。由此可见,就此工艺而言,样品浓度为7 mg/mL左右时过滤载量较优。若想找到最优范围,仍需选择其他浓度进行实验。因此,除病毒过滤需要结合工艺时间、成本等因素找到合适的浓度范围,优化性价比。
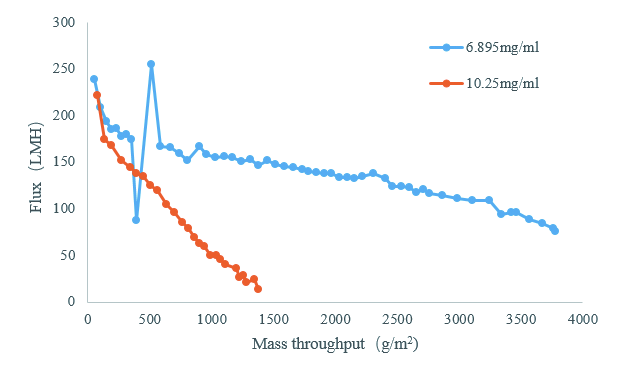
图 3 某样品在不同浓度下的过滤通量
添加剂选择
若蛋白样品不稳定,容易产生聚体,这会很大程度地影响除病毒滤器载量。我们可以通过添加氨基酸(精氨酸、组氨酸等)、糖类或者表面活性剂来稳定蛋白,从而提高滤器载量。
预过滤器的选择
预过滤滤器对纳滤过滤器的性能有很大的影响,使用得当可以明显地减少纳滤过滤器面积的使用。预过滤的目的是去除各种杂质、污染物,如蛋白质聚集物、DNA和其他微量物质。不同的预过滤器处理的料液不同。如图4所示,Viresolve® Pro Micro Shield H 适合处理高pH、高电导率的样品,而Viresolve® Pro Micro Shield适合处理低pH、低电导率的样品[3]。
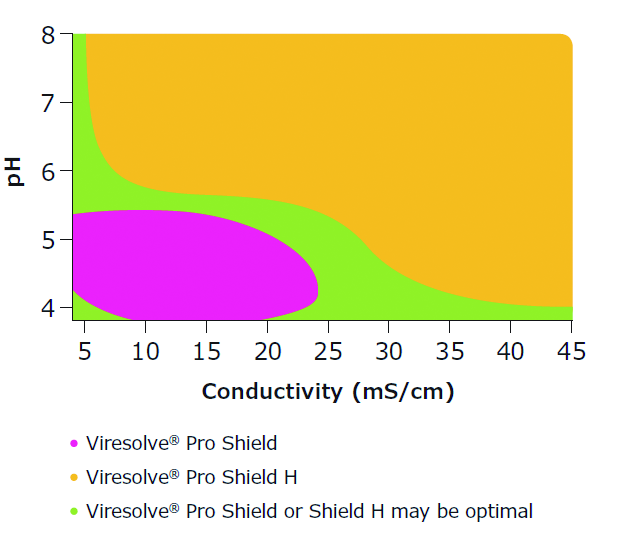
图 4 Viresolve® Pro Micro Shield H和Viresolve® Pro Micro Shield适合的pH和电导率
预过滤器的面积大小也会对除病毒滤器载量造成很大的影响,越大的预过滤器面积会使除病毒滤器载量越大。如图5所示,预过滤与除病毒滤器比例为4:1时,通量明显大于比例为1:1时。结合滤器价格分析,若选择比例为4:1时增加的预过滤器价格低于选择比例为1:1时除病毒滤器增加的价格,则可考虑选择4:1的比例进行除病毒过滤。
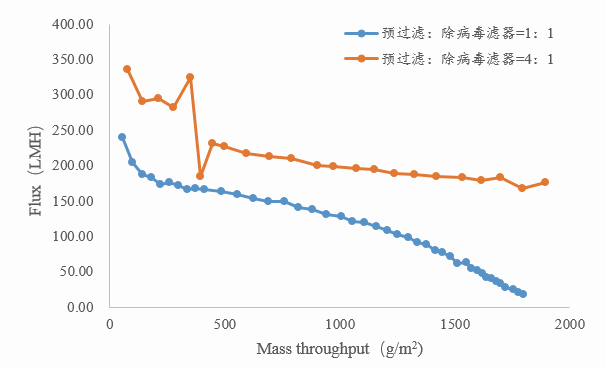
图 5 预过滤器比例对某蛋白过滤载量的影响
总结
在本文中,我们探讨了影响除病毒过滤器载量的不同因素,也分别举了几个例子来展示这些因素对载量可能的影响,从这些例子中我们可以看出滤器、样品pH、电导率、样品浓度、添加剂、预过滤器的不同都会对除病毒过滤造成不同的影响。若要使生产过程中除病毒过滤工艺成本最低,需综合考虑各个因素的相互影响。
白帆生物生产车间目前有2条2 000 L一次性生产线,未来可达6×2 000 L,如图6所示。除病毒过滤阶段拥有Sartorius的FlexAct VI和FlexAct VR两台设备,能全自动地进行低pH病毒灭活和除病毒过滤操作。一次性的自动化操作单元,大大降低了污染风险,减少了样品在不利环境中的暴露时间和不必要的清洁验证,使得除病毒过滤操作更快速、安全、高效。

图6 白帆生物生产车间目前有2条2 000 L一次性生产线,未来可达6×2 000 L
作为国内一次性使用技术与商业生产及CDMO服务结合的时代领军者,白帆生物与Cytiva和Satorius等国际企业强强联合,将“NONCROS无交叉抗体工厂”的概念变为现实,引入现代化一次性使用系统生产线,建立了上海最大的单抗生产基地之一。该基地除了满足集团内产品的生产需求,也致力于为同行提供单抗CDMO服务,谋求共同发展。
【参考文献】
[1].国家药品监督管理局.血液制品去除/灭活病毒技术方法及验证指导原则. 国药监,2002:160.
[2].Bruno F. Marques, David J. Roush, and Kent E. Go¨klen.Virus Filtration of High-Concentration Monoclonal Antibody Solutions.Biotechnol. Prog.2009, 25,483-491.
[3].Millipore. VmaxTM Constant Pressure Testfor Sizing Viral Clearance Filters.
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多