不同 CGT 产品生产工艺平面设计分析
文章通过分析多种常见细胞与基因治疗产品(CGT)生产工艺的不同要求,提出不同的工艺平面设计方案,重点探讨不同功能模块的分区、人、物流线的规划以及主要生产配套设施的平面规划设计方案。
近些年,细胞与基因治疗产品在制备工艺方面,由于种类的多样性与所采取工艺的差异性,且仍处于快速迭代的时期,目前尚无较为通行的、统一的制造工艺,需要灵活的生产工艺平面和配套设施,以支持不同的工艺流程,因此,产品和载体制造需标准化和规模化。正是由于近年来细胞治疗产品在我国逐步从产品研发阶段进入到商业化生产阶段,2023《GMP指南》第二版《无菌制剂》分册[1]新增了这部分内容,为这类产品的 GMP 生产实施提供了一些指导。
Part.01产品定义
传统药物往往作用于蛋白,而基因治疗则直接作用于 DNA,在根源上治疗疾病。根据作用类型的不同,细胞与基因治疗(CGT)主要分为两大类——体内治疗和体外治疗 :体外治疗的代表为细胞疗法 ;体内治疗的代表为基因疗法。
细胞治疗是指应用人自体或异体来源的细胞经体外操作后输入(或植入)人体,用于疾病治疗的过程。体外操作包括但不限于分离、纯化、培养、扩增、活化、细胞(系)的建立、冻存复苏等。细胞治疗主要可分为免疫细胞治疗、干细胞治疗和其他体细胞治疗。
基因治疗产品通常由含有工程化基因构建体的载体或递送系统组成,其活性成分可为 DNA、RNA、基因改造的病毒、细菌或细胞等。根据基因载体类型的特性差异,基因治疗产品主要可分为以病毒为载体的基因治疗产品、以质粒 DNA 为载体的基因治疗产品、RNA 类基因治疗产品,以及以细菌微生物为载体的基因治疗产品,其中以病毒和质粒 DNA 为载体的基因治疗产品较为常见。
Part.02生产工艺分析
细胞与基因治疗产品生产,包括质粒、病毒、细胞,病毒、质粒同为载体,将目的序列递送到靶细胞内部。质粒 DNA 所搭载的目的序列是 DNA,DNA 通常需要进入细胞核才能行使相应的功能,病毒载体搭载的序列可以是 DNA,也可以是 RNA,而RNA 序列通常不需要入核行使功能,并且如果是进行宿主基因组的同源重组,病毒载体效率更高。质粒通常是在原核细胞内进行扩增后提纯,病毒载体通常在真核细胞内包装后逐步扩大培养后裂解细胞 / 收集上清后提纯获得。质粒通常稳定性非常好,对温度不敏感,病毒不一样,一般需要低温冷冻保存,对温度很敏感,反复冻融对活力影响也非常大。一般生产制造基地以从事质粒、病毒生产为主,而“细胞药”经不起长途颠簸和长时间冷冻,要求以最短流程、最快速度为患者提供个体化精准治疗。不管是医院还是药企都希望能缩短彼此之间的距离,因此,未来将催生‘前院后厂’的新模式。细胞与基因治疗产品典型生产流程图如下图 1,包括质粒生产、病毒载体生产及细胞治疗产品生产三条典型生产工艺流程。
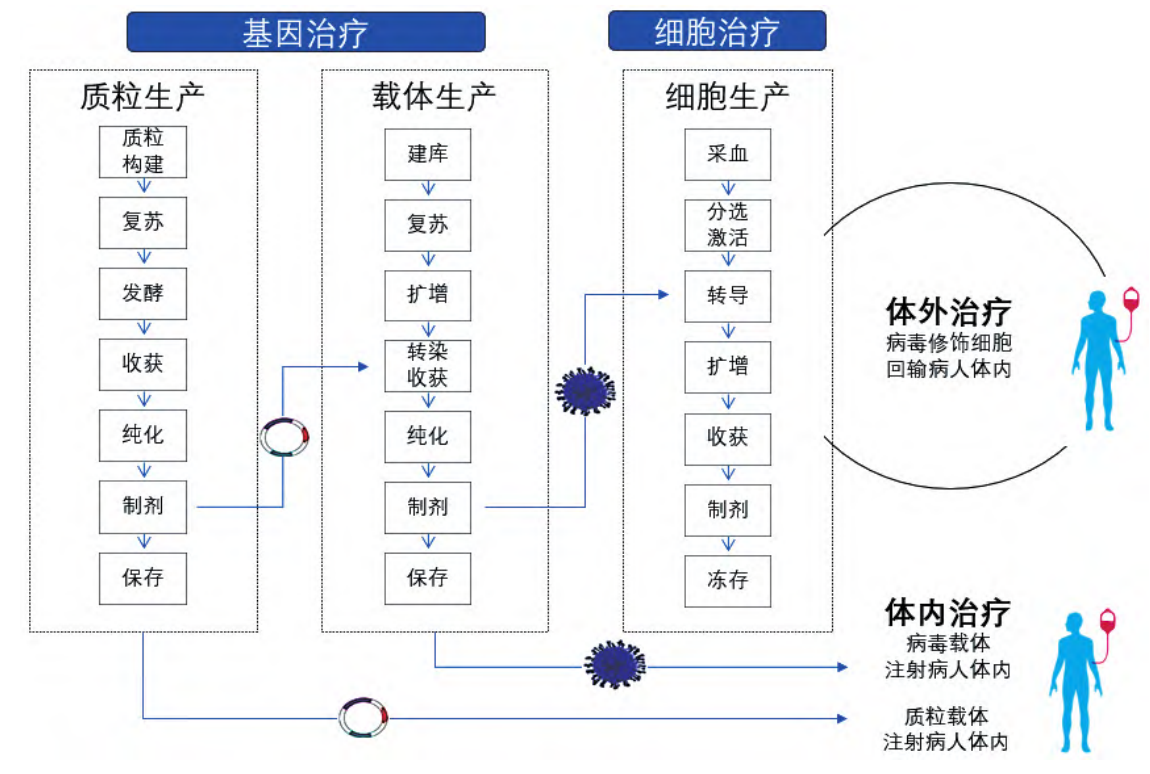
图 1 细胞与基因治疗产品典型生产流程图[1]
2.1 质粒生产
如图 1 所示,质粒生产可分为上游(生产)工艺和下游(纯化)工艺,上游生产包括质粒构建及细菌转染,将构建好的质粒 DNA 转化到工程菌(如大肠埃希菌)建立主细胞库和工作细胞库,冻存的菌种在接种间内进行复苏,然后进行发酵培养扩增、离心裂解收获 ;下游进行各种纯化、最后除菌过滤分装保存。质粒可以扩散到空气中,不容易降解,空间熏蒸不能破坏质粒,可能会带入到产品中扩增。 在质粒的生产过程中建议尽可能使用密闭系统,避免质粒的暴露和泄漏,在不可避免的敞口操作中,应使用生物安全柜进行保护[1]。根据药品生产质量管理规范 -细胞治疗产品生产操作示例表,如表 1 [2]所示,建议质粒生产区洁净环境设置如下 :种子复苏在 C+A 环境下操作,其余上游区操作均在密闭罐中发酵,因此,在产品纯化之前都可以在 D 级环境下生产,直至深层过滤后,进入纯化阶段开始要求在C级环境下操作。另因上游操作区可能涉及活菌体,故上游区需考虑所有废固、废液灭活处理后送出。质粒生产功能区及洁净区划分以及关键物料走向,如图 2 所示。
表 1 生产操作环境洁净度级别参照示例表
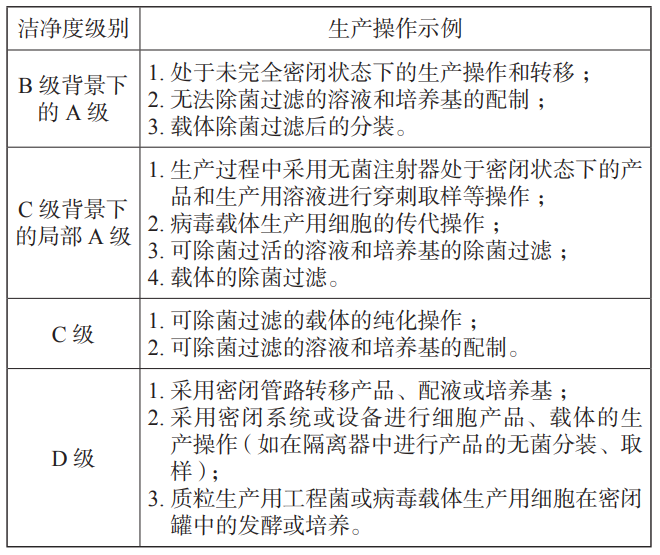
注 :表格中除 D 级以外的生产操作示例,均指在非密闭系统下的操作。
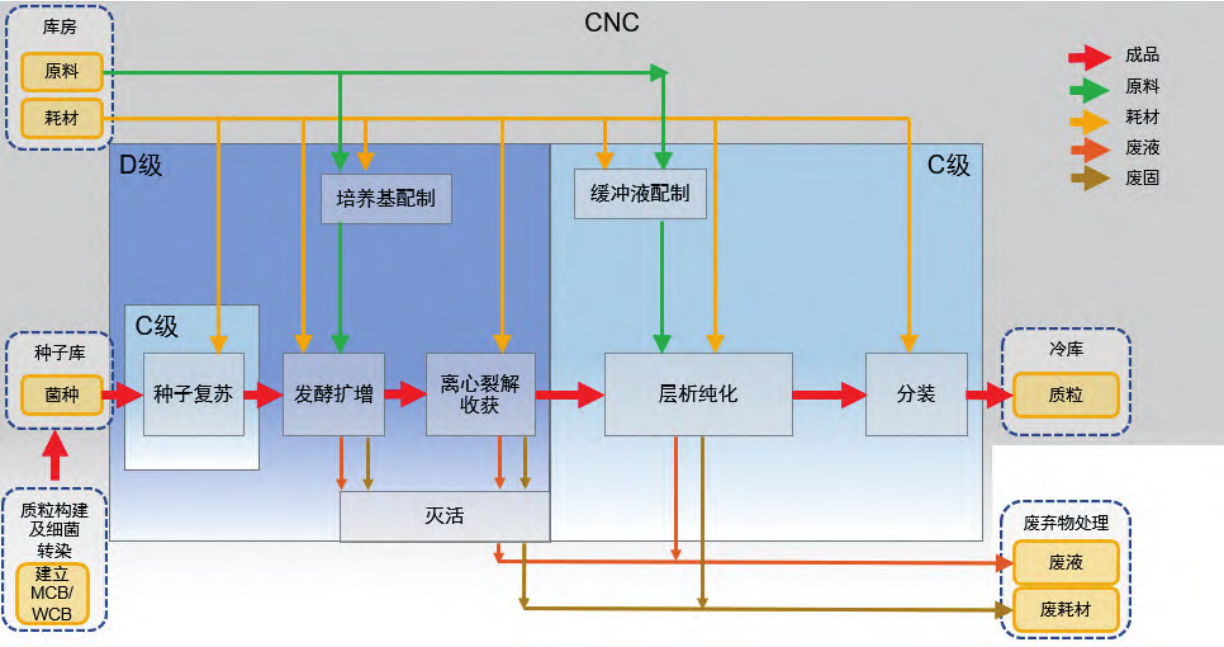
图 2 质粒生产车间主要功能区、净化区划分和关键物料走向示意图
2.2 病毒载体生产
如图 1 所示,病毒载体生产也分为上游(生产)工艺和下游(纯化)工艺。上游生产工艺包括细胞复苏、细胞扩增、转染、离心、过滤等。下游纯化工艺包括各种层析纯化和除菌过滤分装。根据表 1,可除菌过滤病毒载体生产上下游操作环境为 C 级[2]。载体生产分有毒区和无毒区,细胞复苏、发酵扩增为无毒区,从上游转染开始到下游纯化均为有毒区,有毒区均需考虑废液、废固灭活后运出。病毒载体生产功能区及洁净区划分以及关键物料走向,如图 3 所示,不可除菌过滤的病毒载体生产环境应改为 B 级。
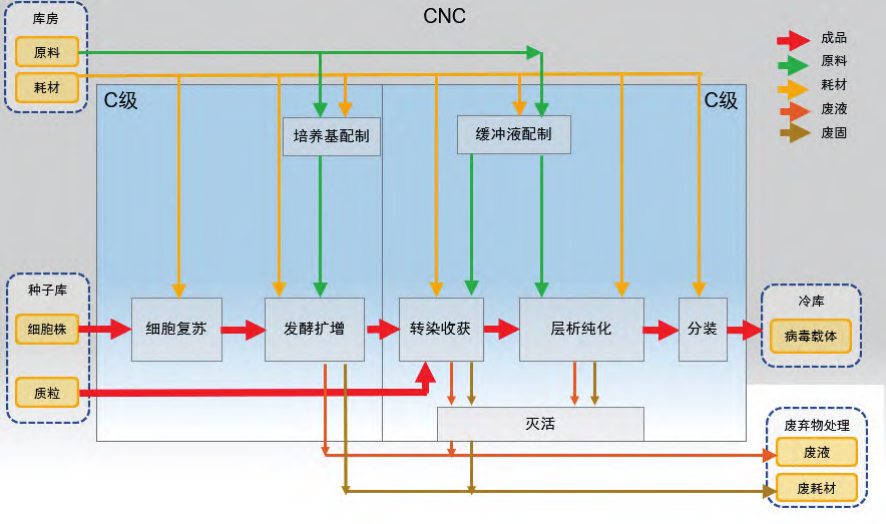
图 3 病毒载体生产车间主要功能区、净化区划分和关键物料走向示意图
2.3 mRNA 原液生产
mRNA 药物生产,包括质粒生产、mRNA 体外转录和纯化、药物递送系统装载和无菌制剂生产,其中,药物递送系统装载如 LNP 制剂,采用脂质纳米材料需使用大量酒精,厂房设计时需考虑该生产区域的防爆设计。质粒生产和无菌制剂生产一般是独立车间生产,mRNA 原液核心生产车间主要包括质粒原液复融、质粒线性化、体外转录、纯化超滤、递送系统装载、过滤分装后送至无菌制剂车间生产 mRNA制剂。根据表 1,mRNA 原液通常可最终除菌过滤,因此生产操作环境为 C 级。mRNA 原液生产功能区及洁净区划分以及关键物料走向,如图 4 所示。
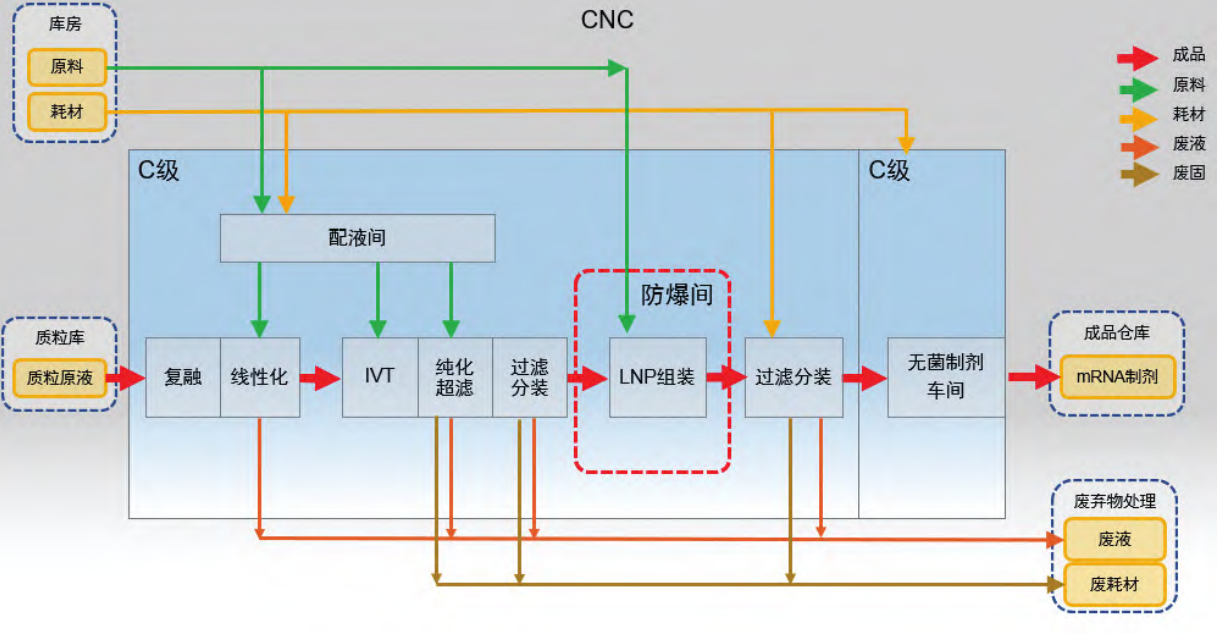
图 4 mRNA 原液生产车间主要功能区、净化区划分和关键物料走向示意图
Part.03工艺平面设计
生产工艺流程确定后,必须明确输入每一步的工艺参数,比如每一操作步骤的输入输出物料量,这些数据大多是基于中试或小试放大实验后的一些假设数据,基于这些数据对每一操作单元进行详细的物料衡算,得出各类型工艺设备的选型计算,同时,对单元操作房间进行工艺设备布局从而推导出单元操作间的需求面积。那么,进行生产场地的总体规划设计首先需要对功能模块进行识别分析,以便推导出房间毗邻关系图[3]。如图 5 所示,细胞与基因治疗产品生产包括有建库区,如细胞建库、质粒建库、病毒建库。建库后要有种子库存放。然后进行质粒生产、病毒生产、细胞药生产或 mRNA 原液生产等。原液车间有上游工艺、下游工艺及配套的配液区、洗消区和原液冷库。制剂工艺一般分开设置在无菌制剂车间。生产区可按有毒区和无毒区分开设置,不同生产区域应独立设置,包括独立的人物流通道、洗消区域。所有产线均涉及清洗灭菌,涉及活有机体区域应考虑灭活系统。洗衣可以集中设置洗衣中心。此外,所有生产都需要考虑配套的生产支持系统,包括生产管理、QA/QC、公用工程设备间等。
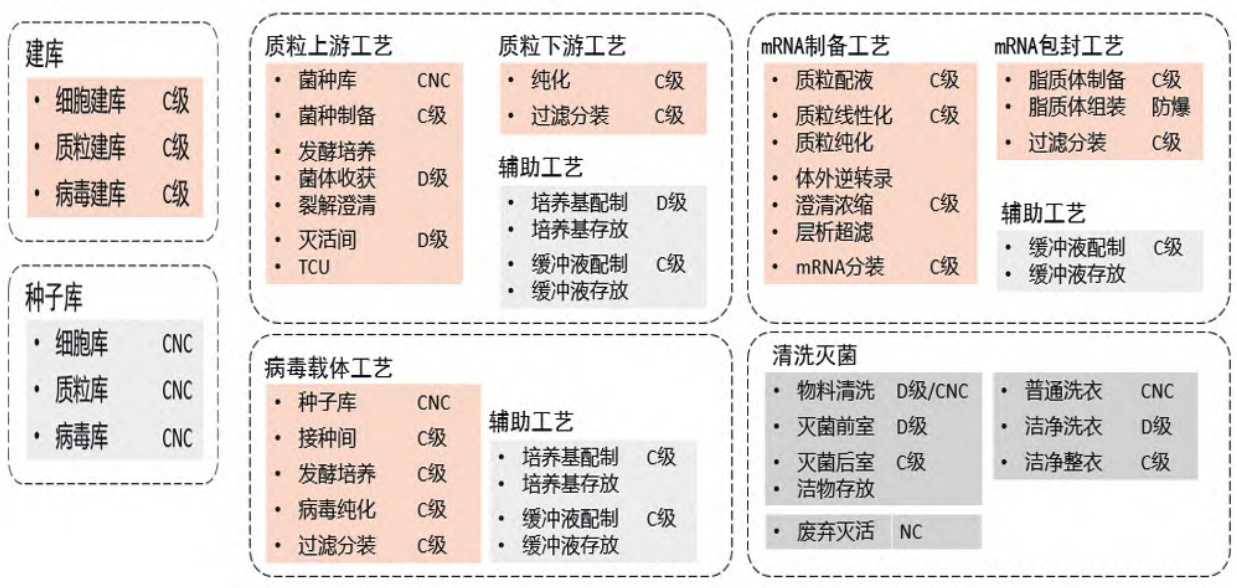
图 5 CGT 生产车间不同功能模块拆分示意图
具体到每个生产工段,平面一般采用两种设计思路 :双通道单向流设计或单通道设计,具体采用哪种取决于生产及场地具体情况,比如生产是单品种还是多品种、生产过程中是否采用全密闭系统,通过风险评估确定时间 / 空间的隔离措施,最终确认是否要严格采用单向流设计。
垂直流设计思路,即配液在上层,生产在下层。这种垂直流线设计利用设备位差,竖向输送物料更便捷、更节能,减少泵使用的麻烦 ;按功能模块分区设计,便于生产管理 ;同类型设备集中布置,有利于公用工程管道布置 ;这种布局更易于实现多功能车间、多品种共线生产。同时,可结合人物流、空调系统划分,考虑工艺单元模块组合。从上游工艺、下游工艺、配液中心、洗消中心等不同工序分模块设计,不仅可以很好地控制交叉污染,同时可以根据生产排班设计空调运行模式的切换,达到节能的目的。
3.1 质粒、病毒、细胞建库区
质粒、病毒、细胞建库区就是将质粒、病毒载体或活细胞数量均一且体积适宜地独立分装后保存于规定条件下的库房。建库的目的就是为了保证生产的可持续性和产品质量的稳定。建库区这种布局通常类似于实验室大通间,每个操作间设独立的人员进出和物料进出通道,以及灭活间,如图 6 所示。
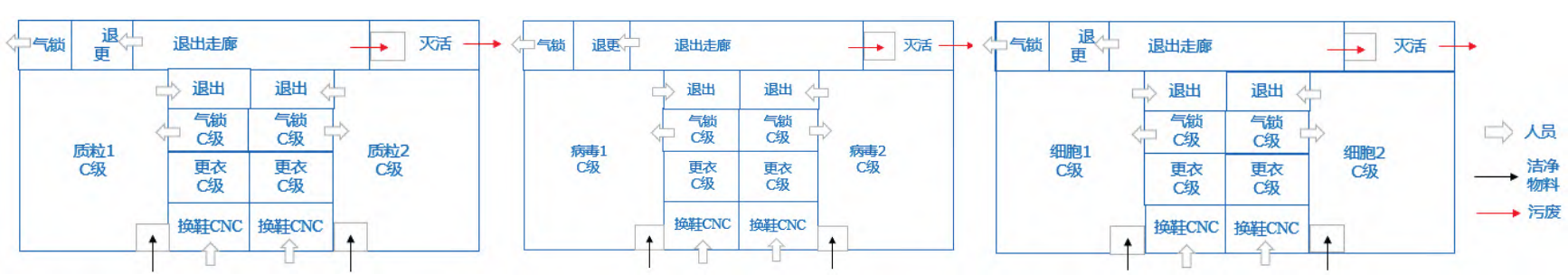
图 6 CGT 生产车间建库区布局示意图
3.2 质粒生产车间
质粒工艺化生产流程包括逐级放大的菌体扩增过程和下游纯化过程,CGT 治疗中最常用的载体AAV 和慢病毒的生产都需要质粒作为起始材料,因此每年需要大量符合质量要求的质粒来满足下游细胞与基因治疗的市场需求。需注意的是质粒可以扩散到空气中,不容易降解,空间熏蒸不能破坏质粒,可能会带入到产品中扩增。在质粒的生产过程中建议尽可能使用密闭系统,避免质粒的暴露和泄漏,在不可避免的敞口操作中,应使用生物安全柜进行保护[1]。质粒的生产可以分为上下游区域,上游区域包括接种、发酵、离心裂解、过滤,过滤前可设在 D 级区内,下游区包括各种纯化、过滤、分装,需要设在 C 级区内操作[2],培养基配液一般靠近上游区域设置,缓冲液配液靠下游区域设置,如图 7 所示。
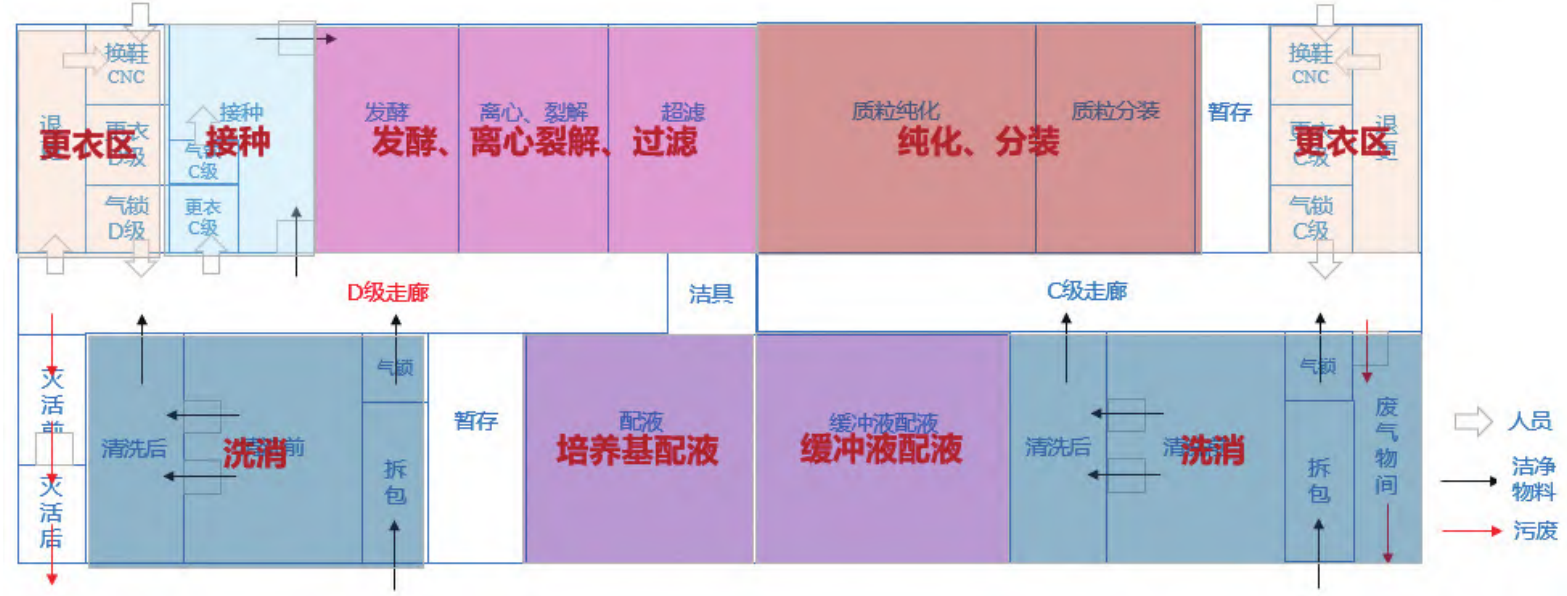
图 7 质粒生产车间平面布局示意图
3.3 病毒载体生产
病毒种类很多,不同种类病毒制备工艺存在一些差异,如腺病毒可以通过病毒毒液感染细胞的方式来扩大病毒产量,相比于需要使用大量 pDNA 的AAV、慢病毒等病毒载体的生产,其成本较低。目前常用于基因治疗的病毒载体包括慢病毒(LV)、腺相关病毒(AAV,单链线性 DNA 病毒)、腺病毒(AdV,大分子双链无包膜 DNA 病毒)和转录病毒(RV,RNA 病毒)。
慢病毒载体能整合进宿主细胞基因组和不具有组织特异性的特点,使慢病毒载体被广泛用于体外细胞基因治疗中。某慢病毒载体生产工艺流程主要分为上游(细胞复苏、细胞扩增、细胞转染收获),下游主要为纯化、浓缩等环节,最后为灌装环节。根据慢病毒载体的生产工艺流程,将车间按无毒区(细胞复苏、细胞扩增)和有毒区(细胞转染、纯化、浓缩等)进行严格区分,分设 2 套独立洁净空调系统[1],如图 8 所示。
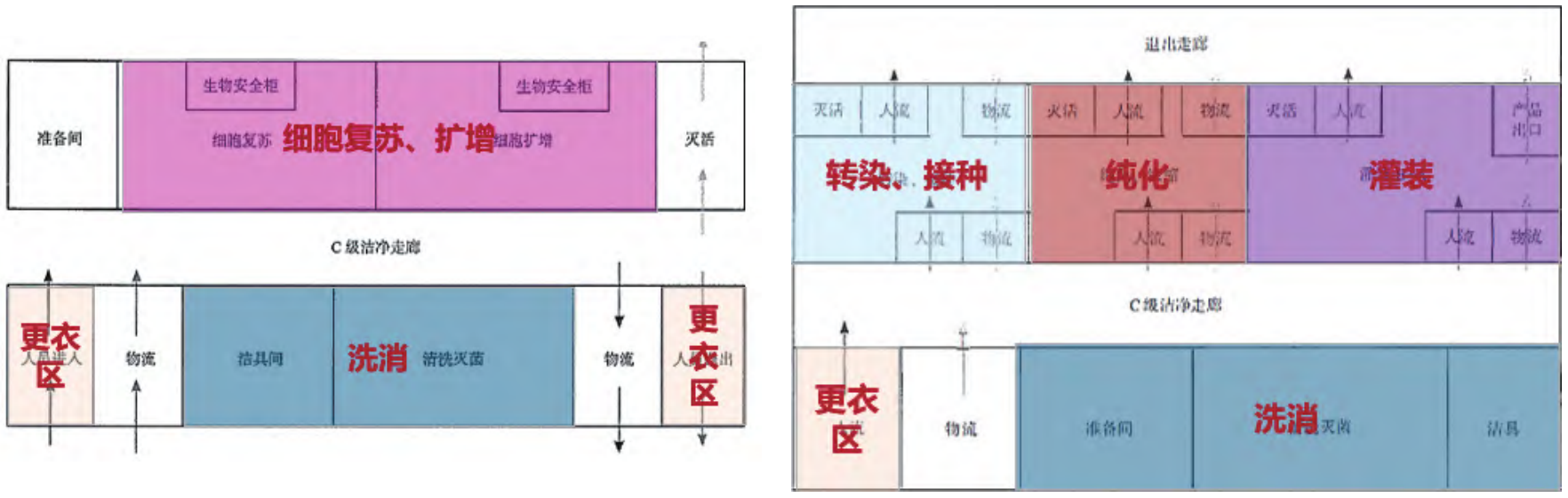
图 8 慢病毒载体生产车间平面布局示意图[1]
另一种布局思路从上游接种到下游纯化工艺流线严格采用单向流设计,分区设置独立空调系统,共享更衣区、配液区、洗消区、灭活区及物流通道等,节省了公共配套辅助区。如图 9 所示。
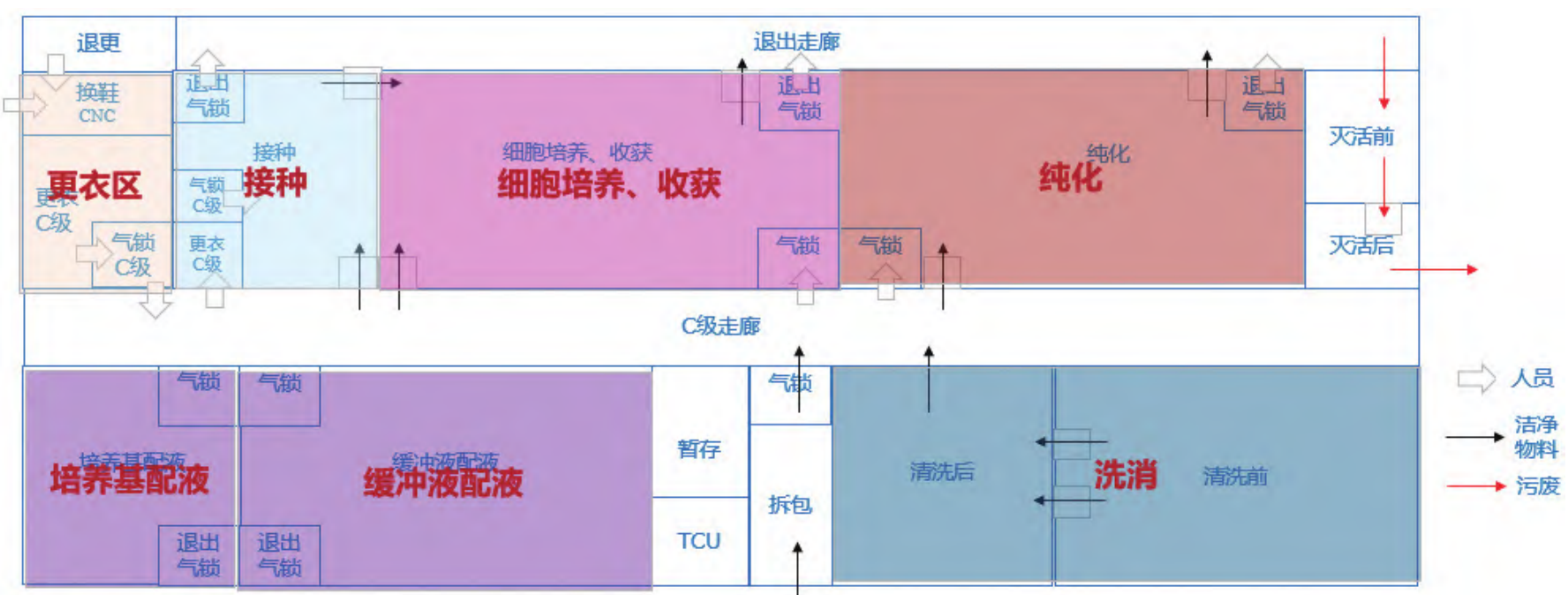
图 9 病毒载体生产车间平面布局示意图
3.4 细胞治疗产品生产
细胞治疗产品所需生产设备有生物安全柜或隔离器、培养箱、离心机、细胞计数仪、培养瓶或生物反应器系统及特定工艺的设备(如细胞分离和转导系统等)。其所采用的设备与管路系统可为密闭系统和非密闭系统。
图 10 为非密闭工艺条件下的厂房示意图,如图所示,工艺操作间人、物单向流动,准备间人、物非单向流动,各主操作间共用进入、退出走廊,进入和退出走廊均为洁净区。
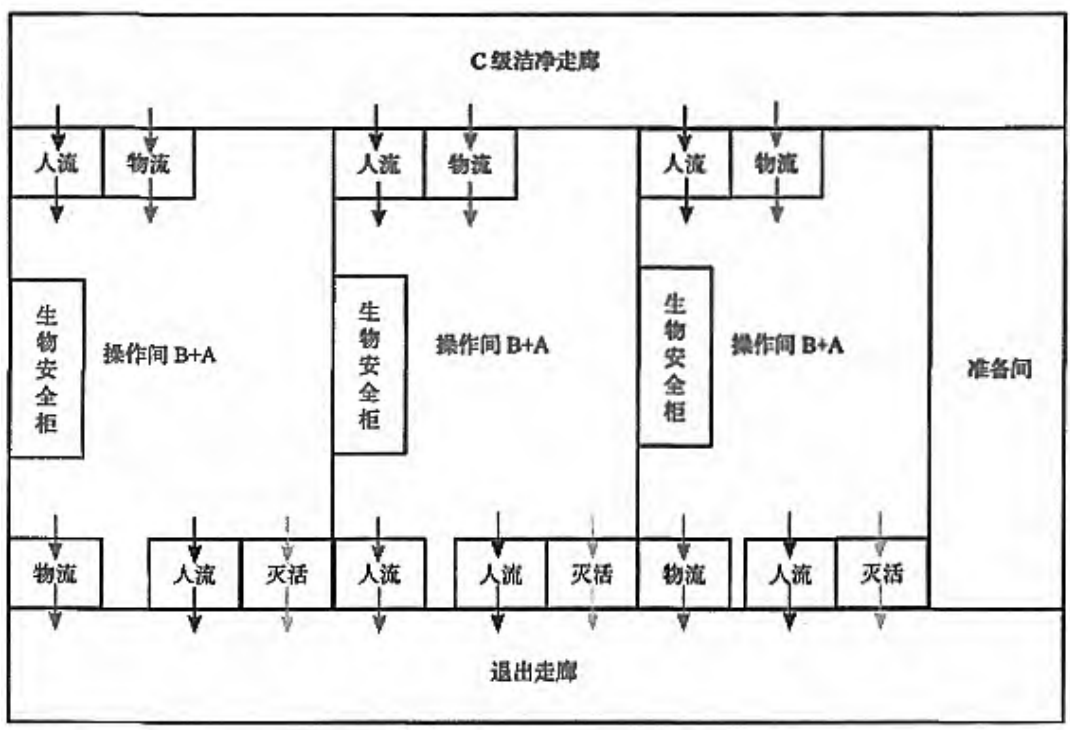
图 10 某非密闭工艺条件下的车间示意图[1]
采用密闭设备和管道,其环境的洁净度级别可适当降低,可以考虑 C 级或 D 级[2]。如图 11 所示。
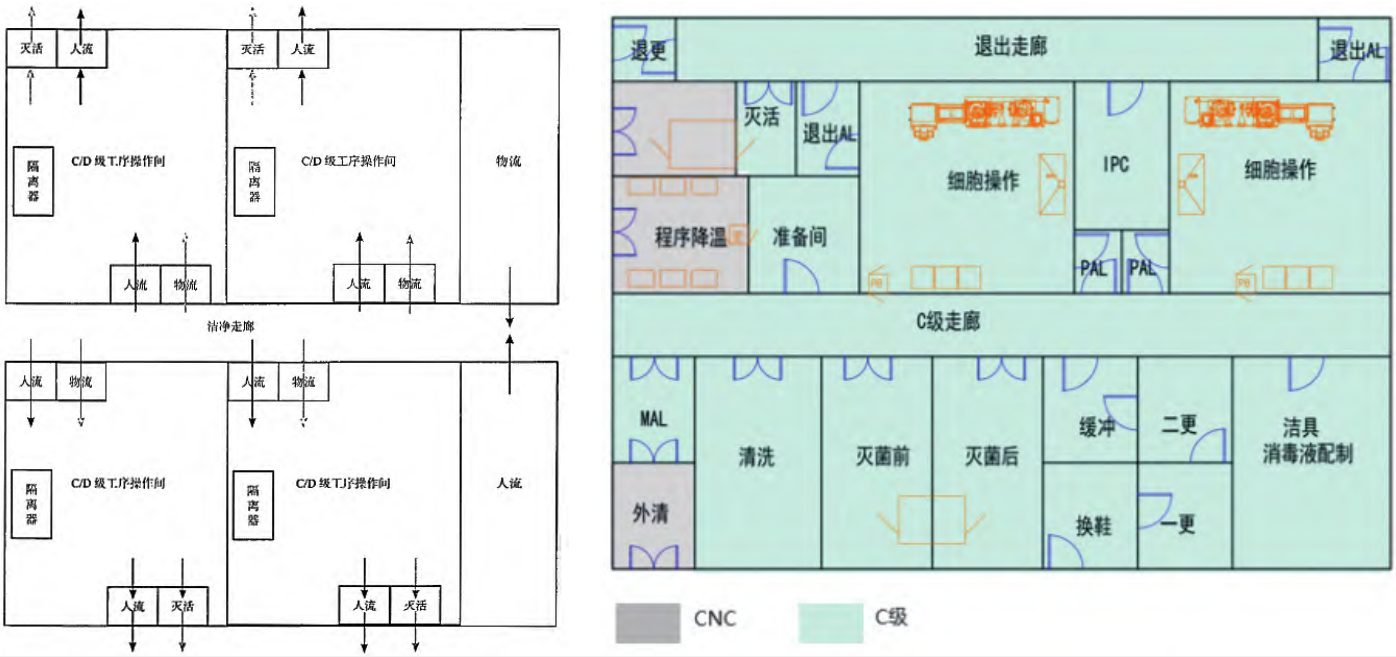
图 11 在密闭工艺条件下(如隔离器、密闭管路)的车间示意图[1]及实施案例
3.5 mRNA 生产
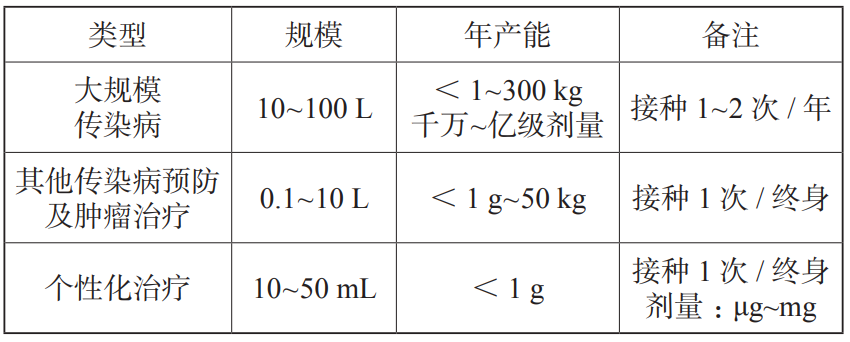
mRNA 生产线包含一个质粒生产线和一个mRNA 原液生产线,mRNA 原液生产核心操作间包含质粒线性化,体外转录与纯化,递送系统装载,无菌过滤浓缩,最后原液分装冻存,再运送至制剂灌装车间。结合以上工艺分析,mRNA 原液核心生产车间主要包括质粒线性化、体外转录、纯化超滤、递送系统装载(如 LNP 封装),同时考虑配套的人员、物料进出口以及配液、清洗等辅助间,如图 12所示。此外,如 mRNA 疫苗生产规模不大,一般小于 100 L,如表 2 所示,通常也可以采用类似实验室的大通间,体外转录与纯化在一个大空间下,这种方案具有不同工艺切换灵活、节省空间、节省空调系统等优点,但需要对上下游的交叉污染进行足够的风险评估。
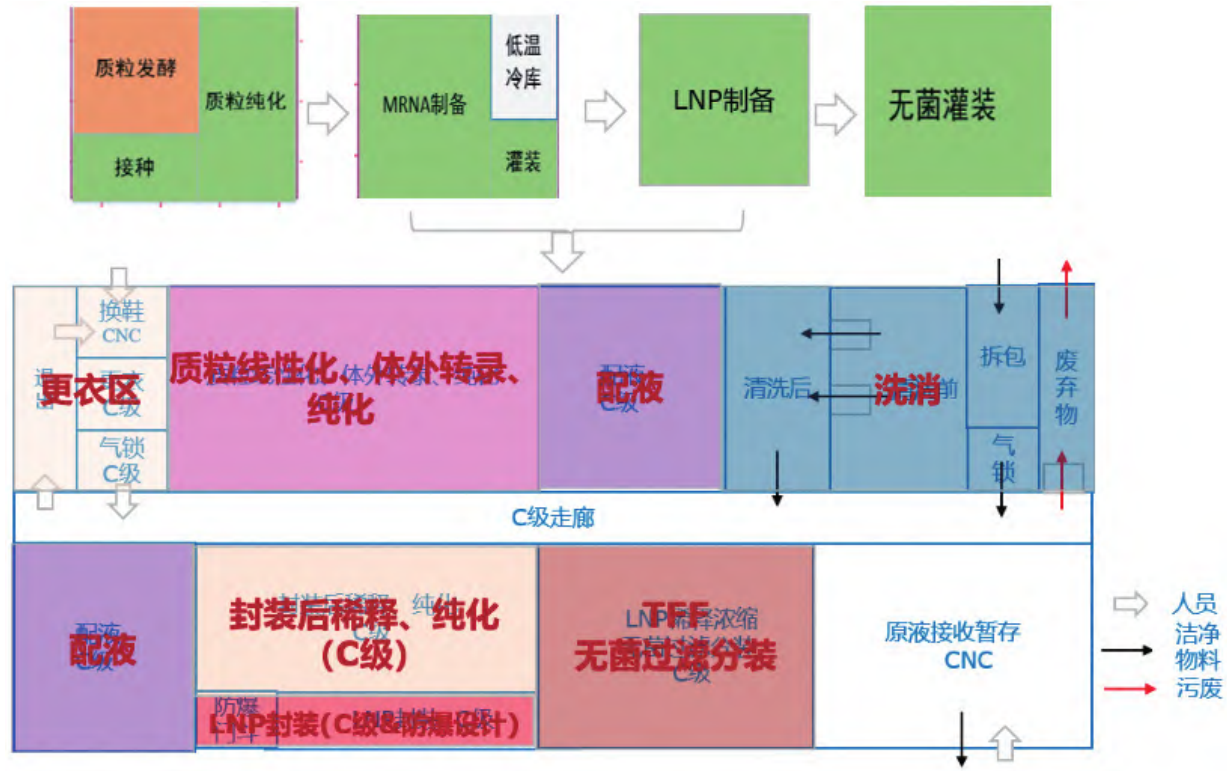
图 12 mRNA 原液核心生产车间平面布局示意图
表 2 不同类型 mRNA 疫苗产能分析
Part.04小结
综上,本文通过分析多种常见 CGT 产品生产工艺的不同要求,提出不同的工艺平面设计方案,重点探讨不同功能分区、人、物流线规划及主要工艺辅助配套设施的规划设计方案。值得一提的是,工艺平面规划设计前,需要开展一些重要的工艺设计工作,如用户需求的调研、详细的生产排班、物料衡算、设备选型计算等,限于篇幅,本文不作展开介绍,但此部分内容也是工艺设计过程非常重要的一部分工作,要满足客户定制化需求的工艺平面,前期的工艺设计工作不容忽视,本文仅提出几种 CGT 产品平面设计思路,供业内同行共同学习探讨。
参考文献
[1] 国家药品监督管理局食品药品审核查验中心组织 . 药品 GMP指南 [M]. 2 版 . 北京 :中国医药科技出版社,2023.
[2] 国家药监局核查中心 . 细胞治疗产品生产质量管理指南(试行)[Z]. 2022. 10. 31.
[3] ISPE Baseline Guide :Volume 6 - BiopharmaceuticalManufacturing Facilities(Second Edition)[S]. 2013. 11.
[4] 中华人民共和国卫生部 令 . 药品生产质量管理规范 -2010 年修订 [Z]. 2010. 10. 19.
邵丽竹
何发
相关推荐
-
创新赋能行业,聚力共赢未来
用创新赋能行业,以合作带来共赢。2023 年 12 月 11 日,2023(第十五届)弗戈制药工程国际论坛在江苏南京嘉悦 · 印湖酒店召开。本届论坛由机械工业信息研究院 PharmaTEC 制药业主办,围绕“创新赋能 聚力共赢”的主题,邀请了来自制药行业的相关领导、专家学者、行业翘楚齐聚南京,共同探讨制药企业多元化创新发展之路,为我国制药行业的高质量可持续发展集结智慧、贡献力量。
2024-03-05 许飞
-
New Vision、龙沙、Catalent、赛默飞世尔……全球“关厂潮”为什么是CDMO?
近日,CDMO 企业New Vision Pharmaceuticals宣布关闭位于美国佛罗里达州的无菌吹灌密封生产设施,88名员工失业。该公司表示,工厂将在裁员的同一天关闭,裁员将是“永久性的”。此次关闭于2024年2月9日生效。
2024-02-20
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略
















评论
加载更多