D级洁净区空调系统间歇式运行的可行性
目的:分析D级洁净区空调系统间歇式运行的可行性。方法:按照批准的方案对间歇式运行的洁净区各项指标进行监测。结果与结论:各项监测指标在合格范围内, D级洁净区空调系统间歇式运行可行。
GMP (Good Manufacturing Practice, 药品生产质量管理规范) 对药品生产不同等级的区域的表面微生物、沉降菌、浮游菌以及悬浮粒子等有着明确的规定
[1]
。为了保证生产区域的洁净等级合格, 在绝大多数药品生产企业都是保持空调系统24小时连续运行, 导致生产消耗大量的电能, 增加了巨大的成本, 在制剂行业, 空调系统的耗电成本占车间总耗电成本的55%~60%, 针对如此巨大的能耗, 本文讨论一下本人所在企业D级洁净区空调系统间歇式运行的可行性, 在保证生产环境合格的基础上降低能源消耗。
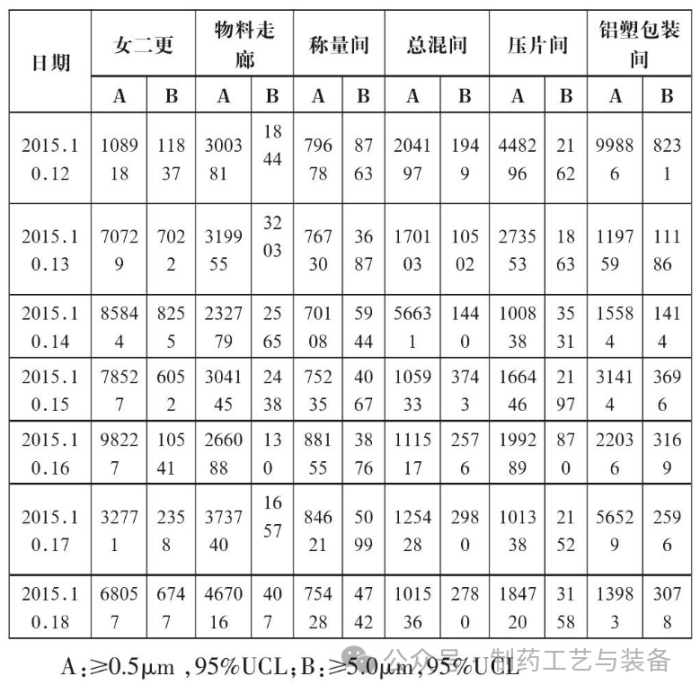
某口服固体生产线为D级洁净环境, 主要生产口服片剂、胶囊剂, 洁净区面积约900m2, 空调系统总送风量控制在56000m2/h左右, 温度控制在18~26℃, 相对湿度控制在30-65%, 不同等级的相邻房间压差控制在10Pa以上, 同等级的相邻房间压差控制在5Pa以上, 房间换气次数20以上。洁净区人流物流口均安装门禁装置, 非授权的生产人员无法进入。房间列表如下:
2.1空调系统停止运行后, 洁净区温度≤18℃, 相对湿度≤65%, 才能执行该方案。如果在夏季出现了高温、高湿的情况下, 容易滋生一些菌类, 该方案不能执行;
3.1在每天生产结束后 (17:00) 停止空调机组的运行, 停止冷冻水以及蒸汽供应, 最长停风时间为13h。
3.2在停用空调系统之前, 生产人员按照日常清洁的要求对洁净区进行清洁, 对车间存放的物料及中间产品采取必要的做好密封处理。设备内不存放物料, 检查设备所有开关、保证房间门紧闭, 对裸口使用的药用聚乙烯袋用尼龙扎带扎紧, 确保密封。由专人对上述操作进行检查复核, 检查完毕后通知空调岗位停止空调系统、冷冻水以及蒸汽的供应。空调系统停止运行期间, 禁止人员进入洁净区。
3.3第二天上午06:00开启空调系统并开启冷水及蒸汽的供应, 按照工艺要求将洁净区内温湿度调整至合格范围内, 自净2小时, 然后生产人员进入洁净区, 用75%乙醇对每个房间进行喷雾消毒, 设备表面采用75%乙醇清洁消毒。对环境进行连续7天的监测。监测期间确保每天的乙醇消毒操作, 监测项目主要有沉降菌、浮游菌、悬浮粒子以及表面菌。
3.4本方案的实施不改变原操作规程中对洁净区环境消毒的规定, 即:洁净区每6个月进行一次甲醛熏蒸消毒, 在环境消毒前需要进行一次环境监测, 以确认环境是否合格。
由QA人员进行连续7天静态的悬浮粒子测试、浮游菌测试、沉降菌测试和表面微生物测试
[2]
, 并记录数据。
取样点的数量通过房间面积的平方根并向上圆整至最相近的数值来决定, 而最小取样量则根据ISO14644-1的要求决定。确定好取样点数量和最小取样量后, 在距地面高度0.8~1.2米的取样点摆放悬浮粒子计数器, 同时确保在非层流区 (湍流区) 进行取样时悬浮粒子取样口垂直朝上, 在层流区进行取样时悬浮粒子取样口朝向气流方向
[3]
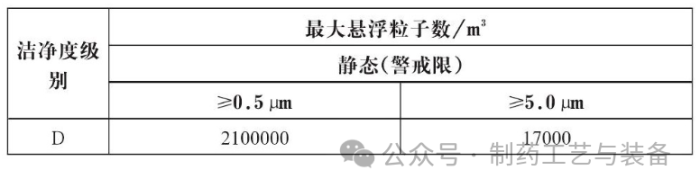
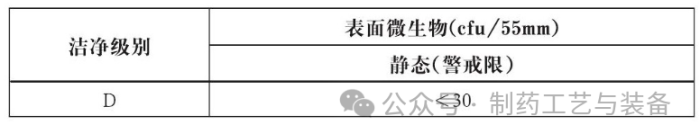
, 相关的数据做好原始记录。主要监测对象是0.5μm和5.0μm的悬浮粒子, 其可接受标准见下表:
系统在运行确认时确定了适宜的浮游菌取样点布局图, 由QA人员使用空气采样仪对各取样点进行样品采样, 取样时QA人员穿着符合要求的洁净服进行各房间的取样, 确保工作区采样点距地0.8~1.5m左右, 略高于工作面, 送风口监测点的取样点位置离开送风面30cm以上, 记录原始数据, 浮游菌平均菌落数 (个/m3) =菌落数/采样量
[4]
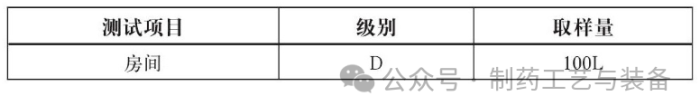
, 要求每个取样点的平均浓度低于内控标准, 若某个取样点的浮游菌平均浓度超过内控标准, 则需对取样点重新取样两次, 两次计算结果均低于内近期标准才算符合要求。样品取样量参量下表:
由两名以下的QC人员严格依照运行确认时确定的取样点布局图将准备好的培养皿布置好, 打开培养皿盖, 使培养皿表面暴露4小时后盖好盖子并倒置, 全部取完样后将培养皿倒置于30-35℃的培养箱中进行72小时的培养, 然后进行相应的菌落计数, 记录原始数据。取样量参照下表:
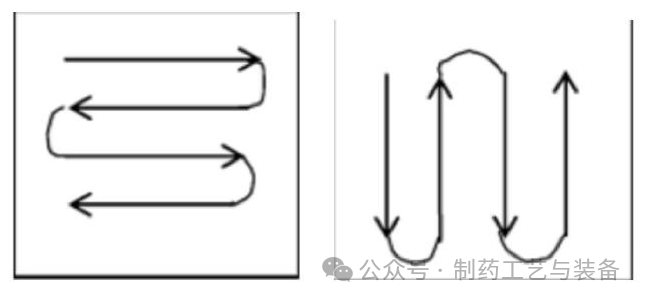
采用棉签法
[5]
对各取样点进行表面微生物取样, 选取的测试点为平整表面, 包括地板、墙面、门 (含门把手) , 天花板、房间中的设备表面、鞋柜以及水池附近的墙面。取样点位置一般距离地面0.8~1.5m并且避开回/排风口位置1m以上。棉签擦拭时将棉签按在物体表面上, 用力使其稍弯曲, 平稳而缓慢的擦拭取样物表面约25cm2, 擦拭过程覆盖取样面整个表面, 然后翻过棉签, 采用与之前擦拭方向垂直的方向进行擦拭, 如图所示:
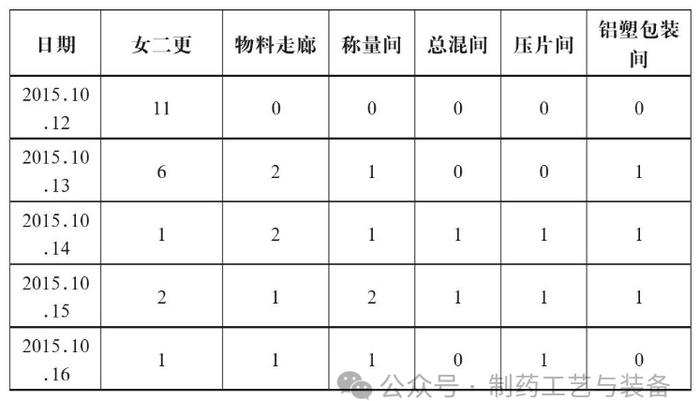
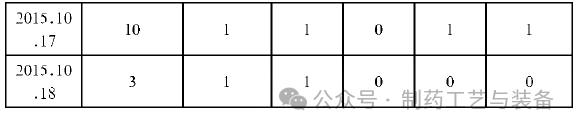
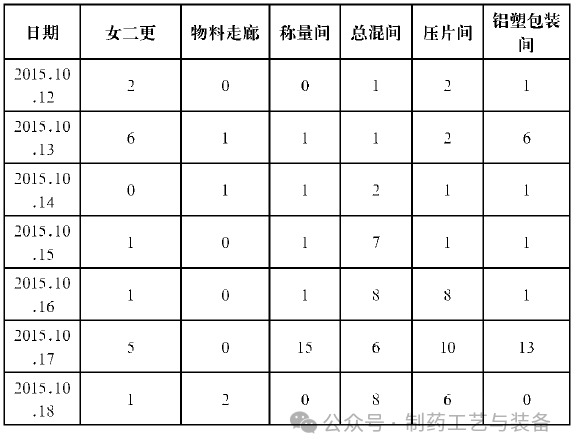
经过对口服固体生产线空调系统各关键房间进行取样监测, 期间的悬浮粒子、浮游菌、沉降菌、表面菌的检测结果均未超过公司内定的警戒限和纠偏限。故判断在洁净区温度≤18℃, 相对湿度≤65%, 且生产产品不易吸潮的情况下, 洁净级别为D级的口服固体制剂生产线按照规定的步骤对环境进行充分的清洁, 并对环境的风险进行充分的评估后, 空调系统可以间歇性运行, 为企业节省了很大一部分电耗开支。
[1]国家食品药品监督管理局药品认证管理中心.药品生产质量管理规范(2010年修订)[2011-02-14].www.ccd.org.cn
[2]国家食品药品监督管理局药品认证管理中心.药品GMP指南:质量管理体系[M].北京,中国医药科技出版社,2011:231-302
[3]国家食品药品监督管理局药品认证管理中心.药品GMP指南:厂房与设施[M]北京,中国医药科技出版社,2011:231-302
[4]王秀梅.浅谈新版GMP无菌药品生产环境监测[J].山东化工,2013,42(9):186-188.
撰稿人 | 张铁军、韩文涛 华北制药股份有限公司新制剂分厂、华北制药华胜有限公司
责任编辑 | 胡静
审核人 | 何发


















评论
加载更多