超级重磅首仿获批,正大天晴、诺华正面交锋!12个月市场独占,下一个会是谁?
1月3日,中生制药在港交所发布公告称,由旗下正大天晴申报的依维莫司片(商品名:晴维时)已获得国家药品监督管理局的上市批准,此次获批的六项适应症覆盖了乳腺癌、肾细胞癌、胰腺神经内分泌瘤等瘤种。

公开资料显示,依维莫司是由瑞士诺华制药原研的哺乳动物雷帕霉素靶蛋白(mTOR)的选择性抑制剂,曾一度跻身年销售额超20亿美元的“重磅炸弹”梯队。随着2020年依维莫司相关专利在美国等地区到期,该药销售额在仿制药的冲击下开始出现下滑,不过,作为国内市场的独家品种,其销量依旧呈现市场增长。
值得关注的是,这次批准不仅让正大天晴的依维莫司片成为国内首仿药物,其还将成为我国药品专利纠纷早期解决机制(亦称“药品专利链接制度”)实施以来,首个以“首仿获批+首个挑战专利成功”的身份获得12个月市场独占期的产品,将与诺华在国内市场上展开正面交锋。
市场观点认为,持续完善的药品知识产权保护制度是推动中国医药产业高质量发展的必由之路,也是我国实现从制药大国向制药强国跨越的重要举措。首个“市场独占期”药物出炉,意味着我国药品专利链接制度迎来又一里程碑,势必将鼓励更多仿制药企业发起专利挑战,从而促成更多仿制药尽快上市,进一步提升药物可及性。
三项专利被宣告无效
原研诉讼请求悉数驳回
现有研究表明,mTOR是致癌通路PI3K/AKT/mTOR信号通路的重要组成成分,在蛋白质合成、细胞运动、细胞增殖与存活、基因转录、自噬等不同的细胞基本过程中发挥重要作用。研究发现,mTOR信号通路失调与多种疾病密切相关,包括癌症、胰岛素抵抗、关节炎、骨质疏松症等。
在抗肿瘤机制上,依维莫司可以通过与胞内蛋白FKBP12结合形成抑制性的复合物,从而抑制mTOR激酶的活性,降低mTOR的下游效应物S6核糖体蛋白激酶(S6K1)和真核生物延伸因子4E-结合蛋白(4E-BP)的活性,从而干扰癌细胞的生长、分化和代谢,发挥抗肿瘤效应。
由于对多种恶性肿瘤展现出的确切治疗效果,依维莫司的临床价值得到了充分验证。2009年3月,诺华研发的依维莫司通过了美国FDA的快速审批,率先用于晚期肾癌患者的治疗。也就是在这一年,正大天晴开启了依维莫司的仿制药立项工作。
作为一种新的靶向治疗药物,依维莫司的工艺开发难度并不低。直到2018年11月,正大天晴才完成依维莫司片的生物等效性研究。
2021年6月,新修改的专利法正式实施,新增了药品专利纠纷早期解决程序等有关条款。随后,国家知识产权局与国家药品监督管理局联合发布《药品专利纠纷早期解决机制实施办法(试行)》,提出化学仿制药申请人提交药品上市许可申请时,应当对照已在中国上市药品专利信息登记平台公开的专利信息,针对被仿制药每一件相关的药品专利作出声明。
在新法背景下,2021年6月到8月,正大天晴先后对依维莫司片涉及的三件相关专利(ZL200680051365.0、ZL200780004302.4、ZL201310425110.8)提交无效宣告请求,并于2022年1月重新向CDE提交了依维莫司片仿制药上市请求,同时依据相关规定对上述三件专利作出4.1类声明,即中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效。
基于正大天晴提交的证据,2022年2月到3月,国家知识产权局作出裁定,宣告诺华上述三件专利权全部无效。但诺华并不接受这一结果,一纸诉讼将正大天晴告上法庭。

2022年4月,北京知识产权法院针对原告诺华就正大天晴申请的依维莫司片相关技术方案是否落入相关专利权保护范围之诉立案,案号为(2022)京73民初579号-581号。经过审理,2022年11月,北京知识产权法院裁定驳回原告诺华股份有限公司的起诉,裁驳理由均为相应专利权已被国家知识产权局宣告全部无效。
不过诺华也并未放弃,针对上述三件专利无效决定分别向北京知识产权法院提起专利行政诉讼,案号分别为(2022)京73行初10173号、(2022)京73行初16428号、(2022)京73行初16427号。2023年12月,在正大天晴收到依维莫司注册证的后一天,北京知识产权法院也针对上述三件专利行政诉讼出具了行政判决书,判决均驳回原告诺华的诉讼请求。
北京知识产权法院在相关的民事裁定书指出,药品专利纠纷早期解决机制设立的目的既在于保护药品专利权人的合法权益、降低仿制药上市后的专利侵权风险,亦在于保护仿制药企业的利益、保证符合要求的仿制药的审批程序不会受到不合理影响。在该案件中,专利权人或利害关系人在确认是否落入专利权保护范围案件中主张的权利要求被国家知识产权局宣告无效的,裁定驳回起诉的处理方式有利于平衡双方当事人的利益,也符合药品专利纠纷早期解决机制的制度定位。
“双雄格局”加速形成
谁将成为下一个竞争者?
事实上,依维莫司上述三件专利此前并没有无效挑战决定的记录,这也让诺华一直处于绝对优势的位置。随着正大天晴的依维莫司片首仿药上市,诺华这一拳头品种毋庸置疑将在国内市场迎来强劲的竞争对手。
在全球范围内,诺华的依维莫司自2009年上市以来,随着癌症治疗、器官移植这两大领域的适应症不断增加,其销售额也在持续走高。米内网数据显示,诺华的依维莫司全球销售额在2018年、2019年均超过20亿美元,随后在仿制药的蚕食下市场逐渐下滑,2022年全球销售额仅为8.41亿美元。
而在中国三大终端六大市场上,从2020年至2022年,诺华的依维莫司销售额均超过1亿元。不过经此一役,依维莫司的市场格局将遭到正大天晴的改写。
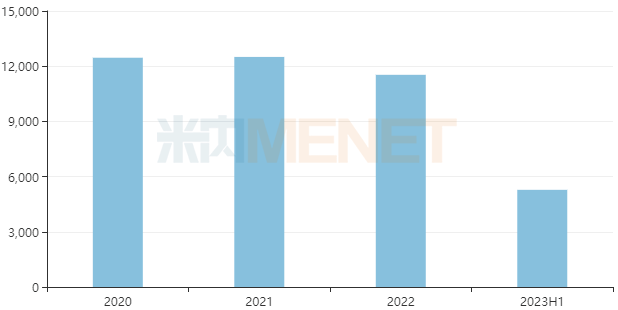
来源:米内网格局数据库
值得一提的是,作为挑战专利成功的产品,正大天晴的依维莫司还享有一定的“特权”。《药品专利纠纷早期解决机制实施办法(试行)》在明晰仿制药企业发起专利挑战相关解决程序的同时,也明确提出对首个挑战专利成功并首个获批上市的化学仿制药,给予市场独占期。
根据上述制度,国务院药品监督管理部门在该药品获批之日起12个月内不再批准同品种仿制药上市,共同挑战专利成功的除外。市场独占期限不超过被挑战药品的原专利权期限。市场独占期内国家药品审评机构不停止技术审评。对技术审评通过的化学仿制药注册申请,待市场独占期到期前将相关化学仿制药注册申请转入行政审批环节。
这意味着,其他企业提交的依维莫司片仿制药注册申请不得不排队等待。米内网数据显示,针对依维莫司片,近年来国内已有7家企业提交该品种仿制注册申请,除了正大天晴外,还包括奥赛康、上海医药、海正药业、华东医药、山东新时代药业、迪康倍等。
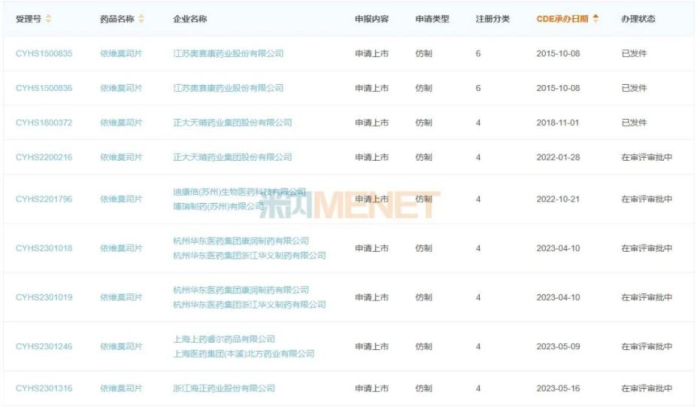
从2015年起,国内药企纷纷开始挑战诺华这一重磅品种,奥赛康是首家提交依维莫司片的企业,不过其6类仿制上市申请并未获批。而正大天晴挑战专利成功,也为后来者扫清了障碍。在国家知识产权局作出诺华上述三件专利权全部无效的裁定,迪康倍在提交依维莫司片仿制药上市请求时随即作了2类声明,即中国上市药品专利信息登记平台收录的被仿制药相关专利权已终止或者被宣告无效。
有数据显示,自我国药品专利链接制度实施以来,截至2023年7月,仿制厂家已经在中国专利登记平台发布了超过200个4类声明,涉及80多个品种。中外制药株式会社与温州海鹤药业的中国首例药品专利链接诉讼案,还入选最高人民法院知识产权法庭典型案例(2022)。
当前,我国医药产业处在加速转型升级的过程中,仿制药仍是我国药品市场的主力军,在药品供应保障体系中扮演着重要角色。随着我国药品相关专利制度愈加完善,本土药企发起针对跨国制药巨头专利无效的剧情注定将轮番上演,在政策激励之下,争抢“首仿”将成为国内头部药企在转型阶段与创新并重的抓手。
撰稿人 | 医药经济报
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多