AAV 空/完整衣壳表征和定量的高级分析方法
腺相关病毒 (AAV) 是一种新兴的基因治疗载体。AAV 将治疗性 DNA 有效载荷包装在病毒衣壳内。这种 DNA 有效载荷限制为约 5 kb 的 DNA,可用于基因编辑、基因沉默或基因替换。一旦 AAV 到达靶细胞,AAV 就会被内化并运输到细胞核,在那里,递送 DNA 有效载荷,并表达治疗产物。
使用 AAV 进行基因治疗有很多优势。AAV 通常被认为是安全的,可以直接输送到患者体内,并且可以靶向不同的组织并穿过血脑屏障。还可以对衣壳进行改造,以提高组织特异性、效力和安全性。因此,许多基于 AAV 的基因疗法正在开发中,其中一些已获得全球监管机构的批准。
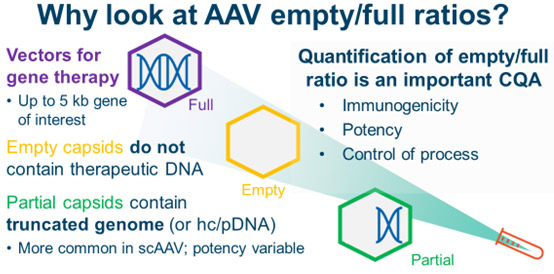
空/完整衣壳比是 CMC 的一个重要考虑因素。一个控制良好的工艺将产生在批次间具有可比性的空衣壳、部分衣壳和完整衣壳比例。因此,用于量化 AAV 的空/完整比的适当方法是重要的分析工具。然而,有许多技术可以做到这一点,选择最合适的技术可能是一个挑战。在这里,将介绍 10 种不同的技术,并评估它们的分析强度、易用性以及在 GMP 环境中实施的能力。
AAV 空/完整衣壳比是一个重要的质量属性
包含所需 DNA 产物的 AAV 被认为是完整的衣壳。然而,除了完整的 AAV 之外,最终制剂中还可以存在其它衣壳类型。空衣壳不包含目的 DNA。它们可能真的是空的,或者它们可能包含小块 DNA,如 AAV ITR 或宿主细胞 DNA 或质粒 DNA 的片段。部分衣壳可能包含完整 AAV 基因组的片段。与单链 AAV 基因组相比,部分衣壳在具有自我互补 AAV 基因组的项目中更为普遍。
完整的 AAV 是最有效的:它们包含所需的 DNA 产物。没有治疗用 DNA 的空衣壳对产品的效力没有任何贡献。相反,它们可能通过递送 DNA 的免疫原性片段以及增强患者对 AAV 衣壳的免疫系统反应来促进免疫原性。根据包装的 DNA,部分衣壳具有不同的效力。如果包装的基因组恰好编码功能性蛋白质,则部分衣壳可能会对效力产生积极影响。因此,除了提高整体衣壳产量外,工艺开发小组还需尝试优化完整衣壳的百分比。
AAV 空/完整测定方法
表征和量化 AAV 空/完整比有四种主要方法:
单独测量 DNA 滴度和衣壳滴度
基于空衣壳和完整衣壳之间电荷差异的分离
基于质量和大小的分离
成像技术
DNA 和衣壳的测量
ddPCR 和 ELISA
使用 ddPCR 和 ELISA 测量空/完整衣壳比的原理很简单:ddPCR 测量 DNA 浓度(载体基因组数/mL),ELISA 测量蛋白质浓度(衣壳数/mL),以及计算DNA – 衣壳比值(载体基因组数量/衣壳数量),以给出完整和空衣壳的数量。
虽然这种方法易于执行且不需要任何专门设备,但它有其缺点。ddPCR 无法量化部分衣壳。根据引物设计和部分基因组的序列,引物要么识别部分基因组,导致高估完整衣壳的数量,要么引物无法识别部分基因组并高估空衣壳的数量。ELISA 取决于抗体的准确性和可用性。抗体可以识别衣壳片段,并且可能存在批次间差异。较差的校准曲线可能会影响计算的衣壳滴度。最后,由于使用 ddPCR 和 ELISA 来衡量空/完整比涉及结合两种独立技术的结果,因此报告的结果涉及两种错误来源的混合,这可能导致高分析可变性。
UV-Vis
UV-Vis光谱法采用 DNA 基因组和蛋白质衣壳的摩尔吸收系数,并计算样品中存在多少 DNA 和蛋白质。可以使用软件计算载体基因组的数量和衣壳的数量,并且像ddPCR和ELISA一样,测量空衣壳和完整衣壳的比例。因为部分衣壳没有与空衣壳和完整衣壳分开,来自部分衣壳的信号被分配给空衣壳和完整衣壳。
因为没有分离衣壳,DNA 和蛋白质杂质都会影响UV-Vis读数。根据我们的经验,UV-Vis 对于非常纯的样品最为准确。然而,根据我们的经验,即使是最纯净的样品,UV-Vis通常也会大大高估空衣壳的数量。UV-Vis 可能是一种有用的方法,适用于试图获得快速(但不一定准确)滴度值的分析团队。
尺寸排阻色谱法 - 多角度光散射 (SEC-MALS)
SEC-MALS 将尺寸排阻色谱(将单体 AAV 与二聚体、聚体和其它杂质分离)与一套分析检测器(如光散射、紫外检测和示差折光检测器)相结合。这些检测器一起可以报告溶液中 AAV 的大小、衣壳滴度和基因组滴度。但是,由于空衣壳、部分衣壳和完整衣壳作为一个单体峰一起洗脱,SEC-MALS 会将来自部分衣壳的信号分配到空衣壳和完整衣壳之间,类似于 UV-Vis。
根据我们的经验,SEC-MALS 是一种强大的分析技术,具有合理的线性度并且可重现。就其弱点而言,我们已经看到 SEC-MALS 偶尔会高估空衣壳的数量。它的软件使用起来也可能有点棘手。由于 SEC-MALS 无法区分部分衣壳,因此它可能更适合部分衣壳较少的 AAV 项目。
基于电荷的分离
完整衣壳比空衣壳具有更低的 pI(负电荷更多,酸性更强)。这种差异允许基于 pI 的分离。根据我们的经验,部分衣壳和完整衣壳具有相似的 pI,这使得这两个物种的分离具有挑战性。基于电荷的分离因翻译后修饰而变得复杂,这可能会影响表面电荷。这些分离也依赖于血清型,这意味着基于一个项目建立的方法可能不容易转化至另一种项目。
阴离子交换层析 (AEX)
在 AEX 中,与较早洗脱的空衣壳相比,带更多负电荷的完整和部分衣壳在柱上的保留时间更长。在一个好的 AEX 方法中,空衣壳和完整衣壳通过基线分辨率相互分离。作为一种基于柱层析的方法,AEX 易于执行、稳健且准确。
然而,建立 AEX 方法可能具有挑战性,因为层析柱、盐类型、浓度和缓冲液 pH 值的选择都会影响分离质量。此外,某些血清型通过 AEX 进行分析更具挑战性。
毛细管等电聚焦 (cIEF)
cIEF 根据 pI 沿 pH 梯度分离空衣壳和完整衣壳。使用良好的 cIEF 方法,空衣壳和完整衣壳将充分分离,从而可以进行量化。cIEF 需要高纯度样品,因为杂质峰可能不容易与蛋白质信号区分开来。虽然 cIEF 可以提供有关样品内电荷异质性的高分辨率信息,但充分分离空衣壳和完整衣壳可能具有挑战性。翻译后修饰会导致峰相互融合,从而使该分析进一步复杂化。
质量和尺寸分离
沉降速度 - 分析型超速离心 (SV-AUC)
SV-AUC 是一种离心形式,其中 AAV 基于它们的 Svedberg 系数分离,Svedberg 系数是粒子质量、大小和形状的度量。从广义上讲,空衣壳的 Svedberg 系数低于完整衣壳。除了提供空衣壳和完整衣壳的高分辨率分离外,SV-AUC 还可以分离部分衣壳。
然而,SV-AUC 在 GMP 环境中的实施具有挑战性。它需要大量的手动操作,数据分析也很耗时。尽管如此,由于能够准确分离和量化空衣壳、部分衣壳和完整衣壳,SV-AUC 是许多 AAV 项目的黄金标准。
电荷检测质谱 (CDMS)
CDMS 是一种新兴的质谱分析形式,可同时测定完整衣壳的质荷比 (m/z) 和电荷 (z)。将这两个值相乘可以确定完整的衣壳质量 m。对于 5.1 MDa 完整衣壳,典型的 m/z 值是 30,000 和 +170(30,000 m/z * 170 z = 5,100,000 Da)。根据我们的经验,CDMS 和 AUC 结果非常接近,这意味着 CDMS 可能是分析实验室中 AUC 的合适替代品。
原子力显微镜 (AFM)
AFM 可探测沉积在成像表面上的 AAV 的物理化学特性。空衣壳更“柔软”,看起来比完整衣壳小。也可以观察到疏水性和表面电荷的差异。然而,由于空衣壳和完整衣壳的特征可能重叠或差异可能很细微,AFM 可能更适合作为表征方法而不是空/完整确定方法。
成像技术
低温透射电子显微镜 (cryoTEM)
CryoTEM 是一种测量 AAV 衣壳内电子密度的成像技术。由于 DNA 的存在,完整衣壳在其内部具有高电子密度(高对比度),而空衣壳几乎没有对比度。CryoTEM 还可以尝试将具有中等对比度的衣壳量化为部分衣壳,但需要一个好的算法来确定什么是低(空)、中(部分)或高(完整)对比度衣壳。我们还观察到 cryoTEM 可能高估了我们样品中空衣壳的数量。
质量光度法
质谱光度法是一种成像技术,它观察 AAV 落在显微镜载玻片上时散射的光量(或对比度增加)。完整的 AAV 将在显微镜载玻片上显示为比空 AAV 更暗的点(具有更大的对比度)。通过测量着陆在显微镜载玻片上的 AAV 数量和着陆事件的对比度或强度,可以确定空/完整比。
质量光度法的一个优点是它是一种快速技术(每个样品大约五分钟)并且易于执行。作为一种单分子技术,它提供了关于样品异质性的非常详细的信息。然而,虽然质量光度法可以区分部分衣壳,但分辨率不是很好,这意味着部分衣壳和完整衣壳的分布可能会相互渗透。我们对该仪器的初步结果表明,质谱光度法会将部分衣壳错误分配为完整衣壳。
选择空/完整分析方法
选择空/完整量化方法高度依赖于研究背景。在 GMP 环境中,没有任何一种技术是准确、快速、易于使用和易于实施的。如果部分衣壳是原料药的重要部分,则 SV-AUC、CDMS 和质谱光度法是最合理的方法。虽然 CDMS 可能是最容易执行的,但 SV-AUC 具有可以在 GMP 环境中实施的优势。由于质量光度测定快速且易于执行,因此它可能对工艺开发团队筛选各种工艺很有用。
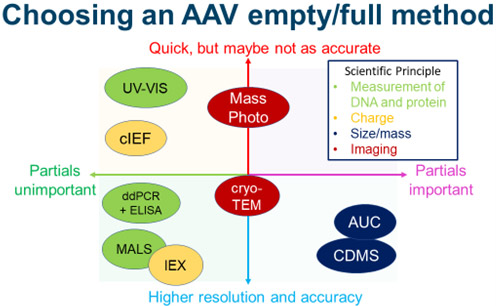
如果不关心部分衣壳,那么基于柱层析的方法应该是强有力的候选者。如果血清型适用于离子交换层析,则阴离子交换层析是一种准确且符合 GMP 的技术。SEC-MALS 也是一个合理的选择,但必须注意确保方法准确。
Cryo-TEM 主要作为一种中等技术,因为它区分部分衣壳的能力值得怀疑,而且准确性一般。UV-Vis 可能对有兴趣快速估计空/完整衣壳比的工艺团队有用。除非可以充分分离空颗粒和完整颗粒,否则 cIEF 和 AFM 可能更适合作为表征技术,而不是绝对量化方法。最后,必要时,可以使用 ddPCR 和 ELISA,但必须彻底验证这些方法,以确保结果准确。
原文:J.Ong, Advanced Analytical Approaches For AAV Empty/Full Capsid Characterization And Quantification. Bioprocess Online, 2023.
撰稿人 | 生物工艺与技术
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多