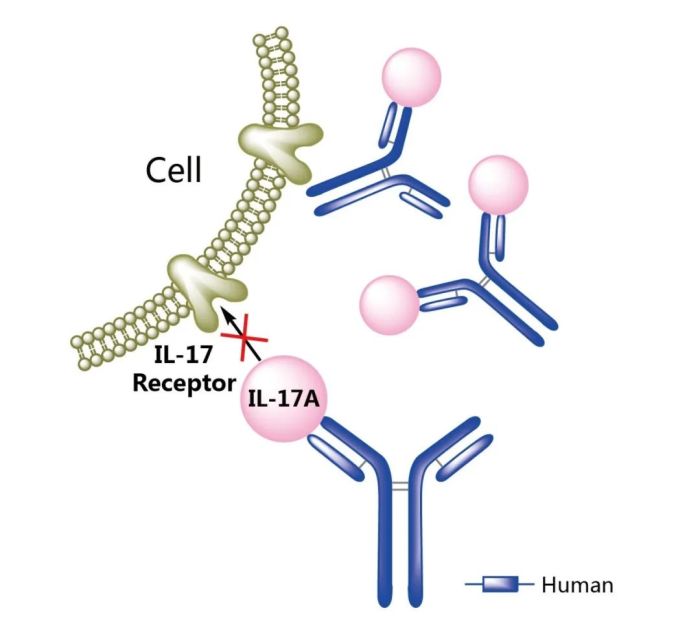
图1. Cosentyx作用机制示意图,来源:药渡数据
Cosentyx(secukinumab,司库奇尤单抗)是第一个也是唯一一个特异性靶向和阻断白细胞介素-17A(IL-17A)的全人类生物制剂。此前,已批准治疗银屑病关节炎、中度至重度斑块状银屑病、强直性脊柱炎和非影像学中轴型脊柱关节炎。
2023年10月6日,FDA批准Cosentyx用于治疗成人中度至重度化脓性汗腺炎(HS),批准的剂量为300mg。此次批准是基于临床三期项目SUNSHINE和SUNRISE的分析,其中每两周或每四周服用Cosentyx 300mg的患者,化脓性汗腺炎临床反应(HisCR50)缓解的比例高于安慰剂。
VELSIPITY(etrasimod,伊曲莫德)是一种每日一次的口服鞘氨醇1-磷酸(S1P) 受体调节剂,可选择性地与S1P受体亚型1、4和5结合。
2023年10月12日FDA批准用于治疗成人中度至重度活动性溃疡性结肠炎(UC)。VELSIPITY的批准推荐剂量为2毫克。FDA的批准是基于ELEVATE UC的3期临床的结果,该项目评估了VELSIPITY 2mg每日一次剂量,对既往至少一种常规生物制剂或Janus激酶(JAK)抑制剂治疗失败或不耐受的UC患者临床缓解的安全性和有效性。研究均达到所有主要和关键的次要疗效终点,表明其良好的安全性与有效性。
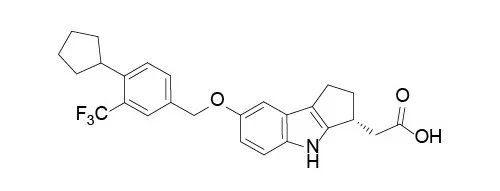
图3
.
Xphozah结构式,
来源:
药渡数据
2023年10月17日,美国FDA批准Xphozah(tenapanor)用于降低患有慢性肾脏病(CKD)成人透析患者的血清磷水平,作为对磷酸盐结合剂应答不足或对任何剂量的磷酸盐结合剂治疗不耐受的患者的附加治疗。磷含量高的慢性肾脏病患者传统上使用磷酸盐结合剂进行治疗。这种结合剂可以在消化过程中从食物中吸收磷,使用剂量较大。Xphozah是第一个也是目前唯一一个磷酸盐吸收抑制剂,它是一种单片剂,每天服用两次。
Xphozah的批准基于三项3期临床试验,分别为TEN-02-201[NCT02675998]、TEN-02-301[NCT03427125]和TEN-02-202[NCT03824587]。这些试验的重点是评估Xphozah降低透析成人慢性肾脏病患者血清磷的安全性和有效性,所有试验都成功达到了主要和关键的次要终点。此前,tenapanor已于2019年获得FDA批准用于治疗成人便秘型肠易激综合征,商品名为Ibsrela。
2023年10月17日,FDA批准Maxgesic
®
IV,用于缓解轻度至中度疼痛,并作为成人阿片类止痛药的辅助药物,用于治疗中度至重度疼痛。Maxigestic®IV是1000mg扑热息痛和300mg布洛芬溶液的独特组合,用于术后输液。将以Combogesic®IV的商品名在美国上市。
此次批准是基于III期临床阶段项目的积极数据,在该项目中,Maxgesic®IV证明与对乙酰氨基酚IV、布洛芬IV以及安慰剂相比,它具有良好的耐受性,起效更快,疼痛缓解率更高。Maxigestic®IV的卓越镇痛效果,也得到了包括阿片类药物使用率的降低等一系列次要终点的支持。
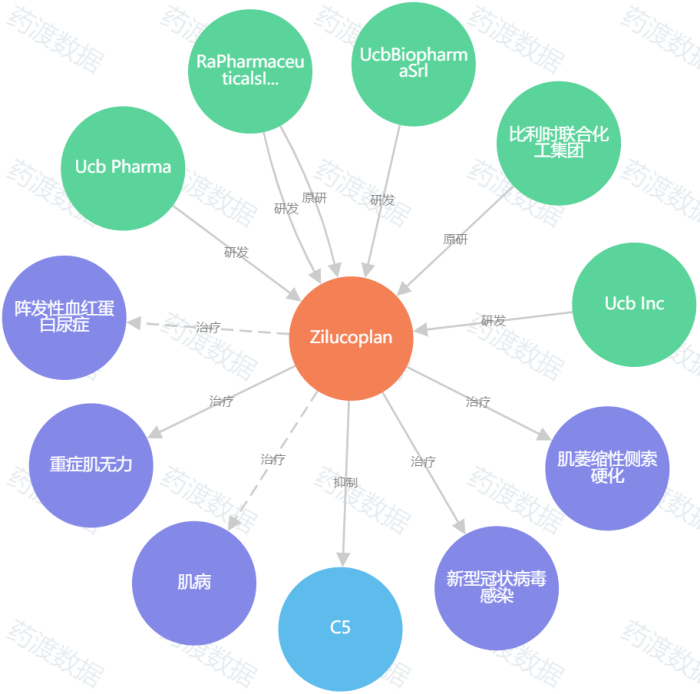
图4
.
zilucoplan知识图谱,
来源:
药渡数据
2023年10月17日, FDA批准zilucoplan(商品名:Zilbrysq)的新药上市申请,用于治疗乙酰胆碱受体(AChR)抗体阳性的全身型重症肌无力(gMG)成年患者。该药是首款获FDA批准用于gMG的补体C5抑制剂,每日自行皮下给药一次。zilucoplan的双重作用机制,可阻止末端补体途径的激活以及膜攻击复合物(MAC)的下游组装和活性,从而阻止其损坏突触后膜,破坏离子通道传导和损害神经肌肉信号传递。
此次获批主要基于一项随机双盲、安慰剂对照的多中心III期RAISE研究结果。与安慰剂相比,第12周时zilucoplan组患者重症肌无力-日常生活活动能力量表(MG-ADL)总评分较基线有统计学意义上的改善;zilucoplan组的重症肌无力定量评分(QMG)、重症肌无力复合评分(MGC)和改良的15项重症肌无力生活质量(MG-QoL15r)评分较基线均有显著改善。
-
生产厂家:
ORASIS PHARMACEUTICALS, LTD
-
2023年10月17日,美国FDA批准Qlosi(0.4%盐酸毛果芸香碱滴眼液)上市,用于治疗成人老花眼。Qlosi是一种不含防腐剂的低剂量毛果芸香碱和多面载体构成的滴眼液。主要作用机制是收缩瞳孔,从而增强景深,改善近视力和中距视力。Qlosi可每日使用,或根据需要使用,每日最多两次。
此次批准是基于III期临床试验NEAR-1和NEAR-2的结果。两项试验均在第8天达到其主要和关键次要终点,显著提高了视力表多读三行的患者比例。接受第一剂治疗后一小时内40%的患者多读三行,这一比例在接受第二剂治疗后达到50%。受试者最早在接受治疗20分钟后,就可获得视力改善,并且疗效可持续长达8个小时。
2023年10月17日, FDA批准BIMZELX®(bimekizumab-bkzx)用于治疗中度至重度斑块性银屑病的成人患者。Bimekizumab是首个也是唯一一个被批准用于治疗成人中重度斑块型银屑病的IL-17A和IL-17F抑制剂,作用机制为选择性抑制驱动炎症过程的关键细胞因子——白细胞介素17A (IL-17A)和白细胞介素17F (IL-17F)。
Bimekizumab的批准得到了三个III期、多中心、随机、安慰剂和/或活性对照试验的数据支持,这些试验评估了bimekizumab在1480名中度至重度斑块性银屑病成人患者中的疗效和安全性。在第16周,85%-91%接受BIMZELX治疗的患者获得了清晰或几乎清晰的皮肤,59-68%达到了完全清除的目标。
-
生产厂家:
ZYDUS WORLDWIDE DMCC
-
2023年10月18日,FDA批准Zituvio(sitagliptin)上市,作为饮食和运动的辅助药物,以改善成人2型糖尿病的血糖控制。Zituvio含有活性成分sitagliptin,一种二肽基肽酶-4(DPP-4)抑制剂。肠促生长素,包括胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP),全天由肠道释放,并且水平会随着用餐而升高。sitagliptin通过减缓肠促生长素的失活,而在2型糖尿病患者中发挥作用。sitagliptin于2006年首次以Januvia(磷酸西格列汀)的商品名获得批准。Zituvio为含有游离碱形式的sitagliptin。
-
生产厂家:
BAUSCH HEALTH US, LLC
-
2023年10月20日,FDA批准Cabtreo(磷酸克林霉素、阿达帕林和过氧化苯甲酰)外用凝胶1.2%/0.15%/3.1%的新药申请,适用于十二岁及以上寻常痤疮患者的局部治疗。该药结合抗生素、类维生素A和抗菌剂三种作用机制,旨在治疗与中度至重度痤疮相关的炎症、细菌和毛囊角化过度。是首个也是当前唯一一个经FDA批准的固定剂量、三联组合的痤疮局部治疗药物。
两项多中心、随机、双盲III期临床试验(试验1和试验2,分别为NCT04214639和2NCT04214652)评估表明,在试验1中,接受Cabtreo治疗的患者获得皮肤症状清除或几乎清除的比例(49.6%),显著高于接受赋形剂凝胶治疗的患者(24.9%)。在试验2中,接受Cabtreo治疗成功的患者(50.5%)相对于赋形剂凝胶组(20.5%),具有与试验1一致的显著治疗成功率。
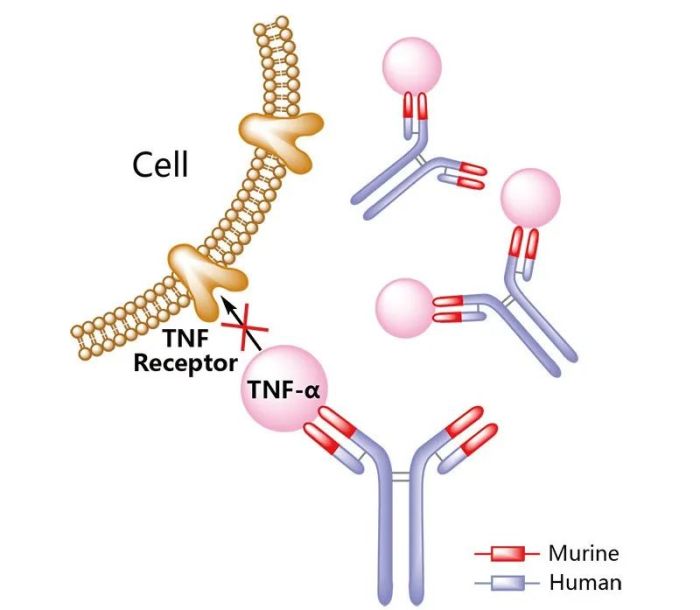
图5.
Zymfentra作用机制示意图,来源:药渡数据
Infliximab是一种抗肿瘤坏死因子α(tumor necrosis factor alpha,TNFα)的单克隆抗体。2023年10月20日,FDA批准Zymfentra(infliximab)用于中重度活动性溃疡性结肠炎(UC)和克罗恩病(CD)成人患者,在接受静脉给予infliximab单抗治疗后的维持治疗。Zymfentra是获FDA批准用以治疗炎症性肠病(IBD)的首个infliximab皮下制剂,可提供血清中稳定升高的infliximab单抗水平。
一项随机、安慰剂对照、双盲、III期研究LIBERTY-UC表明第54周时,ZYMFENTRA的临床缓解率 (43.2%) 显著高于安慰剂 (20.8%)。一项随机、安慰剂对照、双盲III期研究LIBERTY-CD表明第54周时,ZYMFENTRA组的临床缓解率高于安慰剂组(分别为62.3%和32.1%,P<0.0001)。与此同时,ZYMFENTRA组在第54周时的内镜缓解率也高于安慰剂组(分别为51.1%和17.9%,P<0.0001)。ZYMFENTRA和安慰剂组在维持阶段的安全性总体上相当。
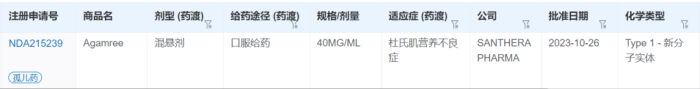
2023年10月26日,FDA批准Agamree(vamorolone)上市,用于治疗2岁及以上患者的杜氏肌营养不良症(DMD)。Agamree以40mg/mL口服混悬液形式提供,通过糖皮质激素受体发挥抗炎和免疫抑制作用。此次批准基于随机、双盲、安慰剂和活性对照的2b期VISION-DMD研究(NCT03439670)的数据,该研究评估了vamorolone对4岁至7岁DMD患儿的疗效和安全性。服用vamorolone 6mg/kg/天的治疗达到了主要终点,在24周时从基线到站立测试(TTSTAND)速度的变化优于安慰剂。此外,在多个次要终点方面优于安慰剂,包括站立速度、6分钟步行测试及10米跑/走时间。
2023年10月26日,IL-23p19单抗Mirikizumab(商品名:Omvoh)获得FDA批准,用于治疗成人中至重度溃疡性结肠炎(UC)。该药品为首个获批用于治疗UC的IL-23抗体。Mirikizumab是一种人源化IgG4单克隆抗体,能够特异性地与IL-23的p19亚基结合,从而阻断IL-23介导的炎症反应而不影响IL-12介导的免疫反应。IL-23是一种参与炎症过程的细胞因子,被认为与多种慢性免疫介导的疾病相关。
FDA的批准是基于两项随机双盲、安慰剂对照的临床III期试验。一项是为期12周的诱导治疗研究(UC-1),另一项是为期40周的维持治疗研究(UC-2)。试验结果显示,Omvoh治疗12周后,65%的患者获得临床应答,24%的患者获得临床缓解,而安慰剂组的临床应答和临床缓解率分别为43%和15%。在12周达到临床缓解的患者中,66%的患者在连续治疗1年期间维持临床缓解,而安慰剂组则为40%。安全性方面,与安慰剂组(UC-1为7.2%,UC-2为8.3%)相比,使用Omvoh的患者因不良事件停止治疗的可能性较小(UC-1和UC-2分别为1.6%和1.5%)。
2023年10月27日,FDA批准山德斯公司提交卡巴他赛注射液505 (b)(2)申请,此次获批基于FDA对上市药物JEVTANA(卡巴他赛)注射液60mg/1.5mL(NDA#201023;赛诺菲-安万特)的安全性和有效性的调查结果。JEVTANA于2010年6月17日获批,作为一种两瓶制剂,用于治疗激素难治性转移性前列腺癌患者。山德士提交的卡巴他赛注射液的活性成分、给药途径和剂型与JEVTANA相同。山德士制剂的规格为10mg/mL,有4.5mg/4.5mL小瓶和60mg/6ml小瓶两种包装。给药前,用0.9%氯化钠溶液或5%葡萄糖溶液稀释后输注。含有一瓶13%乙醇的稀释剂,给药前需要进行两步稀释,与JEVTANA不同,山德士产品不需要两步稀释。
此外,山德士产品的辅料含量不同,乙醇浓度增加到19.8%,并且含有聚乙二醇300 (PEG 300),而JEVTANA不含PEG。由于该药品依赖于Jevtana的安全性和有效性,因此,没有提交新的临床信息。
14
-
生产厂家:
COHERUS BIOSCIENCES INC
-
2023年10月27日,君实生物海外合作方Coherus Biosciences宣布,PD-1单抗特瑞普利单抗LOQTORZI™ (toripalimab-tpzi) 已获FDA批准,联用顺铂/吉西他滨一线治疗晚期复发或转移性鼻咽癌(NPC);作为单药疗法,用于铂类化疗后进展的不可切除或转移性鼻咽癌(NPC)NPC。这是国产PD-1在美国斩获的首个上市批准,具有里程碑意义。相关文章传送门:
为什么又是君实生物取得了突破?
此前,美国地区尚无其他PD-1单抗获批鼻咽癌适应症。此次获批基于JUPITER-02(一项随机、双盲、安慰剂对照、国际多中心III期临床研究)及POLARIS-02(一项多中心、开放标签、II期关键注册临床研究)的研究结果。相较于对照组,特瑞普利单抗+化疗显著延长mPFS 13.2 个月,提升了近3倍,疾病进展或死亡风险降低 48%。3 年OS率较对照组提升了15.3%,死亡风险降低37%,具有显著的统计学差异。
撰稿人 | 幻目 药渡
责任编辑 | 胡静
审核人 | 何发
















评论
加载更多