超预期而提前终止临床的“超效药”
临床试验中需要坚持的前提之一是临床均势。临床均衡的概念最早是由弗里德曼于1987年提出,指在临床研究过程中应保持均衡,如果均衡被扰乱,应终止研究,并为患者提供更好的治疗。
临床试验因临床均势被打破而提前终止大部分都是不好的消息,比如招募不到足够的患者、效果不明显、安全性差等。试验效果非常好而提前终止的情况则相对罕见,当然这也是大家都希望看到的结果。
临床试验会委托独立的数据监察委员会对试验的数据进行实时分析,当数据足够给出结论时,试验可以提前终止,以保护试验参与者的利益。这是因为继续进行试验将违反临床均势,对新加入试验或继续参与试验的患者来说,被分配到疗效较低的治疗组将面临不公平的待遇。
提前终止临床实验对药物研发和患者治疗都有重要的影响。首先,提前终止可以加快药物的上市进程,使药物更早地可供患者使用。这对于那些没有其他有效治疗选择的患者来说尤为重要。其次,提前终止临床实验可以为药物研发者带来商业上的优势。药物研发是一项昂贵的过程,而提前终止临床实验可以减少研发成本并提前获得市场份额。
提前终止的临床实验并不常见,但在某些情况下确实发生。以下是一些提前终止临床实验的例子:
阿贝拉昔单抗(Abelacimab):
2023年9月18日,生物技术公司Anthos Therapeutics宣布,阿贝拉昔单抗(Abelacimab)因出血明显少于利伐沙班,疗效上呈现“压倒性的优势”,在数据监测委员会建议下决定提前终止治疗房颤的2期AZALEA-TIMI 71研究。
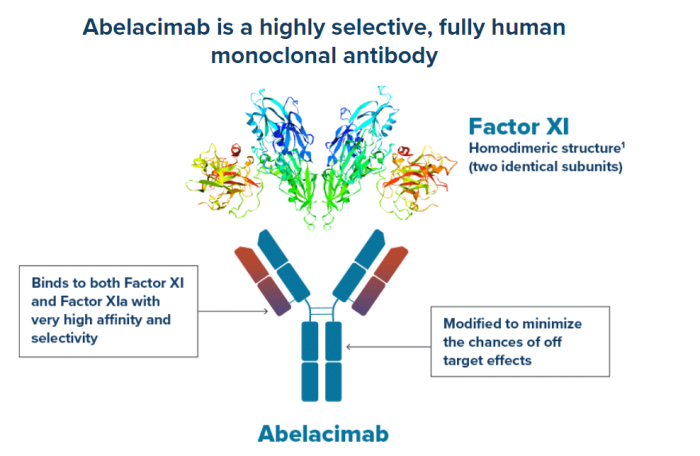
利伐沙班是治疗房颤的标准抗凝药物之一,而抗凝治疗最大的不良反应是增加出血的风险。阿贝拉昔单抗是一种高度选择性的全人源单克隆抗体,具有针对XI因子和XIa因子的双重抑制作用。由于XI/XIa因子抑制剂-阿贝拉昔单抗显著在保证抗凝效果的同时,出血风险大大减少,AZALEA-TIMI 71研究提前终止;对照组患者可以选择从利伐沙班组转换到阿贝拉昔单抗组。
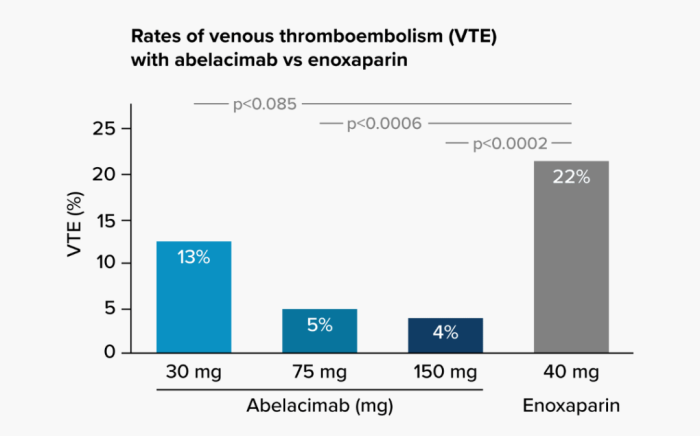
两年前, 阿贝拉昔单抗的2期疗效ANT-005 TKA研究便已取得了突破性的成果,结果显示阿贝拉西单抗明显优于标准治疗依诺肝素,相比依诺肝素,其使静脉血栓栓塞的发生率降低了约80%。该成果于2021年发表在《新英格兰医学杂志》上。
司美格鲁肽
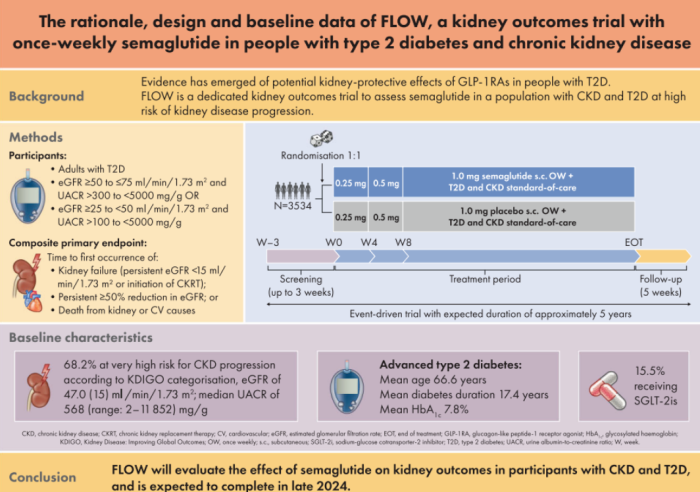
2023年10月11日,诺和诺德宣布提前终止其GLP-1药物司美格鲁肽(semaglutide)治疗合并肾功能不全2型糖尿病患者和慢性肾病患者的3期临床FLOW试验。独立的数据监测委员会认为中期分析结果达到了特定的预设标准,因此予以停止该试验。预计FLOW数据将于 2024 年上半年发布。
FLOW临床试验是一项随机、双盲、平行组、安慰剂对照、优效性试验,比较注射司美格鲁肽1.0mg与安慰剂作为标准护理的辅助治疗对2型糖尿病和慢性肾脏病(CKD)患者肾脏结局的预防进展和肾脏及心血管死亡风险的影响。其自2019年正式启动入组,计划在28个国家的418个研究地点进行,预计入组3524例肾病患者,计划试验时间约5年。现在揭盲的临床数据预计在2024年上半年发布,相比原计划提前了约一年。
FLOW临床实验提前宣布成功,无疑为司美格鲁肽在新一代“药王”竞争中赢得了更多优势,2023年则有望突破200亿美元大关。
索凡替尼(surufatinib)
索凡替尼由和黄医药研发,于2006年立项。2019年6月,索凡替尼在治疗非胰腺神经内分泌瘤(NET)的3期SANET-ep研究中中期分析达到主要疗效终点,提前终止研究;2020年1月,治疗胰腺NET的 SANET-p也达到主要疗效终点,经独立数据监查委员会推荐提前终止研究。
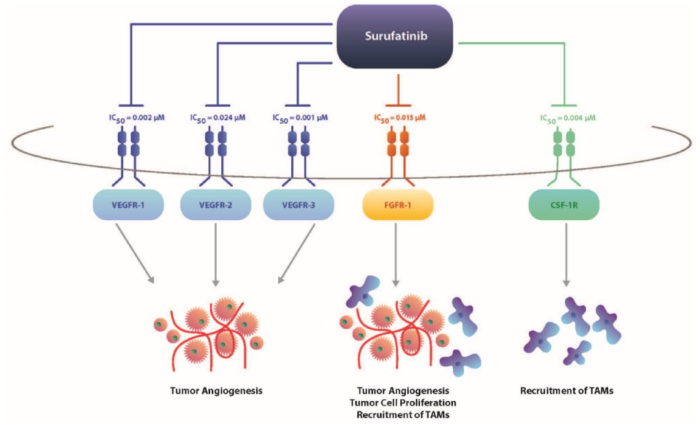
索凡替尼是一种具备多种作用机制的抗癌新药。它可以通过抑制血管内皮生长因子受体(VEGFR)和成纤维细胞生长因子受体(FGFR)来抑制血管生成。另外,其还可以抑制集落刺激因子-1受体(CSF-1R),借此调节肿瘤相关巨噬细胞,促进机体对肿瘤细胞的免疫反应。索凡替尼的多重作用机制让它可以与其它癌症免疫疗法联用,治疗多种类型的癌症。
索凡替尼的非胰腺神经内分泌瘤(NET)研究名称为SANET-ep,研究表明,索凡替尼在非胰腺NET的抗血管生成治疗过程中对于患者的明显获益。与安慰剂组的中位PFS 3.8个月相比,索凡替尼治疗组患者的中位PFS达到了9.2个月,提升了2.4倍, ORR为10.3%,63%的非胰腺NET患者实现肿瘤缩小,并在所有亚组中均观察到了索凡替尼的治疗疗效。独立数据监察委员会对SANET-ep数据预先设定的中期分析表明,索凡替尼已经成功达到PFS的预设主要疗效终点,因此决定提前终止研究。
索凡替尼的胰腺NET的研究名称是SANET-p,研究结果表明,索凡替尼与安慰剂相比,中位PFS提高了3倍(13.9个月对4.6个月),ORR为19.2%,84%的胰腺NET患者实现减瘤获益,疾病进展风险下降66%。因疗效同样显著,而提前终止。至此,胰腺和非胰腺神经内分泌肿瘤两类患者,都可以在治疗中选择索凡替尼。
索凡替尼于 2021 年 6 月及 2020 年 12 月,在中国分别获批用于治疗胰腺神经内分泌瘤和非胰腺神经内分泌瘤。
索凡替尼治疗胰腺及胰腺外神经内分泌肿瘤的新药申请滚动也已提交至FDA审核。2021年4月,FDA授予索凡替尼快速通道资格,进一步加速了其审核。2022年5月2日,FDA发出完整回复函,认为当前基于两项成功的中国 III期研究以及一项美国桥接研究的数据包尚不足以支持药品现时于美国获批,需要纳入更多代表美国患者人群的国际多中心临床试验(MRCT)来支持美国获批。
但我们有理由相信这款由我们国家自主开发的疗效十分出众的药物,与全世界患者见面的时间不会太长。
恩格列净(empagliflozin)
2022年3月16日,礼来和勃林格殷格翰联合宣布,基于独立数据监察委员会的建议,SGLT2抑制剂恩格列净(empagliflozin)治疗慢性肾病(CKD)患者的3期临床试验EMPA-KIDNEY提前终止。与安慰剂组相比,恩格列净使CKD患者肾脏疾病进展或心血管死亡的主要终点的风险降低了 28%,全因住院的发生风险显著降低14%。
恩格列净是一种口服、每日一次、高选择性钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂,在血糖水平较高的2型糖尿病患者中,抑制SGLT2可阻止糖被肾脏再吸收,促进糖分从尿液中排出。此外,恩格列净还可防止盐的再吸收,从而增加体内盐的排泄,降低身体血管系统的液体负荷,有助于减少心血管死亡。
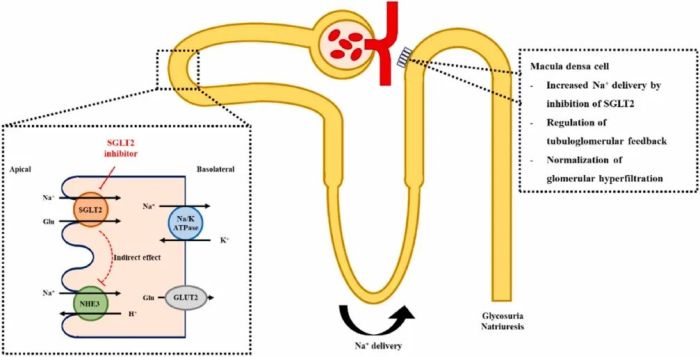
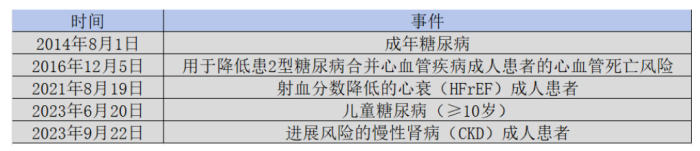
目前, 恩格列净已被FDA批准多项适应症。2022年恩格列净的全球营收高达82.15亿美元,位列全球第15位,且仍处于高速增长趋势中。
Entresto:
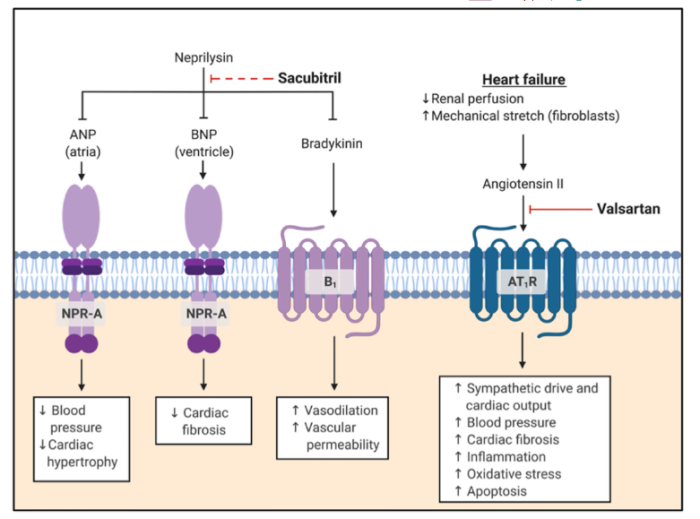
在全球最大规模的3期临床心衰试验PARADIGM-HF中,研究发现,与标准疗法依那普利相比,Entresto可使心血管死亡率降低20%, 这一优异结果使该研究而提前终止。
Entresto是首个血管紧张素受体脑啡肽酶抑制剂(ARNI)类药物,来降低衰竭心脏的压力。这是一种每天服用2次的片剂,其通过增强心脏的保护性神经内分泌系统(NP系统)并同时抑制有害系统(RAAS)来发挥作用。
Entresto成为20年来首个心衰新药,于2015年获得FDA批准,并在2017年在中国获批上市。Entresto上市以来,销售不断创新高,2022年,销售收入达到46亿美元,在心衰领域可谓一骑绝尘。
Cemiplimab(商品名Libtayo)
2021年3月15日,赛诺菲和再生元两家公司合作开发的PD-1抑制剂cemiplimab(商品名Libtayo)在宫颈癌3期临床试验中因主要终点—总生存率(OS)结果积极而提前终止。
该项3期临床旨在比较cemiplimab与化疗治疗转移或复发性宫颈癌患者的安全性和有效性差异。
结果显示,cemiplimab使总体人群死亡率降低了31%,cemiplimab组患者的中位OS为12.0个月,化疗组为8.5个月。鳞状细胞癌患者中,死亡率降低27%:cemiplimab组中位OS为11.1个月,化疗组中位OS为8.8个月。腺癌患者中,死亡率降低44%:cemiplimab组中位OS为13.3个月,化疗组中位OS为7.0个月。疗效均具有显著性差异,并且未发现cemiplimab新的安全信号。
Cemiplimab是第一个在3期试验中证明与化疗相比生存期显著改善的PD-1抑制剂。目前,欧盟委员会已批准cemiplimab作为单药疗法,治疗铂类药物化疗期间或之后疾病进展的复发或转移性宫颈癌成年患者,且无论PD-L1状态或组织学如何。
提前终止临床实验是一个罕见但重要的事件。当药物在临床实验中显示出明显的疗效时,提前终止可以更早地为患者提供治疗,并加快药物的上市进程。然而,提前终止也需要谨慎考虑,以确保药物的疗效和安全性得到充分评估。对于提前终止的临床实验,后续的监测和研究仍然是必要的,以确保药物的长期效果和安全性。
撰稿人 | 清风 生物制药小编
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多