国内外制药企业质量管理成熟度现状及对我国药品生产监管的启示
Part
1
1.1
美国FDA质量量度项目
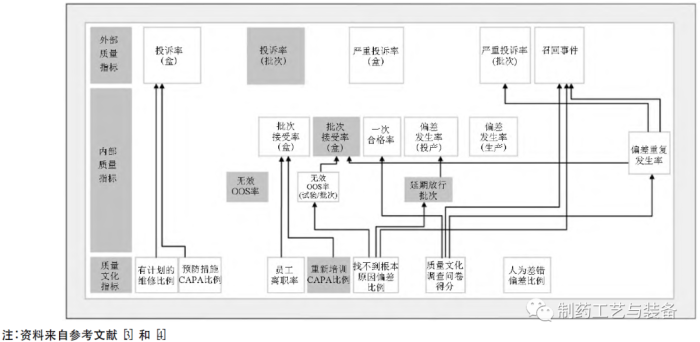
1.2
美国FDA质量管理成熟度项目
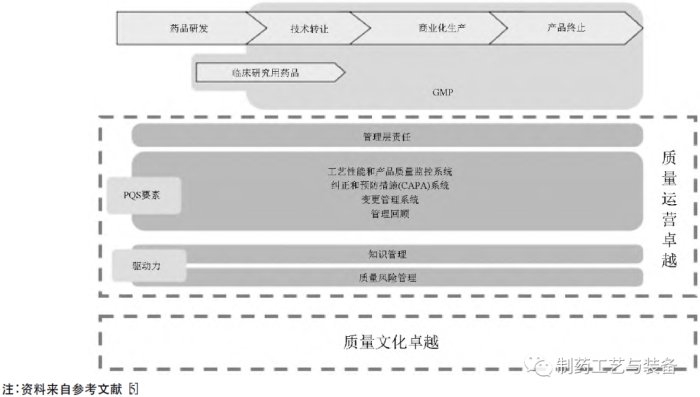
1.3
跨国制药企业质量管理成熟度


Part
2
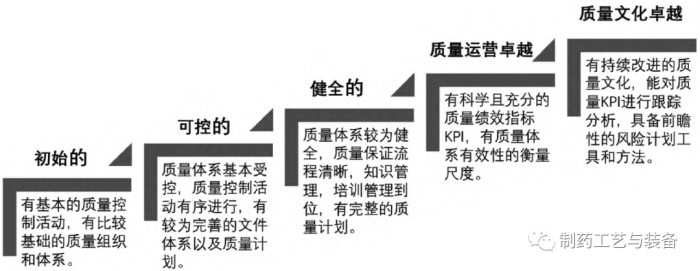
2.1
企业绩效管理中质量指标不够充分
2.2
质量管理体系的运行有效性需要提升
2.3
持续改进的质量文化建设需要加强
Part
3
3.1
转变药品生产监管理念
3.2
加强质量管理成熟度研究
3.3
智慧监管加速质量管理成熟
Part
4
参考文献
[1] International Conference on Harmonisation. Guidance on Q10 Pharmaceutical Quality System [EB/OL]. (2009-04-08) [2022-8-17]. https: / /https: / /www. federalregister. gov /documents /2009 /04 /08 /E9-7875 /internationalconference-on-harmonisation-guidance-on-q10-pharmaceutical-qualitysystem-availability.
[2] FDA. Quality Metrics for Drug Manufacturing[EB/OL]. (2022-03-09)[2022-08-17]. https: / /www. fda. gov /drugs /pharmaceutical-quality-resources/quality-metrics-drug-manufacturing.
[3] ISPE. Quality metrics initiative: A report from the pilot project-wave1 [EB/OL]. (2015-06-01) [2022-08-17]. https: / /ispe. org /products /ispe-qualitymetrics-initiative-wave-1-report.
[4] ISPE. Quality metrics initiative: Quality metrics pilot program wave 2 [EB/OL]. (2016-06-01) [2022-08-17]. https: / /ispe. org /products /ispe-qualitymetrics-initiative-wave-2-report.
[5] ISPE. Quality Management Maturity Program: Advancing Pharmaceutical Quality[EB/OL]. (2020-10-08) [2022-08-17]. https: / /ispe. org /pharmaceutical-engineering /ispeak /ispe-quality-management-maturity-program-advancing-pharmaceutical.
[6] FDA. CDER Quality Management Maturity[EB/OL]. (2022-05-04) [2022-08-17]. https: / /www. fda. gov /drugs /pharmaceutical-quality-resources /cder-quality-management-maturity.
[7] ISPE – PDA Guide to Improving Quality Culture in Pharmaceutical Manufacturing Facilities[EB/OL]. (2019-10-07) [2022-08-17]. https: / /ispe.org /news /ispe-pda-create-guide-improving-quality-culture-pharmaceutical-industry.
[8] 国家药品监督管理局. 国务院办公厅印发《关于建立职业化专业化药品检查员队伍的意见》[EB/OL] . (2019-07-18) [2022-08-17]. https: / /www. nmpa. gov. cn /yaopin /ypjgdt /20190718174601792. html.
[9] 国家药品监督管理局. 国务院办公厅印发《关于全面加强药品监管能力建设的实施意见》[EB/OL] . (2021-05-10) [2022-08-17]. https: / /www.nmpa. gov. cn /zhuanti /ypjgssyj /ypjgssyjjj /20210510191205129. html.
[10] 国家药品监督管理局. 国家药品监督管理局启动药品检查合作计划(PIC/S) 预加入申请工作[EB/OL] . (2021-09-29) [2022-08-17]. https:/ /www. nmpa. gov. cn /yaopin /ypjgdt /20210929162552105. html.
[11] Steven Lynn,Susan Schniepp,Justin Anahory. Getting drug quality right thefirst time [EB/OL]. (2022-04-20) [2022-08-17]. https: / /www. pharmamanufacturing.com/articles /2022 /getting-drug-quality-right-the-first-time /.
[12] 王霞,陈恒青,朱建伟. 质量管理体系中实施质量量度对制药工业的意义[J]. 中国医药工业杂志, 2020,51(4) : 545-550.
[13] 包敏芝,胡延熹. 质量量度在国内药品生产企业中的应用[J]. 上海医药, 2016, 37(23) : 69-72.
[14] 国家药品监督管理局. 中华人民共和国药品管理法[EB/OL]. (2019-08-27) [2022-08-17]. https: / /www. nmpa. gov. cn /xxgk /fgwj /flxzhfg /20190827083801685. html.
[15] 张景辰. 加强事中监管,促进药品产业的供给侧改善—FDA 质量量度计划的启示[J]. 中国食品药品监管, 2016,(4): 56-58.
[16] 杨依晗,赵燕君,高惠君. 美国食品和药物管理局质量量度管理的简介及启示[J]. 中国新药与临床杂志, 2016, 35(4) : 260-263.
[17] 孙敏,谭德讲. 用合理的质量量度指标助力药品质量的科学监管[J]. 中国食品药品监管, 2021,(2) : 37-43.
撰稿人 | 胡位歆、和金周
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多