欧盟新版无菌药品附录主要变化点及对我国无菌药品生产管理的启示
目的:通过比对分析提出工作建议,为国内无菌生产企业进一步提升无菌管理水平提供借鉴。
方法:介绍最新版欧盟无菌药品附录的一些主要变化点,对比分析欧盟和我国在无菌药品方面的异同。
结果与结论:欧盟无菌附录在适用范围、污染控制体系(CCS)、环境监测和工艺监测、部分生产和生产具体技术等方面较原有版本和我国要求有较大提升。国内无菌生产企业应重视欧盟无菌附录的变化,逐步加强无菌管理,大力推进无菌生产企业的国际化进程。
无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药[1],相对于口服制剂,无菌药品的给药方式多为注射给药,且患者使用范围多为急、重症,属于高风险产品生产领域,因此各国药品生产质量管理规范(GMP)均建立了专门的章节或附录对无菌药品的生产提出了专门要求。
欧盟作为欧洲国家的政治经济联合体,兼有超国家联邦政体和国际组织的双重属性,其各项事务的治理议案绝大多数都是通过协商和博弈达成共识才得以通过,药品监管领域也是如此[2],其所发布的相关药品检查要求考虑了不同发展水平成员国的实际状况,可供借鉴之处颇多,值得深入研究和分析。
2022 年8 月22 日,欧盟发布GMP 附录1《无菌药品生产》(以下简称欧盟附录)指南最终版,并定于2023 年8 月25日实施(第8.123 条的最后实施期限为2024 年8 月25 日)[3],本版附录与上一版相比,发生了较大的变化,可能会对国内有国际接轨需求的无菌药品生产企业产生较大的影响。通过前期的对比工作,发现我国现行GMP 对无菌药品的要求与上一版本欧盟附录要求基本相同,本文主要通过分析新版《无菌药品生产》附录更新的内容进行分析与总结,以期为药品检查工作中无菌检查关注点提供思路,同时也为国内无菌生产企业进一步提升无菌管理水平提供借鉴。
欧盟GMP 附录1“无菌药品生产”于1971 年首次出版。往后陆续进行了多次修订,2003 年5 月30 日发布了修订版,2005 年和2007 年,调整了洁净室分级表,新增培养基模拟灌装、生物负载监测和西林瓶轧盖相关指南。本次修订版本为在2007 版基础上的修订与完善,该版本在正式发布前经历了多轮的征求意见。该版本除8.123 条款于2024 年8 月25 日实施外(冻干机部分,为培训和实施留出足够的时间),将于2023年8 月25 日实施[3]。本次修订的主要原因是GMP/GDP 检查员工作组合PIC/S 委员会共同建议对现行版附录1 无菌药品生产进行修订,以反映监管和生产环境的变化。新附录阐明了生产企业如何通过使用ICH Q9 和Q10 指南中的新型工具,加深对工艺的理解。本次修订还考虑了其他GMP 章节和附录以及其它法规文件中的相关变更、考虑了一些技术的进步,力争保证一致性,消除歧义。
本次修订是对当前版本的重大改进,并突出了PIC/S、EMA 和WHO 之间的巨大合作。可以看出,附录1 修订发布后对全球药品生产和其它无菌产品的生产,可能达到的影响力将是非常普遍的。
本版附录对结构进行了优化,新版附录由2007 年版的16页增加到了57 页,目录的比对详见表1。

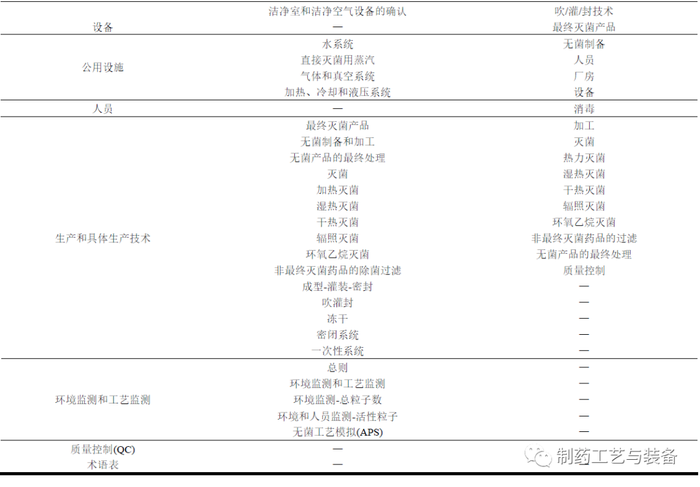
新版附录调整了整体结构,逻辑性方面更强,将无菌制备、灭菌、除菌过滤等归入生产和具体生产技术的章节项下,新增公用设施章节,强调了高风险公用设施要求的同时建立专门子章节明确了无菌生产过程用水、气、真空等的要求。新增药品质量体系(PQS)章节,要求将有效的风险管理系统纳入产品生命周期的各个方面,正确识别和理解产品的风险。在原有各章节中也进行了进一步的细化,更利于企业的理解和执行。
本版附录在范围章节规定:“无菌产品的生产涵盖多种无菌产品类型(原料药,辅料,内包装材料和成品制剂),包装规格(单剂量到多剂量),工艺(从高度自动化系统到手动工艺)和技术(如生物技术、传统小分子生产系统和密闭系统)。”该范围与国内药品GMP 附录1 所列“本附录适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程”相比,扩大了适用范围,将无菌辅料及内包材类纳入附录管理。同时也明确该附录可用于支持其他非无菌但须控制和减少微生物、微粒和内毒素/热原污染的产品的生产。
ICH Q10 制药质量体系中关于控制策略的定义为“根据当前对产品和工艺的理解而产生的一系列保证工艺性能和产品质量的有计划的控制”。药物与医疗保健科学协会(PHSS)在2014 年8 月发布的《Control Strategy in Manufacture of Sterile Pharmaceutical/Drug Products,Whitepaper(无菌药品生产控制策略白皮书)》[4]提到了控制策略应该包含制造控制策略、质量控制策略和污染控制策略。
欧盟无菌附录在2017 年和2022 年的征求意见稿[5]中将污染控制体系(CCS)作为新术语引入,本版附录正文中有50 余次关于CCS 的描述,其将CCS 定义为源于现有产品和工艺的理解得出的针对微生物、内毒素/热原和微粒的一系列有计划的控制措施,以确保工艺性能和产品质量。控制措施可包括,原料药和制剂的物料和组分相关的参数和属性,厂房设施设备的操作条件,过程控制,成品质量标准,以及相关方法和监控频次。
CCS 并不是法规的新要求,欧盟附录只是对现有要求的正式化和一些整合,涵盖了从厂房设施公用工程的建设到日常运维、生产工艺的设计到实施、设备的选型和使用、物料的筛选和管控、人员的培训和管理、清洁消毒的策略、监测系统等全过程。要求不仅仅是对于风险评估、验证、程序等相关信息的简单收集和罗列,而是需要对控制策略的有效性和合理性的一个持续性评估,要求形成一个总结性、周期性、实时更新的文件体系。CCS 文件的形成要求药品生产企业对产品的工艺有深入的了解,才能分析出各环节潜在的污染可能性,从而达到污染控制的目的。
厂房章节包含了总论、屏障技术、洁净室和洁净空气设备的确认和消毒四个部分。
屏障技术部分增加了大量的条款对隔离器及RABS 的工艺设计、手套检漏及清洁消毒、内部的净化消毒要求进行了规定。其中,隔离器的使用由上一版本和我国附录要求的D 级变化为开放式隔离器的环境通常应至少为C 级,封闭式隔离器的背景应至少为D 级,背景级别的确定应基于风险评估并在CCS 中论证合理性。
洁净室和洁净空气设备的确认部分对洁净室各级别允许的微粒总数和最大微生物污染水平进行了优化,与上一版本及我国2010 版药品GMP 附录1 无菌药品最大的变化为:在微粒控制方面,一是对于A、B 级区,在CCS 或历史趋势中有说明的情况下,可以考虑包括5 靘微粒的分级,在标准中未做标准限值定义;二是对于D 级区的动态监测,没有做出预先的标准限度,生产企业需要根据风险评估和日常监测数据建立动态的监测限度标准。在最大微生物污染控制方面,一是现行法规及上一版欧盟无菌附录,均不要求洁净室分级时进行微生物监测,本版本附录要求在洁净室分级和日常动态监测中均要进行微生物监测;二是A 级各类微生物的检出限度由原来的<1 调整为无微生物生产(No growth);三是强调沉降碟的暴露时间应基于回收率研究。
本版本在人员方面的要求主要的变化在于明确了进入人员的基本要求:无监督进入应仅限于经过适当资质确已通过更衣评估并参与过成功APS 的人员,强调了准入资质的动态管理,在取消资质后重新获得资格的在培训要求等。人员着装方面,强调B 级区应佩戴无菌眼罩(或护目镜),在穿工作服时佩戴的无菌手套之外再佩戴另一幅无菌手套,并将袖口塞入外层手套中。
本章节为该版附录中内容最多的一个章节,涵盖了各类灭菌技术、无菌产品制备和终处理以及非最终灭菌产品的除菌过滤等内容。该章节引入了一些新的生产技术或术语,如使用前灭菌后完整性测试(PUPSIT)和一次性系统(SUS)。
附录中要求无菌过滤器组件的完整性应在使用前通过完整性测试(使用前灭菌后完整性测试,PUPSIT)进行核实,检查由于过滤器使用前准备造成的损坏和完整性降低。我国现行GMP 对滤器完整性的要求是除菌过滤器使用后,必须采用适当的方法立即对其完整性进行检查并记录。完整性测试节点要求的变化对过滤系统的组成提出了新的挑战,灭菌后使用前的滤器组件视为无菌系统,过滤系统的设计应避免完整性检测过程(检测用溶剂、气体等)不引入新的污染风险。
SUS 系统因其安全性、生产灵活性、成本低等众多优势广泛运用到了生物制品行业[6],欧盟将SUS 的相关要求纳入了本版无菌药品附录。附录对SUS 的特定风险进行了列举并要求应将相关风险作为CCS 的一部分予以评估,要求评估SUS 的溶出物、浸出物对产品的影响,要求建立接受标准及人工处理操作等。
无菌工艺模拟(APS)为本版附录的新增章节,2007 版的附录及我国的GMP 附录中关于APS 只有两个条款的描述,主要为验证频次和结果判断的要求。后续我国发布了《无菌工艺模拟实验指南(无菌制剂)》[7],该指南对模拟实验的设计、实施、周期等进行了详细的规定,主要差异:模拟周期除常规的周期要求外,强调在停产前、长时间闲置或生产线退役或移动位置之前,应考虑在最后一个生产批次之后进行APS。培养结果的目标应为无微生物生长,任何被污染的单元应判定APS 失败并进行调查,并应进行足够数量的连续成功的重复APS(通常至少3 次)以证明工艺已恢复到受控状态。
国内部分学者已对CCS 体系进行了研究与思考,李栋芸[8]认为制定CCS 需要深厚的技术和工艺知识,需要药品生产企业工程、设备、生产、QA、QC、物料管理相关人员甚至供应商的参与,结合产品的工艺流程和特点,从多方面分析污染来源,制定污染控制策略。李国琼[9]等学者从冻干粉针剂生产工艺过程入手,从源头控制、时间限制、隔离保护、环境监测进行CCS 具体阐述分析,可为无菌药品生产企业制定CCS 分析提供一些其实。
污染控制策略不是一次性行为,应定期对生产过程中的变更、偏差、关键参数趋势等进行回顾,并根据趋势不断更新控制策略,才能持续提升无菌保证水平,提高产品质量及用药安全性。
无菌产品的生产是一项复杂的活动,需要特定的控制和措施来确保产品质量,仅通过检测不能保证产品的无菌性。欧盟无菌药品附录强调对监测过程产生的各类数据、生产过程发生的各类变更、偏差进行定期的回顾,通过统计学的分析及时发现不良趋势以达到提前纠正预防的目的。企业应重视数据的应用,使各类数据服务于质量提升。
欧盟认为,高标准的硬件可避免人员操作的随意性[10]。新版欧盟无菌药品附录引入了大量的新的生产技术和硬件要求,企业应基于产品的风险,适时选择合适的新技术改造现有车间。对于新建企业,车间设计过程就应按照QRM 原则进行管理,前瞻性的发现潜在的质量风险,通过考虑附录对硬件的相关要求,结合产品工艺特点,采用适当的技术加强对产品的保护。
欧盟的无菌药品附录有着普遍的影响力,继该附录更新后,PIC/S 于2022 年9 月更新了无菌药品附录、WHO 于2022年12 月更新了无菌药品附录,上述更新的无菌药品附录在结构、关键内容上保持了与欧盟无菌药品附录的一致性。目前我国通过欧盟GMP 认证的无菌制剂企业数量仍较少,本研究对欧盟无菌药品附录中主要的变化点进行了简要分析,并对该附录可能对无菌药品生产企业造成的影响进行了讨论,以期给企业一些指导。企业通过对法规进一步的学习与解析,分析自己在无菌管理方面存在的差距并不断完善,可以促进国内无菌药品生产企业的无菌保障水平提升,加速走出国门。
[1]国家食品药品监督管理总局.药品生产质量管理规范(无菌药品附录)[EB/OL].(2014-07-04)[2011-02-24]https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20110224164501312.htm.
[2]王晓,杨牧,王璐,等.欧盟与中国药品法律法规及检查体系对比分析[J].中国药业,2020,29(10):60-64.
[3]EU GMP Annex 1 Manufacture of Sterile Medicinal Products[S].2022.
[4]PHSS Control Strategy White Paper[S].2014.
[5]Anon.Second targeted stakeholders' consultation on the revision of Annex1,on manufacturing of sterile medicinal products,of Eudralex volume 4[EB/OL].[2020-02-23].https://ec.europa.eu/health/medicinal_products/consultations/2020_sterile_med icinal_products_en.
[6]曹燕静,侯伟,张仲理.抗体药物生产用一次性使用系统的可提取物与浸出物研究概论[J].中国医药工业杂志,2021,52(7):871-880.
[7]国家食品药品监督管理总局.国家药品监督管理局关于发布除菌过滤技术及应用指南等3 个指南的通告[EB/OL].(2018-09-11).https://www.nmpa.gov.cn/ylqx/ylqxggtg/ylqxqtgg/20180911170301439.html.
[8]李栋芸.无菌注射剂污染控制策略[J].化工管理,2022,2:144-147.
[9]李国琼,翁贤坤,梁玉琴,等.冻干粉针剂生产过程的污染控制策略[J],中国医药工业杂志,2022,53(1):155-162.
[10]靳玉瑶,赵利斌,王娟.欧盟生产质量管理规范监管制度对我国药品生产企业的启示[J],中国药业,2021,31(13):1-4.
撰稿人 | 赵嵩月
责任编辑 | 胡静
审核人 | 何发















评论
加载更多