固体分散体
1. 药物增溶技术
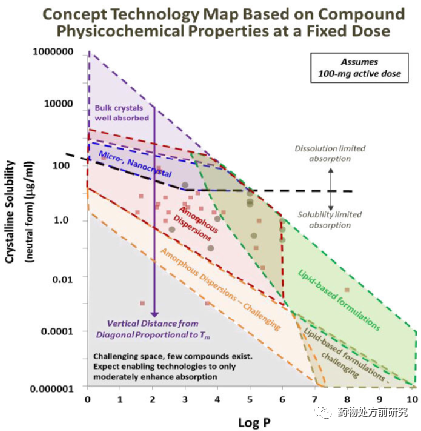
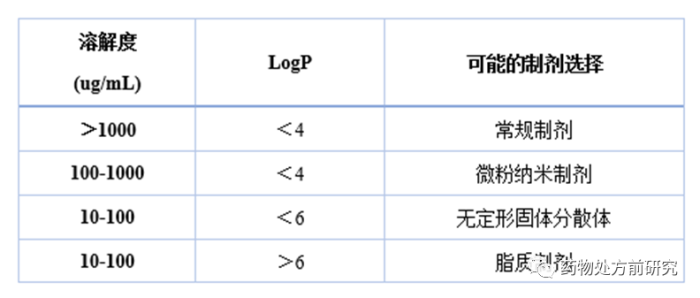
不同性质的难溶性化合物选择哪种增溶策略呢?下面是Lonza基于化合物理化性质提出的制剂决策导图。横坐标是LogP,纵坐标是晶体溶解度。假设用药量是100 mg。如果溶解度比较高(﹥1000 ug/mL),且LogP小于4,可以直接选择常规制剂。如果溶解度在100-1000 ug/mL之间,可以考虑微粉化或者纳米制剂。如果溶解度更低,则可以考虑ASD。但如果溶解度低,同时LogP很高,﹥6,可以考虑使用脂质制剂。当然,这只是一个经验性的总结,可以提供参考。但具体到每一个化合物还是需要综合考察化合物的性质,选择合适的增溶方法。有时候可能还需要对比不同手段的效果,以确定最合适的方法。
2.ASD简介
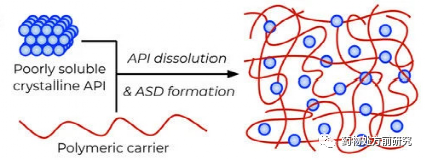
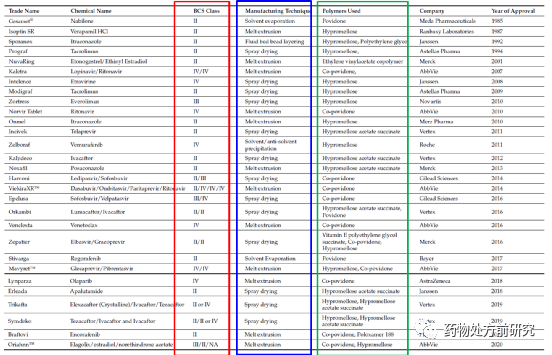
无定形固体分散体是指药物以高能态的无定形或分子形式分散于载体材料中,其中载体材料通常为高分子材料。ASD是一种相对比较成熟的手段,已经应用于多种上市药物,下表列举了一些已上市的ASD药物。在2010年之后,FDA批准的ASD药物明显增多,这也说明ASD越来越受到人们的关注,技术也日益成熟。从表中也可以看出,ASD针对的药物基本都是BCS II和IV类化合物,即低溶解性的化合物。
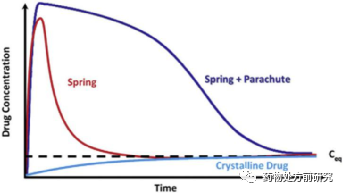
无定形在前面的文章中已经有介绍。无定形药物处于高能态,因此具有较高的表观溶解度和溶出速率。而正因为无定形处于高能态,因此他具有不稳定,溶解后易结晶析出的问题。而ASD则很好的解决了纯的无定形API不稳定易析出的问题。如下图所示,晶态药物的溶解随时间的延长而增大,最后达到一个平衡值。无定形的溶出速率非常快,而随着时间的延长,可能发生沉淀,溶液中浓度降低,形成一个“喷泉”形状的溶解曲线。而如果加入了沉淀抑制剂,则达到峰值后的降低速率会较无定形小,形成一个“降落伞”形状的溶解曲线。正是这样“降落伞”形状的溶解行为,提高了药物的生物利用度。
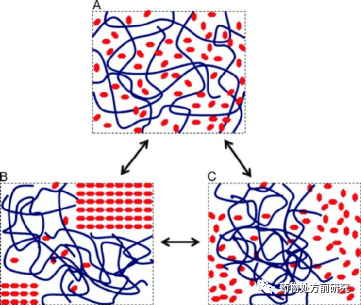
ASD也可以理解为药物分子作为“溶质”,溶解于“溶剂”-无定形高分子基底中形成的无定形混合物。根据它们的组成,这样的二元体系可以分为几种不同的情况,如下图所示。如果药物的载入量低于它在该高分子基底中的平衡溶解度,则它们会形成热力学稳定的均一固体溶液,如下图A所示。这是固体分散最希望得到的状态,均一且稳定。而对于大多数体系而言,这样的情况只存在于较低的载药量和较高的温度条件下。如果降低温度,则体系过饱和,药物分子会结晶析出,如下图B所示。或者,相比于无定形相分离,药物结晶需要越过更高的能垒,ASD发生相分离,如下图C所示。因此,ASD的性质与两个主要的因素有关,即高分子的种类和载药量。
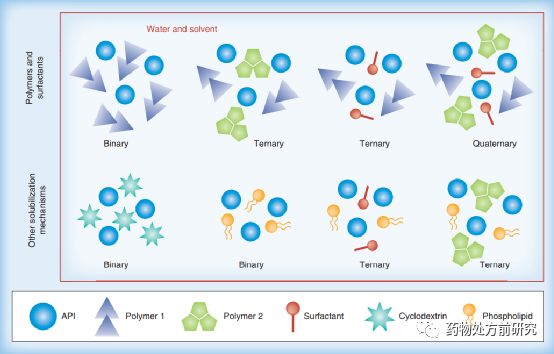
最简单的ASD由API和一种高分子材料组成,此外还有一些更复杂的体系。比如为了进一步提高溶出,可能会加入表面活性剂或者环糊精等。有时候可会使用两种高分子材料以提高ASD的性能。
3.ASD的性质
ASD首先是无定形,它就具有无定形的一般特性。晶体和无定形在加热条件下的热力学变化如下图所示。熔融的药物缓慢冷却,分子具有足够的时间从现在的当前位置移动到晶体中热力学稳定的点。此时,药物从无定形转化为晶体。而如果降温速率很快,它将转化为过冷液体(supercooled liquid state)。继续冷却,系统处于平衡状态,直到达到玻璃化转变温度。低于玻璃化转变温度,系统处于非平衡状态(过冷液态,supercooled liquid state或低粘度橡胶态,lower viscosity rubbery state),形成一种冻结的玻璃态(glassy state)。玻璃化转变温度(glass transition temperature,Tg)是无定形物质性质发生转变的重要参数。
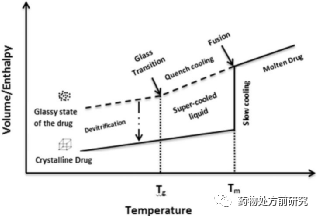
反增塑作用(Anti-plasticization)是指降低材料的塑性或者使材料硬化。在热力学上,通过增大玻璃化转变温度,可以提高从无定形态转变为晶态的能量。当两种具有不同Tg的物质混合后,最终Tg将介于这两个物质Tg之间。如果用高Tg的高聚物和低Tg的无定形药物从分子层面混合,则可以得到Tg介于这两者之间的ASD。换句话说,ASD的形成中,高聚物经历的是增塑作用,而药物经历了反增塑作用。最终ASD的Tg可以通过Gordon-Taylor方程进行计算:
其中Tg是混合物的玻璃化转变温度,Tg1和Tg2分别是无定形药物和高分子材料的玻璃化转变温度。W1和W2分别是药物和高分子的质量分数。KG是一个常数,取决于药物和高分子材料之间的作用力,可以通过下面的公式计算:
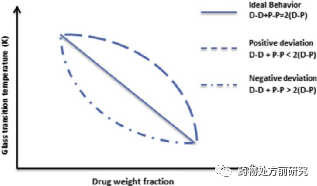
其中r1和r2是无定形药物和高分子材料的密度。除了Gordon-Taylor方程,Fox,Couchman-Karasz,或者Kwei等方程也可以用于ASD玻璃化转变温度的计算。Sathigari等人研究了Plasdone S-630载体对无定形efavirenz稳定性的影响。Plasdone S-630的增塑作用提高了系统的黏度,降低了分子的可移动性。而实验得到的Tg与理论计算得到的有很大不同。这是由药物与高分子材料非理想混合导致体积的非线性加成所引起的,如下图所示。当药物分散于高聚物载体中时,几种同核和异核作用开始起作用。这些作用可以用下面的公式表示:
1. D-D + P-P > 2(D-P)
2. D-D + P-P < 2(D-P)
3. D-D + P-P = 2(D-P)
其中D和P分别表示药物和高聚物。这些作用的相对强度最终决定ASDs的体积。第一种情况,同核作用大于异核作用。因此,形成固体分散体时,体积减小。第二种情况代表同核作用小于异核作用,形成固体分散体时,体积增大。第三种情况表示理想情况,没有体积变化。理想情况下,药物分子和高分子材料完全混合。但是大多数情况下,它们的混合不是理想状态,也就导致实际Tg也理论计算的Tg不一致。较强的药物-高分子分子间作用力会产生放热的混合,构型熵增大。此时,在相同高分子质量分数的情况下,ASD的玻璃化转变温度高于理想值,更加稳定。
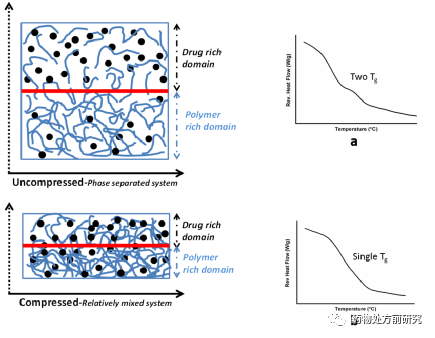
下面的例子研究了Miconazole-PVP VA64固体分散体在压缩条件下的相位响应。Miconazole-PVP VA64固体分散体通过喷雾干燥的方式得到。干燥的固体分散体在不同的压力条件下压缩,停留时间相同。当固体分散体中药物含量低于20%,观察到单一的Tg,高于20%,则出现两个Tg。而如果是加压的条件,更高药物含量的条件下仍然观察到单一的Tg。这种现象可以解释为不同相的相区尺寸减小,从整体看,两相混合的更加均匀。从这个例子也可以看出,是否有单一的Tg是形成ASD的重要判据。
4.ASD的稳定性
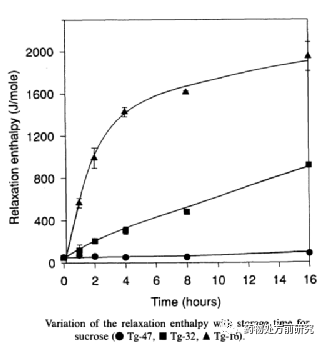
ASD的稳定性包括物理和化学稳定性。化学稳定性可以通过原辅料相容性确定,ASD的物理稳定性和其玻璃化转化温度有关。玻璃化转化温度即是无定形物质从玻璃态转化为高弹态的温度。无定形处于高弹态时,分子的运动加剧,发生转晶的可能性会大大增大。研究表明,如果存储温度低于玻璃化转化温度50K,则无定形较稳定,不容易发生重结晶。下图所示的蔗糖在不同存储温度下的热焓松弛,在低于玻璃化转化温度16和32K时,有不同程度的弛豫,而在低于玻璃化转化温度47K时,则没有明显的弛豫。排除API和高分子之间有较强的作用力,一般ASD的Tg是介于API和高分子之间的。如果API具有较低的Tg,则可以通过选择具有较高Tg的高分子材料作为载体材料,使ASD具有相对较高的Tg,提高其物理稳定性。
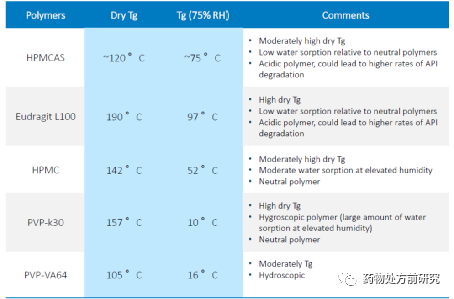
玻璃化转化温度和热焓松弛可以通过DSC或者mDSC进行测试,如下图所示。玻璃化转化一般是一个台阶,一般将中点温度作为玻璃化转化温度。而如果有吸热峰,同时又有基线的变化,则此时是玻璃化转化温度和热焓松弛的叠加。普通的DSC无法将两个过程分开,而mDSC则可以将他们分开。其中玻璃化转化在可逆曲线上,而热焓松弛在不可逆曲线上。
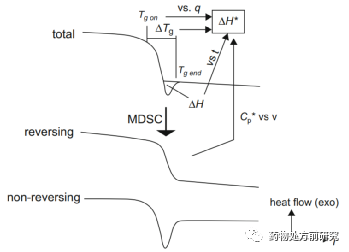
水分会影响ASD的稳定性。水是一种很强的增塑剂,他的Tg为-137度,具有很高的自由体积,水分可以进入无定形内部,显著提高自由体积,导致无定形分子流动性增加,从而降低玻璃化转变温度。下图所示的是几种不同高分子材料在不同湿度下的玻璃化转变温度。随着湿度的不断增大,玻璃化转变温度是不断降低的。因此,提高无定形稳定性的方法主要有两个:降低存储温度和保持环境干燥。
5.常用高分子材料
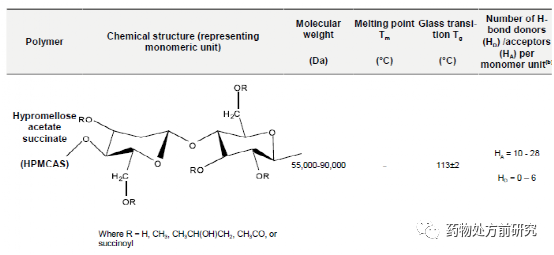
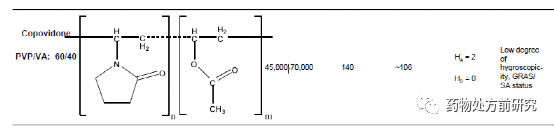
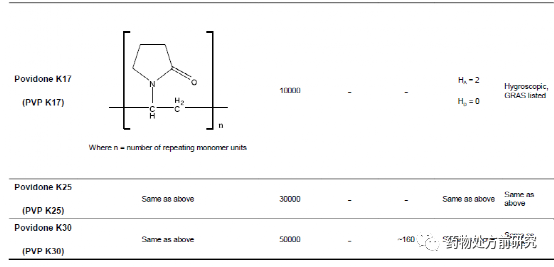
高分子是由重复的结构单元组成,这些结构单元称之为单体。根据它们的来源进行分类,可以分为天然高分子(淀粉、纤维素、蛋白质等),半合成高分子(羟丙甲维生素[hydroxypropyl methylcellulose, HPMC]),合成高分子(聚乙烯吡咯烷酮[polyvinylpyrrolidone, PVP])。从单体的角度分类,它们可以分为均聚物(homopolymers)和共聚物(copolymer)。均聚物是指只含有一种单体的聚合物,如甲基纤维素。共聚物是指含有两种不同的单体,如交聚维酮。聚合物可以是无定形(如聚丙烯酸),半晶态(如聚L-乳酸)或者晶态的(如聚乙二醇)。高聚物的链状结构可以抑制药物分子的移动。这样可以降低无定形药物的化学势,使得接近晶体。不同的高聚物对无定形药物的影响不同,例如分子流动性,热力学性能,环境应力,制备方法等。下面列举了几种常用的高分子材料。
6.ASD的筛选流程
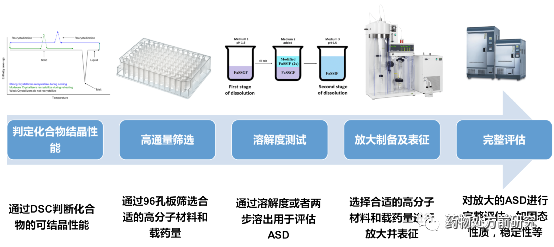
ASD的筛选可以按照下面的流程。首先通过DSC判断化合物的结晶性能,如果结晶性能较强,则可能使用较低的载药量;如果结晶性能较弱,则可能使用较高的载药量。然后通过96孔板进行高通量筛选,可以同时筛选高分子和载药量。得到的固体薄膜可以通过PLM、DSC等进行表征,选择候选高分子和载药量。然后再通过溶解度测试确定溶解度较高和能够维持较长过饱和时间的高分子和载药量组合。之后就可以通过喷雾干燥或者热熔挤出等方法放大制备ASD并表征,确认后即可进行完整评估,固态性质、稳定性等。
7.ASD制备
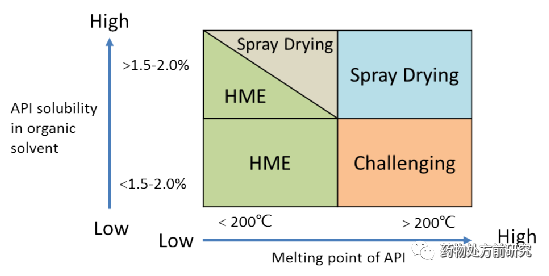
ASD属于无定形的一种,所以无定形的制备也同样适用于ASD。一般的通用方法之前已有介绍,所以这里侧重介绍两种工业化的制备手段。从文章开头的表中也可以看出,目前商业化制备ASD的方法有三种,分别为喷雾干燥(Spray drying)、热熔挤出(Melt extrusion)和共沉淀(Co-precipitation)。其中喷雾干燥和热熔挤出占85%以上。喷雾干燥和热熔挤出的选择需要根据化合物的特点,主要与化合物的在有机溶剂中的溶解度和熔点相关。如果化合物在有机溶剂中的溶解度很低,则没有办法通过喷雾干燥,因为喷雾干燥首先需要将化合物溶解。而如果化合物的熔点太高,则无法通过热熔挤出的方法制备ASD,因为热熔挤出的前提是将化合物和高聚物熔化。如果即可以使用喷雾干燥,又可以使用热熔挤出,一般优先选择热熔挤出,因为他的成本比较低。
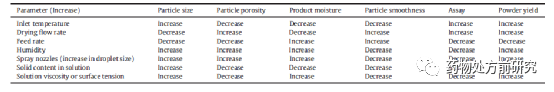
首先介绍喷雾干燥。喷雾干燥的原理示意图如下图所示。喷雾干燥是一个连续过程,它可以非常容易地从实验室规模放大到工业化生产。喷雾干燥的参数对于产品的性质有很大影响,主要的参数包括入口温度、干燥气体流速、雾化条件等。喷嘴的种类和大小很大程度上决定了固体分散体的粒径大小。此外,固体的含量也可能影响溶液的黏度,从而影响干燥过程及最终产品性质。下表列举了一些参数以及它们对产物的影响。
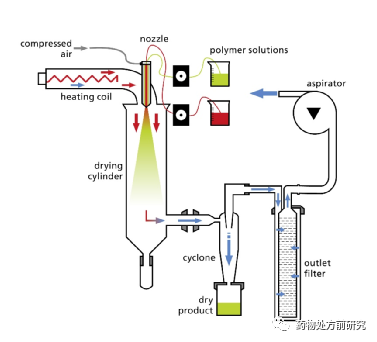
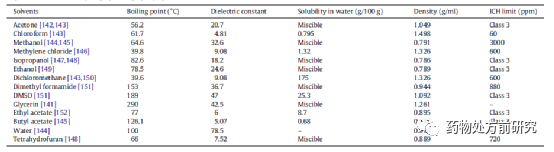
开发ASD第一个挑战就是找到合适的溶剂。它必须能够溶解足够多的药物和基底,最好大于50 mg/mL,并具有较低的黏度。而且,从GMP和工业角度,溶剂必须低毒性且易挥发,因为最终产物中的溶剂残留必须符合ICH中的相关指导原则(Q3C(R5))。该指导原则中将溶剂分为三类,其中Class 3是推荐使用的,而Class 1和Class 2应该尽量避免使用。喷雾干燥时,一些常用的溶剂如下表所示。
同样,基底也会影响最终产物的性质,尤其是无定形度,物理和化学稳定性,可湿性等。例如当采用表面活性剂作为载体,如tween 80,十二醇硫酸钠,泊洛沙姆,牛黄胆酸钠等,可以得到第三代固体分散体,可以提高药物的溶解度和生物利用度。
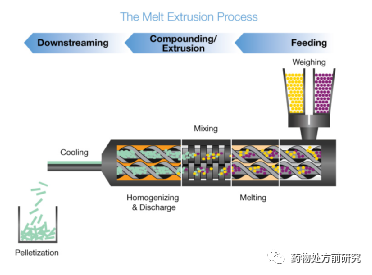
热熔挤出的原理示意图如下图所示。热熔挤出,尤其是双螺杆热熔挤出(twin-screw melt extrusion)是最常见的工业固体分散制备手段。双螺杆相比于单螺杆具有更大的优势。双螺杆可以减少物质在挤出机中的停留时间,物料连续流出,各组分混合的更好。热熔挤出是连续操作,易于放大,同时也没有溶剂参与。在热熔挤出中,熔融的药物和基底加入到制剂中的其它辅料中。熔融的材料可以作为制粒液体,确保混合均匀,以便后续的操作。工业和实验室热熔挤出的区别仅在于螺杆的直径大小。实验室热熔挤出螺杆的直径一般在11到16 mm,而工业挤出机螺杆直径一般在16 到50 mm。这样的连续操作可以满足工业/GMP生产,产量从几kg到数吨。通过HME制备固体分散,产物的性质主要取决于组成和过程参数。选择合适的基底和塑化剂是关键。除了螺杆的设计,其它参数例如加料速率、温度和旋转速率是决定最终产物性质的关键因素。HME中使用的基底通常是低熔点或者低玻璃化转变温度的高聚物或者蜡类物质。通常使用的载体包括PVP 、PVP-VA、PEG、纤维素酯类等。根据这项技术,高聚物行业也开发出针对此项技术的高聚物,如HPMCAS 、Soluplus® 、Affinisol®等。通过加入一些特定成分,可以改善最终药物释放,例如Vitamin E、Tween®、Myrj®等。
8.ASD的表征
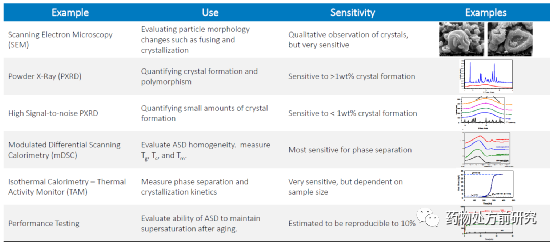
ASD的表征也有很多方法,如PLM,XRPD,DSC等等。PLM或者SEM可以表征ASD的外观形貌以及尺寸大小。PLM还以对ASD中是否含有晶体进行检测。XRPD同样可以用于晶体和无定形的区分。使用高分辨的XRPD还可以对ASD中的晶体含量进行定量分析。mDSC可以对ASD的玻璃化转化温度进行检测,玻璃化转化的个数可以判断ASD的均一性,而玻璃化转化温度则可以判断ASD的物理稳定性。
参考文献:
1. Williams, Hywel D., et al. "Strategies to address low drug solubility in discovery and development." Pharmacological reviews 65.1 (2013): 315-499.
2. Tambe,Srushti, et al. "Recent Advances in Amorphous Solid Dispersions: Preformulation, Formulation Strategies, Technological Advancements and Characterization." Pharmaceutics 14.10 (2022): 2203.
3. Boucher, Virginie M., et al. "Enthalpy recovery of glassy polymers: Dramatic deviations from the extrapolated liquidlike behavior." Macromolecules 44.20 (2011): 8333-8342.
4. Patel, Nirali G., Sabrina Banella, and Abu TM Serajuddin. "Moisture sorption by polymeric excipients commonly used in amorphous solid dispersions and its effect on glass transition temperature: III. Methacrylic acid-methyl methacrylate and related copolymers (Eudragit®)." International Journal of Pharmaceutics 636 (2023): 122745.
5. Newman, Ann, Karthik Nagapudi, and Robert Wenslow. "Amorphous solid dispersions: a robust platform to address bioavailability challenges." Therapeutic delivery 6.2 (2015): 247-261.
内容来源:药物处方前研究
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多