注射用水分配系统设计探讨
注射用水广泛应用于制药生产的配液、清洗等工艺过程中,WHO 和各国药典提出了注射用水质量的最低要求。基于风险识别的注射用水制备、储存和分配系统的设计对降低质量风险至关重要,应识别出注射用水制备、存贮、分配、使用和控制整个生命周期各环节各阶段的风险和削减措施并在设计中体现。分配系统设计要满足URS,符合标准、规范并满足以下要求:
(1)维持化学物质和微生物数量在可接受限值范围内,最小化微生物生长的环境和条件;
(2)满足使用点流速、压力、温度的需要,适应使多用点的瞬时不同用水需求;
(3)确保系统可靠并最小化对运行的潜在影响,降低初始投资和运行成本。
在具体设计过程中,还要考虑以下因素:
(1)系统的配置:单个或多个循环系统、使用点需求、冷却需求(单点、子循环或多个分支换热器组合)、再热需求和二次循环等;
(2)使用点温度、压力、流速细节,决定换热器、泵、流体装置和部件等;
(3)使用点安装方式便于保护、维护、取样和清洁。
Part
1
中国GMP(2010)第九十七条“注射用水可采用70 ℃以上保温循环” [1],中国药典(2020) [2] 也在此基础上提出了更具体的要求。欧盟GMP 附录1( 2008)第59 条“注射用水应该以防止微生物滋生的方式生产、储存、分配,如在70 ℃以上稳定循环” [3]。
美国FDA高纯水检查指南(1993)提及“65~80 ℃热循环可以认为是自消毒” [4],在第IX 管道章节讨论了“盲端”与循环温度的关系,提到65~80 ℃热循环、65~75 ℃热循环两个温度范围,即盲端长径比(L/D)越小,温度可以相对较低。
1.1
分配系统决策树和不同配置方案概念
上述药典和GMP 规范都提到“70 ℃以上稳定循环”,而制药的生产实际需求是:常温(20~25 ℃)使用点多 、用水量大,传统的单点管中管换热器或列管式换热器存在温度控制精度低、压降大、投资高的局限,需要我们在设计前期进行系统配置的规划和决策。
我们可以参考国际制药工程师协会基本指南4《水和蒸汽系统》(2019 版) [5] 推荐的决策树工具,梳理出一个最适合特定工艺需求的备选方案,评估哪个配置是最能满足用户需求和给定的条件,见图1。
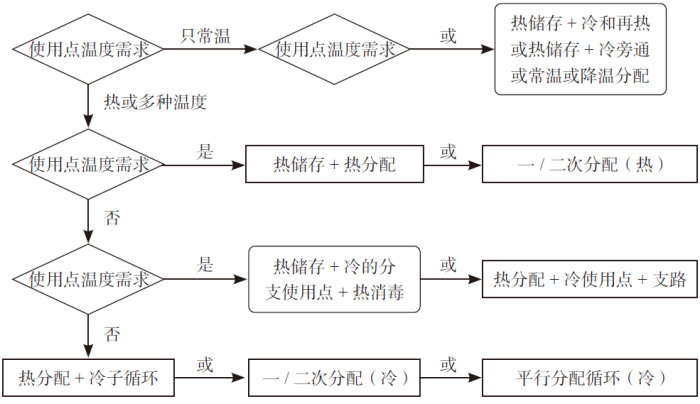
图1 分配系统决策树
基于上述决策树的梳理,结合国际制药工程实践,我们针对两个注射用水各使用点车间工艺对温度、流量的不同需求,梳理出两个案例的系统配置和消毒方式,见表1。

表1 案例分配系统配置
1.2
不同案例分配系统温度控制策略和设计
根据系统配置方案,我们进一步细化了两个案例系统储罐和循环管路设计温度,见表2。这两个案例不同于ISPE 推荐的配置概念流程图,部分有相通之处,在各个环节做了细致的风险分析、设计计算和工程设计,重点是不同用水工况或生产模式下温度的设置和控制。
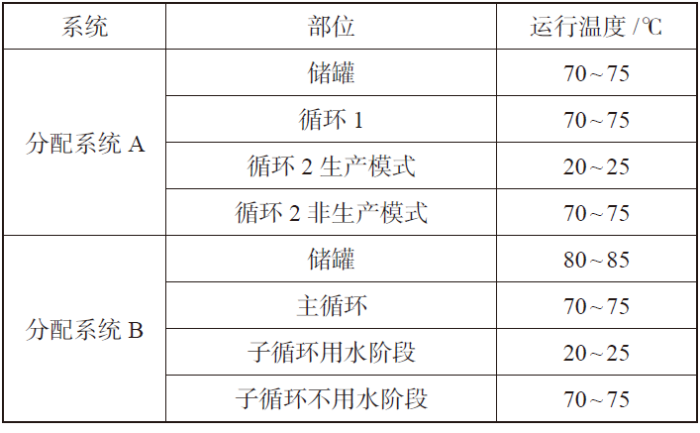
表2 案例分配系统温度
分配系统A 包括高温循环1 和常温循环2(冷和再热循环)和两个平行并列循环管路,共用一个热存储罐。高温热循环1 全部是热使用点(70~75 ℃)。常温循环2 全部是冷使用点(20~25 ℃),我们设计生产模式和非生产两种模式,生产模式下供水温度自动降到20~25 ℃,而且通过比例调节阀,循环中有20%~30% 的常温注射用水回储罐再热消毒;在非生产模式下系统自动升温到70~75 ℃循环。系统流程如图2 所示。
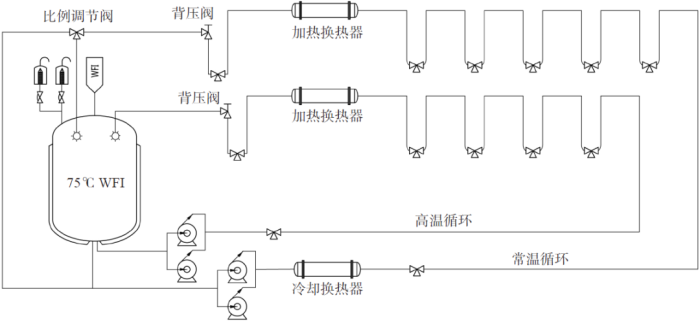
图2 案例分配系统A
分配系统B 包括热分配+ 冷子循环和一个热存储罐。分配系统包含若干个热使用点、若干个单点冷却使用点、3 个子循环(Sub-loop)。每个子循环又有若干个冷用点,其中一个使用点用水时,子循环温度降到20~25 ℃,除了使用点用水,有一定量的常温水回到主循环。这个系统的主管路较长,且主管水温会受到各个子循环低温影响,为保证主管回水温度高于70 ℃,通过模拟计算,确定了储罐温度为80~85 ℃。系统流程如图3 所示。
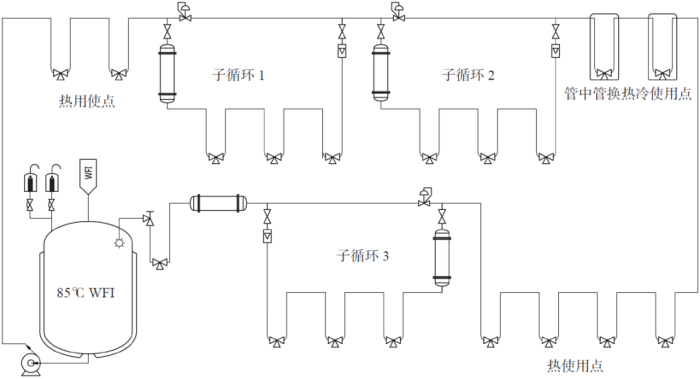
图3 案例分配系统B
Part
2
合理的流速既要保证分配系统内:(1)流速应该达到湍流以控制微生物的滋生。(2)系统供水能力要满足在最大用水量时管路内不形成负压。ISPE指南《水系统》(2019)第8.6.2 :“常温分配管道中的最低流速按0.9 m/s(或3 ft/s)设计已经过时。现在的趋势是基于雷诺数的较低流速下的湍流是可接受的” [5]。
雷诺数计算公式为:
Re = ν · d · ρ/μ
其中 ν —— 管道流速, m/s ;
d——管道直径, m ;
ρ——流体密度, kg/m3 ;
μ——动力黏度, Pa · s
通常雷诺数大于4 000 即达到湍流状态,雷诺数大于10 000 即达到完全湍流状态,0.9 m/s 条件下的雷诺数远远超过了湍流临界值,过大的流速也会带来流动摩擦损失。我们做了不同管径、流速、温度下的雷诺数计算表格,从表中可以看出,同一管道规格、同一流速下,温度变化对雷诺数变化很大(主要是动力黏度变化)可以作为设计复核的参考,见表3。
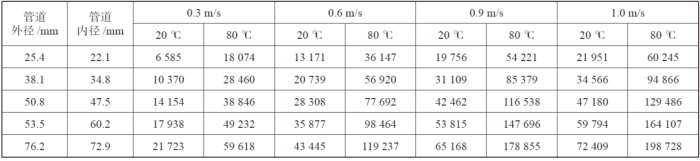
表3 不同管径、流速、温度下的雷诺数
在具体工程设计中,需要设定回水总管、子循环或支路的雷诺数下限值和流速下限值,然后综合计算、平衡;尤其是子循环系统,允许在上游使用点用水时,下游使用点短时间的低流速和常温。如案例B,我们设计的条件是:
(1)主循环流速≥ 0.9 m/s 且雷诺数大于28 000 ;
(2)子循环不用水时流速≥ 0.9 m/s 且雷诺数大于28 000(水温≥70 ℃);
(3)子循环用水时使用点后的管道流速≥ 0.3 m/s 且雷诺数≥10000(水温20~25 ℃);
设计时要用软件或表格模拟和校核系统流量、流速、温度、雷诺数,图4 是以案例B 用水量最大时的工况模拟计算的。
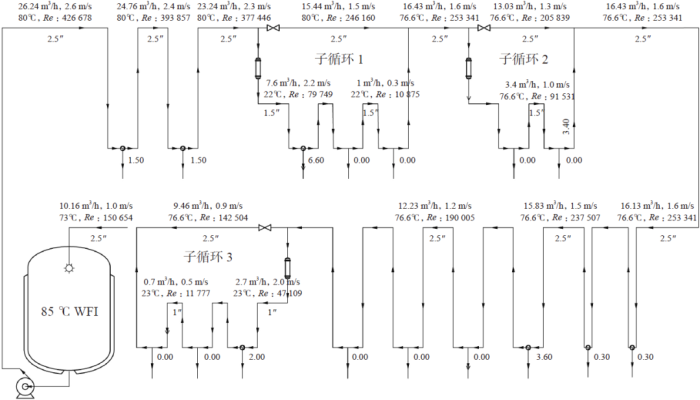
图4 案例B的流量/流速/温度/雷诺数校核图
Part
3
上述设计温度、流速是基于风险分析基础上更适合工艺的精准设计策略,在工程设计中通过对系统部件进行合理的设计和选型,最大限度降低运行问题和微生物风险,做了对比分析,具体见表4。
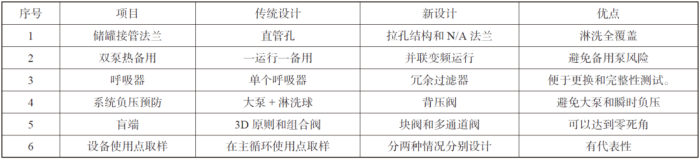
表4 系统部件设计优化
Part
4
取样点位置首先要考虑取样的代表性,其次要考虑排水、取样口位置、取样环境等。对于设备使用点取样点设计的原则:要取到从分配主管到工艺使用点的末端,使用点取样应该取到工艺使用点的管路上流经所有部件和表面的注射用水。ISPE 指南《制药用水、蒸汽、工艺气体取样》(2016) [6] 和《关键公用系统GMP 符合性》(2020) [7] 都对取样代表性进行了详细阐述。
对于连接工艺设备的使用点,很多案例是统一按图5a 设计,这是不符合上述要求的,应该分两种情况来设计:a. 使用点最短管道直连设备,可以在主管用点阀门上取样;b. 使用点较长管道连接设备,必须在靠近工艺设备处取样,同时配套吹扫、排尽的设计,如图5b。
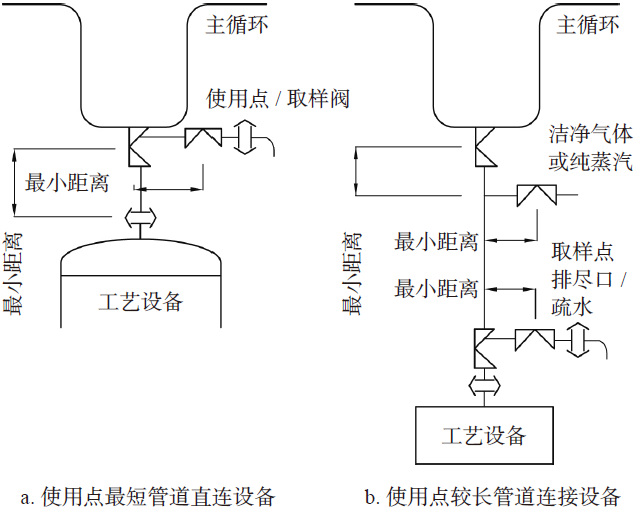
图5 设备使用点取样点
Part
5
传统使用点阀门以手动阀门为主,存在不能按用水计划有序开启、关闭使用点阀门和放水量不准确的弊端。为了有计划用水、精确用水和自动控制,我们设计了自动控制系统,除了系统参数采集与执行机构的控制外,还与工艺自控系统连锁,实现工艺使用点阀门定时、定量控制。操作员工可通过现场人机界面或操作员站发出用水请求或发起工艺控制步骤。系统架构图如图6所示。
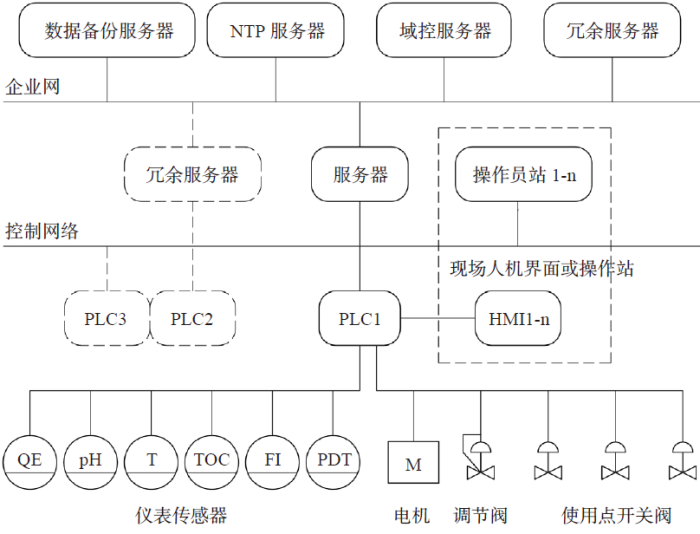
图6 分配系统自控架构图
远程的控制系统按照“计算机化系统”设计、建造、验证和运行,达到电子签名和电子记录的要求,可以释放现场巡检抄表的劳动力,降低人工记录的“数据完整性”风险。
Part
6
注射用水分配系统的设计、建造要满足使用点需求和保证水质稳定,并最小化微生物生长的环境和条件;要研究国内外的药典、GMP 规范和相关参考指南和最新工程实践,循环温度、流速、系统部件、取样和控制系统等方面是设计重点,通过上述设计探讨,可以得出以下结论:
(1)分配系统循环温度不仅仅局限于“注射用水可采用70 ℃以上保温循环”,可以根据需求,构建不同系统,如高温存储常温循环、子循环等各种组合方式。
(2)分配系统的最低流速按0.9m/s(/或3ft/s)设计已经过时,基于雷诺数的较低流速下的湍流是可接受的,如子循环系统,允许在上游用点使用水时,下游使用点短时间的低流速和常温。
(3)分配系统部件需要进行合理的设计和选型,最大限度降低运行问题和微生物风险,如采用冗余呼吸器、双泵运行和背压阀等。
(4)工艺设备使用点取样应该取到工艺用点的管路上流经所有部件和表面的注射用水,尤其是使用点较长管道连接设备,必须在靠近工艺设备处取样。
(5)控制系统可与工艺自控系统连锁,实现工艺用点阀门定时、定量控制。控制系统的要达到“计算机化系统”的电子签名和电子记录的要求,降低人工记录的“数据完整性”风险。
参考文献
[1] 国家药品监督管理局. 药品生产质量规范(2010 修订)[S].2010.
[2] 中国药典委员会. 中国药典[S]. 2020.
[3] European Commission. EU GMP Annex 1 Manufacture of SterileMedicinal Products[S]. 2008 .
[4] FDA. Guide to Inspections of High Purity Water Systems[S].1993.
[5] ISPE. Water and Steam Systems[S]. 2019.
[6] ISPE. Sampling for Pharmaceutical Water, Steam, and ProcessGases[S]. 2016.
[7] ISPE. critical utility GMP compliance[S]. 2020.
内容来源:制药工艺与装备
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
拜耳这波数字化操作,直接解放全自动片剂生产车间劳动力!
2025-11-18
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多