注射剂项目研发生产策略全解析(三):研发策略制定
依据《注射剂项目研发生产策略全解析》中(第一篇处方前研究),确定的参比制剂、附带溶剂和配件(若有)、仿制规格、包材及原辅料信息,提前购买参比制剂、国内通过一致性评价(或视同通过一致性评价)的制剂及原辅料,需要获得其COA、质量标准,原辅料需要获得合成路线、杂质谱及元素杂质等信息。
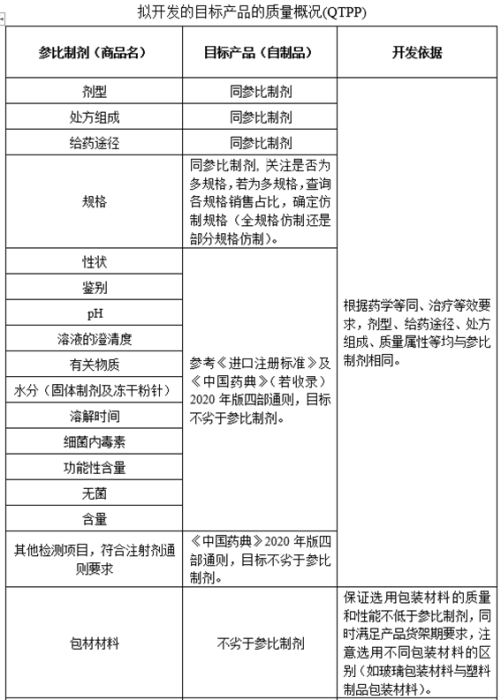
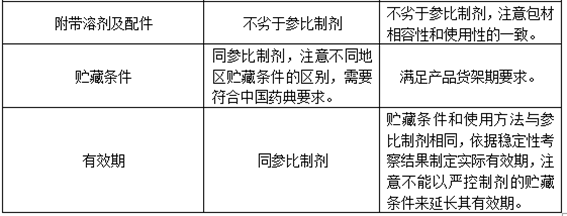
本文带大家通过查询药典、法规及参比制剂资料等信息,确定原辅料、包材及制剂标准,形成目标产品质量概况(QTPP)。
根据《注射剂项目研发生产策略全解析》中(第一篇处方前研究)查询的原料药相关信息,购买他们的物料小样(多厂家购买,数量够原辅料相容即可),如可能,索要原料供应商资料,作为参考。
查询参比制剂上市国、主流国家(美、欧、日)及中国药典,药物在线标准数据库(功能强大,强烈推荐)。
查询到的资料需要参考ICH、国内等各类法规,最终确定不低于中国药典且制备的制剂不次于参比制剂的标准。
对比中国药典标准(若收录)、国内各厂家标准、主流国家药典标准(美、欧、日)及参比制剂研发上市国药典标准(该标准与参比制剂所用标准可能一致),同时依据ICH、国内等各类最新法规,确定原料药重点关注内容,和选用的原料药厂家提前交流进行限度控制,减少后续不确定性。
颜色,若制剂的制备工艺无改变成品颜色的功能(使用活性炭吸附已不被认可),则选用不低于参比制剂颜色的原料药;
外观形态,与不同晶型可能有关,直接影响溶解度,尽可能选择与参比制剂研发上市国药典标准一致的原料药,若不一致,则需要检测其晶型和溶解度;
溶解性能,与原料药构型有关,尽可能选择与参比制剂研发上市国药典标准一致的原料药;
比旋度,对同一物质是一个常数,尽可选择与参比制剂研发上市国药典标准一致的原料药;
鉴别,目的是依据药物的组成、结构与性质通过化学反应、仪器分析或测定物理常数(结合性状项下的外观和物理常数)来判断药物的真伪,确定为同一物质即可,不用过分关注。
酸碱度,需要特别关注,特别是正常生产多批投料时,原料药酸碱度不同时需要不同量pH调节剂进行调节;
有关物质,有关物质主要是在生产过程中带入的起始原料、中间体、聚合体、副反应产物,以及贮藏过程中的降解产物等,结合Q3A(R2):新原料药中的杂质及Q3B(R2):新药制剂中的杂质等标准,需要特别关注原料药的杂质谱及限度指标,不次于参比制剂;
干燥失重,指待测物品在规定的条件下,经干燥至恒重后所减少的重量,注意多批次干燥失重的数据,干燥失重数据偏差过大会影响原料药的稳定性;
重金属,指在规定实验条件下能与硫代乙酰胺或硫化钠作用显色的金属杂质,特别关注制剂成分中是否与金属杂质进行螯合或其他反应,若有,重点控制其限度;
含量,物质中所包含的某种成分的量,特别关注原料药中带有结合水、盐基等成分,注意投料准确性及多批次含量数据;
类别,原料药分类涉及制剂药品分类,结合ATC分类用于共线生产评估及确定生产线适用性;
贮藏,药品的稳定性不仅与其自身的性质有关,还与外界温、湿、气体及包装材料有关,特别关注自研制剂的贮藏方式不应严于参比制剂;
残留溶剂,指在原料药生产中使用的,但在工艺过程中未能完全去除的有机溶剂,在常规剂型制备工艺中很少有去除残留溶剂措施,结合Q3C(R8):杂质:残留溶剂的指导原则,控制原辅料残留溶剂不高于制剂标准;
元素杂质,药品中的元素杂质有多种来源;它们可能是在合成中有意添加的催化剂的残留,也可能是实际存在的杂质(如:与生产设备或包装系统相互作用产生的杂质或药品各个组分中存在的杂质),结合元素杂质指导原则Q3D(R2),控制原辅包、生产设备及注射用水等多途径的元素杂质不高于制剂标准;
细菌内毒素,是G-菌细胞壁的脂多糖成分,于细菌死亡解体后释放,适量时可激活免疫系统,对机体产生有益作用,过量则可引起机体严重的病理生理反应,表现为发热、低血压、心动过速、休克、多器官功能衰竭甚至死亡,控制原辅包、生产设备及注射用水等多途径的细菌内毒素不高于制剂标准;
微生物限度,微生物包括:细菌、病毒、真菌以及一些小型的原生生物、显微藻类等在内的一大类生物群体,它个体微小,与人类关系密切。微生物限度检查法系检查非规定灭菌制剂及其原料、辅料受微生物污染程度的方法。检查项目包括细菌数、霉菌数、酵母菌数及控制菌检查;关注非最终灭菌产品及最终灭菌产品的法规控制限度;
附带溶剂和配件(若有),不低于参比制剂标准,注意其相容性及使用性。
控制标准不低于国家药包字YBB标准,关注玻璃包材和塑料制品包材的相互替换,注意透水透氧率等不一致的指标。
查询药智数据库、各国药典,参考ICHQ3a、国内相关法规,对比分析,目的是查寻原研药、国内厂家(近期获批的)的制剂标准。
本篇《注射剂项目研发生产策略全解析》中(第三篇研发策略制定),通过查询药典、法规及参比制剂资料等信息,确定原辅料、包材及制剂标准,形成目标产品质量概况(QTPP),为后期制定实验计划提供相关依据。
1、https://db.yaozh.com/(药智数据库,很全面,90%以上的资料都有)
2、https://xueshu.baidu.com/(百度学术,查制剂的文献资料等)
3、https://www.baidu.com/(百度,查上市历史、销售数据等)
4、https://www.drugfuture.com/pmda/(日本上市药品数据库,查处方、说明书等)
5、https://db.ouryao.com/(中国药典、法规及标准,查药品及检测标准等)
6、https://www.cde.org.cn/(国家药品监督管理局药品审评中心,查原辅料上市信息及指导原则等)
7、https://www.canbigou.com/directory.html(参比购,查参比制剂目录)
8、https://www.drugfuture.com/fda/(美国FDA药品数据库(U.S. FDA Drugs Database),查处方、说明书等)
9、https://www.drugfuture.com/ema/(欧盟EMA药品数据库,查处方、说明书等)
10、https://drugx.cn/(药研导航,查各国药监局及药典等)
《注射剂项目研发生产策略全解析》中(第一篇处方前研究)及(第三篇研发策略制定),确定了参比制剂、附带溶剂和配件(若有)、仿制规格、包材及原辅料信息,通过查询药典、法规及参比制剂资料等信息,确定原辅料、包材及制剂标准,形成了目标产品质量概况(QTPP)。
本文带大家通过查询药典及参比制剂资料等信息,系统的分析原辅料和制剂的物理、化学、生物及微生物性质,为后期的小试开发工艺参数提供依据。
(3)购买原料药小样(多厂家购买,数量够原辅料相容即可),询问其要原料药全套资料,包括原料药性质、杂质谱、元素杂质及致突变等资料。
(4)参比制剂资料中关于原料药的信息,如美国的review、日本的IF文件、欧洲的审评报告等资料。
(5)百度学术、中国知网、PubChem及药智网等网站;
常规剂型的考察项目通常包括:性状(外观、旋光度或比旋度等)、酸碱度、溶液的澄清度与颜色、杂质(工艺杂质、降解产物等)、对映异构体、晶型、粒度、干燥失重/水分、含量等。
特殊剂型的考察项目包括:黏度、分子量及分子量分布等。
无菌制剂的考察项目通常包括:细菌内毒素/热原、无菌等。
(1)性状(外观、旋光度或比旋度等),与产品的安全性及有效性相关,性状的改变间接显示出产品质量或生产工艺的改变,性状控制不低于中国药典标准且符合制剂使用要求;
(2)酸碱度,影响产品的稳定性,进而影响产品的安全性和有效性,酸碱度控制不低于中国药典标准且符合制剂使用要求;
(3)溶液的澄清度与颜色,影响产品的安全性和有效性,溶液的澄清度与颜色控制不低于中国药典标准且符合制剂使用要求,若易受光、热、氧等条件影响,先控制使用中环境条件,若控制效果不理想,需对其内控收紧限度;
(4)杂质(工艺杂质、降解产物等),影响产品的安全性和有效性,区分杂质类别及性质,结合Q3A(R2):新原料药中的杂质及Q3B(R2):新药制剂中的杂质等标准分析,杂质需符合中国药典,若易受光、热、氧等条件影响,先控制使用中环境条件,若控制效果不理想,需对其内控收紧限度;
(5)对映异构体,对映异构体的改变间接显示出产品质量或生产工艺的改变,进而影响制剂的安全性和有效性,对映异构体控制不低于中国药典标准且符合制剂使用要求;
(6)晶型,影响产品的溶解度及溶出度等,进而直接影响产品的安全性和有效性,晶型控制不低于中国药典标准且符合制剂使用要求;
(7)粒度,影响物料的溶解性,进而直接影响产品的安全性和有效性,粒度控制不低于中国药典标准且符合制剂使用要求;
(8)干燥失重/水分,原料药含有较大量的水分时,不仅使其含量降低,还会引起水解或发生变质,从而使药物失效,进而直接影响产品的安全性和有效性,干燥失重/水分控制不低于中国药典标准且符合制剂使用要求;
(9)含量,含量影响投料准确性,含量过低直接影响产品的安全性和有效性,含量控制不低于中国药典标准且符合制剂使用要求;
(10)黏度、分子量及分子量分布,控制不低于中国药典标准(若收录)且符合制剂使用要求;
(11)细菌内毒素/热原,直接影响产品的安全性和有效性,控制原辅包、生产设备及注射用水等多途径的细菌内毒素不高于制剂标准,尽量形成细菌内毒素/热原控制策略,若形不成细菌内毒素/热原控制策略则需要对原料药或制剂进行内控,细菌内毒素/热原控制不低于中国药典标准且符合制剂使用要求;
(12)无菌,直接影响产品的安全性和有效性,有无菌检查项的制剂控制原料药的无菌,无菌控制不低于中国药典标准且符合制剂使用要求;
(1)购买原料药小样(多厂家购买,数量够原辅料相容即可),询问其要原料药全套资料,包括原料药性质、杂质谱、元素杂质及致突变等资料。(重点关注)
(2)参比制剂资料中关于原料药的信息,如美国的review、日本的IF文件、欧洲的审评报告等资料。(重点关注)
(3)百度学术、中国知网、PubChem及药智网等网站;
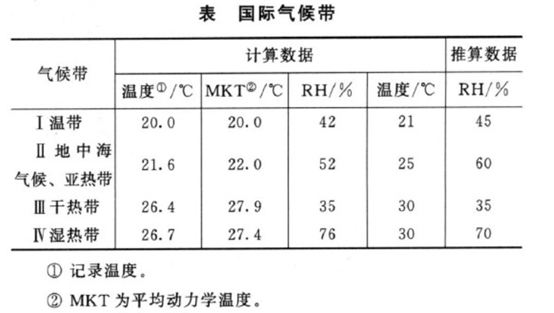
中国总体来说属亚热带,部分地区属湿热带,故长期试验采用温度为25℃±2℃、相对湿度为60%±5%,或温度30℃±2℃、相对湿度65%±5%,与美、日、欧国际协调委员会(ICH)采用条件基本是一致的。
原料药物进行加速试验与长期试验所用包装应釆用模拟小桶,但所用材料与封装条件应与大桶一致。
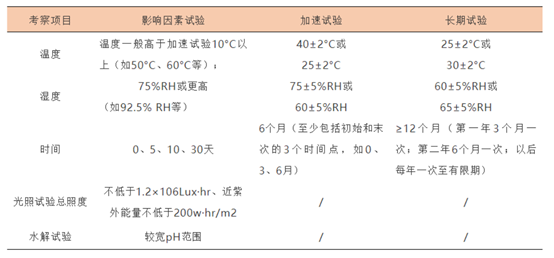
(4)稳定性试验包括影响因素试验、加速试验与长期试验。影响因素试验用1批原料药物进行;如果试验结果不明确,则应加试2个批次样品。生物制品应直接使用3个批次。加速试验与长期试验要求用3批供试品进行。
(5)原料药物供试品应是一定规模生产的。供试品量相当于制剂稳定性试验所要求的批量,原料药物合成工艺路线、方法、步骤应与大生产一致。药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。每批放大试验的规模,至少是中试规模。大体积包装的制剂,如静脉输液等,每批放大规模的数量通常应为各项试验所需总量的10倍。特殊品种、特殊剂型所需数量,根据情况另定。
(6)加速试验与长期试验所用供试品的包装应与拟上市产品一致。
(7)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。在稳定性试验中,应重视降解产物的检查。
(8)若放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速试验与长期稳定性试验。
(9)对包装在有通透性容器内的药物制剂应当考虑药物的湿敏感性或可能的溶剂损失。
(1)外观、物理常数、功能试验,外观、物理常数、功能试验(如颜色、粘度、硬度等指标)稳定性过程中应符合规定,若超过标准限度要求,通常被定义为“显著变化”,不可被接受;
(2)降解产物,降解产物(即有关物质)稳定性过程中增长速度应不高于参比制剂,若降解产物(即有关物质)超过标准限度要求,通常被定义为“显著变化”,不可被接受;
(3)pH值,pH值稳定性过程中应符合规定,若超过标准限度要求,通常被定义为“显著变化”,不可被接受;
(4)含量,含量与初始值相差5%;或釆用生物或免疫法测定时效价不符合规定,通常被定义为“显著变化”,不可被接受;
辅料性质查询方式同原料药一致,重点关注抗氧剂、抑菌剂等特殊辅料性质;
辅料性质汇总同原料药一致,重点关注抗氧剂、抑菌剂等特殊辅料性质;
辅料性质解析同原料药一致,重点关注抗氧剂、抑菌剂等特殊辅料性质;
辅料稳定性查询同原料药一致,重点关注抗氧剂、抑菌剂等特殊辅料稳定性;
辅料稳定性汇总同原料药一致,重点关注抗氧剂、抑菌剂等特殊辅料稳定性;
辅料稳定性汇总同原料药一致,重点关注抗氧剂、抑菌剂等特殊辅料稳定性;
制剂性质查询方式同原料药一致,重点关注特殊剂型如滴眼剂、胶束等特殊制剂;
制剂性质汇总同原料药一致,重点关注特殊剂型如滴眼剂、胶束等特殊制剂;
制剂性质解析同原料药一致,重点关注特殊剂型如滴眼剂、胶束等特殊制剂;
制剂稳定性查询同原料药一致,重点关注特殊剂型如滴眼剂、胶束等特殊制剂;
制剂稳定性汇总同原料药一致,重点关注特殊剂型如滴眼剂、胶束等特殊制剂;
制剂稳定性解析同原料药一致,重点关注特殊剂型如滴眼剂、胶束等特殊制剂;
附带溶剂及配件性质不劣于参比制剂,信息处理方式同制剂一致;
本篇通过查询药典及参比制剂资料等信息,系统的分析了《注射剂项目研发生产策略全解析》中(原辅料性质及制剂稳定性),深入了解了其物理、化学、生物及微生物性质及稳定性,为后期的小试开发工艺参数提供依据。
1、https://db.yaozh.com/(药智数据库,很全面,90%以上的资料都有)
2、https://xueshu.baidu.com/(百度学术,查制剂的文献资料等)
3、https://www.baidu.com/(百度,查上市历史、销售数据等)
4、https://www.drugfuture.com/pmda/(日本上市药品数据库,查处方、说明书等)
5、https://db.ouryao.com/(中国药典、法规及标准,查药品及检测标准等)
6、https://www.cde.org.cn/(国家药品监督管理局药品审评中心,查原辅料上市信息及指导原则等)
7、https://www.canbigou.com/directory.html(参比购,查参比制剂目录)
8、https://www.drugfuture.com/fda/(美国FDA药品数据库(U.S. FDA Drugs Database),查处方、说明书等)
9、https://www.drugfuture.com/ema/(欧盟EMA药品数据库,查处方、说明书等)
10、https://drugx.cn/(药研导航,查各国药监局及药典等)
-END-
内容来源:药事纵横
责任编辑:胡静 审核人:何发














评论
加载更多