中药口服固体制剂连续制造技术应用现状、趋势与挑战
《中医药发展战略规划纲要(2016—2030 年)》提出“到2030 年,中医药工业智能化水平迈上新台阶”的发展目标,并将“促进中药工业转型升级,推进中药工业数字化、网络化、智能化建设,加强技术集成和工艺创新,提升中药装备制造水平”列为重要任务。然而,目前我国中药行业生产工艺水平与国际领先技术仍然有较大差距,中药制药装备自动化程度较低,制造过程以落后的单元操作为主[1],数据显示,2014 年到2020 年,我国大健康产业整体营收规模超过7 万亿元[2],但现有整体技术水平仍停留在工业2.0 阶段,中药高质量制造需要产业技术和装备升级,中药制药行业面临新的机遇和挑战。
连续制造(continuous manufacturing,CM)是指物料连续地投入并在工艺中完成转换,同时加工后的物料被连续地从系统中移除,其作为一种先进的生产模式,具有提高生产效率并降低成本的显著优势,在汽车、食品、石油化工等行业已成功应用多年,但在制药领域中的发展仍相对缓慢[3]。2022年11 月16 日,国际人用药品注册技术协调会 (The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)发布《Q13:原料药与制剂的连续制造》指南的最终采纳版本,在该指南中,连续制造范围涉及生产过程中输入物料的持续投料,物料的持续转化,以及输出物料的同步去除。目前,我国中药制剂生产仍以传统批量制造模式为主,与传统模式相比,连续制造通过将各个单元生产环节组合为连续生产线,借助过程分析技术(processanalytical technology,PAT)实现了许多优势:仅需较小的生产场地、生产灵活迅速、过程质量实时可控、绿色智能化程度高,在经济效益建模中成本相比传统制造降低了55%[4]。将连续制造技术与我国中药制药相结合,不仅有助于中药制药行业发展转型,更有利于我国从中药大国迈向中药强国。
虽然连续制造相比传统制造存在诸多优点,见图1,但全球范围内应用连续制造技术生产商品化药品的制药企业仍较少,国内外现已上市品种均为口服固体制剂,多采取连续制造工艺与批次生产组合的“单元连续”或“半连续”方式进行生产,与其他类型的制剂(例如液体、注射剂等)相比,固体口服制剂的生产过程更容易实现自动化和数字化控制,物理和化学特性相对稳定并具有良好的耐储存性能,实现难度也更小。
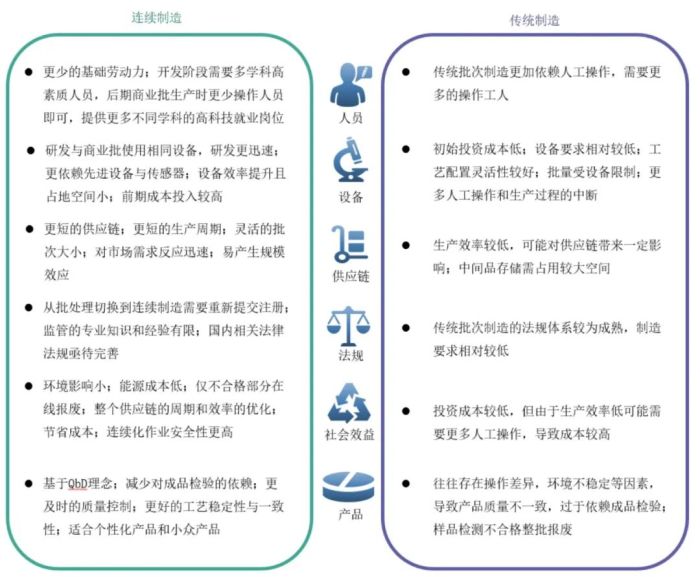
图1 连续制造与传统制造模式对比
Part
1
制造业实行连续制造可以追溯到工业革命时期,随着现代科技发展,石油化工、制浆造纸、食品烹饪等行业应用连续制造技术已较为常见,制药行业由于法规监管的特殊性及对药品质量的严格要求,新技术、新装备的使用仍然较为缓慢,但研究人员对于连续制造的探索从未停止。
美国一直以来积极探索CM 在制药中的应用,将药品连续生产认定为国家重点技术,美国食品药品监督管理局(FDA)将原料药与药品的连续制造列为公认的新兴技术名单[5],2016 年美国国会通过法案授权卫生与公众服务部部长可向高等教育机构和非营利组织拨款,以研究和建议改进药品和生物制品的连续生产过程以及类似的创新监测和控制技术[6]。CM 被认为接近于FDA 在2004 年发表的《药品制造的创新和持续改进》[7]中描述的药品制造“理想状态”,贯彻了FDA 一直倡导的质量源于设计(quality by design,QbD)理念。为帮助实施创新制药技术,FDA 创建了新兴技术团队(emerging technology team,ETT)和生物制品评价与研究中心先进技术小组(CBER advanced technology team,CATT),2018 年美国药典委员会(US Pharmacopeia,USP)发布《药品连续生产的USP 视角》,内容涉及CM 中的术语和定义、批量定义、控制策略、风险管理、PAT、监管预期等方面。同时其他发达国家和地区也成立了专注药品制造现代化、关注连续制造的产学研联盟,例如药品连续制造技术知识中心(美国)、结构化有机颗粒系统工程研究中心(美国)、诺华-麻省理工学院连续制造研究中心(美国)、连续制造和先进结晶中心(英国)、合成和固态制药中心(爱尔兰)、制药工程研究中心(奥地利)。
我国积极投入CM 的研究与实践中,2021 年10 月,国家药品监督管理局药品审评中心公开向社会征求ICH 指导原则《Q13:原料药和制剂的连续制造》意见[8],并于2023 年3 月20 日发布《化药口服固体制剂连续制造技术指导原则(试行)》[9]使得该进程向前更进一步,国内暂无中药连续制造相关指导原则与品种审批,相关政策亟待建设完善。目前批准的连续化生产品种多为单一制剂产品。
目前,全球已有12 款使用CM 生产的药物获批,见表1,FDA2022 年审计表明,与传统批处理方式相比,CM 药品评审时间平均快9 个月,批准和上市时间较短,这意味着收益的增多和快速占领市场[10]。其剂型与生产工艺集中在口服固体制剂产品,这体现了连续制造在口服固体制剂中的应用潜力。
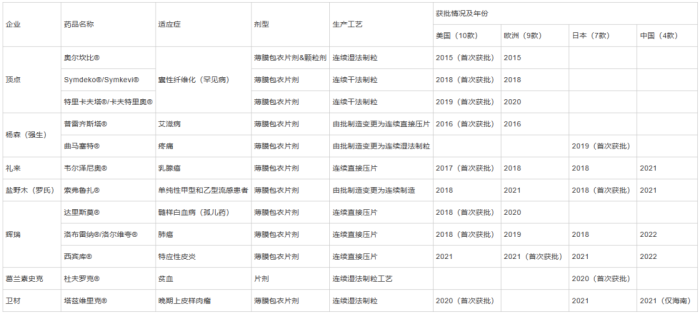
表1近年来使用连续工艺生产的企业与获批药物
Part
2
中药是中医药事业传承和发展的重要载体,升级中药制造模式、提升中药生产效能对于推动中药产业高质量发展至关重要。随着我国新版《药品管理法》于2019 年颁布实施,国家大力推动完善中药全过程质量控制体系,构建中药全过程质量追溯体系,一方面遵循以临床价值为导向的原则,另一方面强调重视“QbD”“全过程质量控制”等理念,指导中药生产企业更加有效地控制药品质量。
2.1
中药制剂生产过程管理
随着国内疫情政策的调整,药品的可及性问题突出,依赖传统设备的生产模式正暴露出越来越多的问题,例如设备性能发挥较为依赖员工;关键设备容量大小桎梏生产批量;提升产量依赖人员加班加点。目前我国中药制剂的主要生产模式为批次间断生产,即通过单元式设备,在完成每一单元生产步骤后由操作人员对中间品进行离线检验,期间物料暂存于设备内或暂存间,结果合格后放行至下一环节,重复过程直至形成最终产品,通常耗时1 周以上,不仅时间漫长,繁琐重复的过程也带来了质量管理风险隐患,在CM 中,可通过4 种主要方式定义生产批量:①输出物料量;②输入物料量;③规定的质量流量下的运行时间;④基于CM 工艺特征的科学合理方法[8],企业可通过运行时间定义批次和批量使中试至商业化过程变得简单,使用连续化设备自动转移物料缩短供应链,通过改变设备运行时间、增加质量流量或增加设备等方式来增加产量,通过停留时间分布(residence time distribution,RTD)确定分流和收集时间,并可用于追溯物料,助力中药生产的全过程质量管理。
2.2
中药制剂产品质量管理
中药全过程质量控制强调从药材源头入手,传统生产过程常年对于不同批次饮片使用相同的工艺参数进行生产,中间品检验依赖水分、密度等单一指标,对于多组分、多靶点的中药制剂来说,难以有效地在过程中发现质量风险隐患,从而过于依赖成品检验确定制剂质量好坏,在使用随机化控制试验设计的中药研发方案中,多重视考察工艺参数的变化,较少考虑关键物料属性与关键工艺参数(critical process parameters, CPPs),关键质量属性(critical quality attributes, CQAs)之间的交互[11]。使用CM 可以大幅改善这种局面,通过在关键工艺点使用PAT 监测生产过程中的CQAs,利用反馈和前馈回路系统自主控制CPPs,以保证过程和最终的产品CQAs 在规定范围内,管理者在生产过程中能够实时掌握过程数据,系统的自主决策减少了人工干预,并可利用积累的生产数据持续优化工艺,改善中药制剂质量。
2.3
建立符合中药特点的连续制造技术体系
与化学药品多采用规定固定工艺参数的模式不同,中药原料的质量波动性较大,生产中的关键工艺参数和质量属性应保持在经优化验证的设计空间内,并非稳定不变。中药复方工艺对物料等输入性因素过度严格控制可能会造成适得其反的结果[12],中药连续制造技术体系需要考虑中药制剂的特点,包括中药的复杂组成、药效成分的多样性和易挥发性等。同时对投入物料的控制、过程检测、物料的分离和收集能力、数据处理和分析能力、稳定性能力具有一定要求,因此,建立符合中药特点的连续制造技术体系可从以下部分考虑:
①连续化改造,特别是中药制药装备自动化与单元智能化设备程度低的环节(如药材前处理)重点突破、积累关键工序的共性技术方法(如算法、建模、PAT 等)。
②良好的控制策略,解决在线检测技术没有和工艺、设备有效结合的现实问题,实现制造过程中的产品可追溯性、开发中药连续制造其中的一个关键就在于对过程动力学的理解[13],常见的方法是通过各个工序或整体生产系统的RTD 来描述物料从进入到离开所需的时间分布情况,该函数可以用数学模型进行建模和预测,并作为取样和追溯物料的依据,这对于设计连续生产工艺的控制策略至关重要。
③质量预测技术,通过建立实时数据库并结合历史数据库和知识库(如中药物料属性数据库)进行实时过程监控、诊断和优化,并对不断更新和积累的质量大数据进行重复利用和深度挖掘,实现质量追溯、工艺优化、设备运行优化等任务,最终实现提前预测质量变化趋势,变被动防御为主动预防。
Part
3
QbD 理念的贯彻实施离不开良好的控制策略[14],越来越多的企业借助连续制造关键技术实现良好的控制策略,进行高效、精确和可持续的生产。
3.1
过程分析技术
过程分析技术被定义[15]为“一个在加工过程中通过及时测量原材料、加工材料和工艺的关键质量和性能属性来设计,分析和控制制造的系统,目的是确保最终产品质量”。主要包括过程认知、过程检测、过程建模、过程控制、持续改进5 个关键技术步骤[16],通过使用光谱传感器和化学计量模型等工具可以实时监控产品质量,使产品符合法规要求。将PAT 纳入工艺监控的控制策略中,通过整合集成各环节数据信息实现对生产过程自动化控制,从而有效保证药品质量稳定。强大的PAT 在线数据和预测性工艺模型,结合基于QbD 的工艺设计,可以实现过程控制的自动化,并实现实时放行检测,而不是靠生产结束后的离线检测。产品的上市时间将会更短,批次问题率将更低,生产率可提高约20%[17]。
现场可编程门阵列作为PAT 的硬件基础,在数据多通道采集和并行处理领域正发挥快速数据处理、高性能、低功耗等技术优势,在诸多领域已被广泛使用,利用其创建实时放行检测是解决中药制药过程中参数混杂问题的重要手段[18],在软件系统层面,有CAMO、Umetrics、Siemens 等知名公司先后推出PAT 软件系统。由于在端到端连续制造过程中需要监控多个过程,PAT 及其实时过程监控功能在确保最终产品质量方面发挥着重要作用。MIYAI Y 等 [19]讨论了在CM 上实施PAT 的策略与试验方法,在合成装置上使用在线傅里叶变换红外和拉曼光谱实时监测环丙沙星中间体和药物活性成分浓度,通过在线模型处理软件和PAT 数据收集和管理软件实现了中间体和产物浓度的实时预测。在水分含量在线监测方面,王晴等[20]利用在线近红外光谱技术,采集样本数据进行建模,实现了用于生产规模的桂枝茯苓胶囊流化床干燥过程水分含量在线监测。
3.2
信息化智能化技术
制造业的转型需要“智能化”赋能,需要信息技术的加持,将生产过程中数据作为基础,发挥大数据优势, 将连续制造与人工智能结合, 目前制药行业应用较为广泛的有生产执行管理系统 (manufacturing execution system,MES)、PDM 研发过程数据集成系统、LIMS 实验信息管理系统等。
数据采集与监视控制系统(supervisory control and data acquisition,SCADA)是结合了软件和硬件的自动化控制系统,可将工艺参数、进料和再加工物料属性以及最终产品质量属性的测量与工艺动态模型相结合,使用这些数据来控制和优化工艺,从而支持实时放行检测,该系统广泛用于石化、自来水输送系统等一系列工业过程中,可实现持续监控过程、实时控制、自动化和保护、远程控制和操作功能。多元统计工艺控制 (multivariate statistical process control, MSPC) 可分析具有潜在相关变量的复杂工艺数据,用于确定工艺中的可变性是否随时间稳定,检测工艺中的异常事件。近年来,陆续有新适用于CM 信息化智能化系统涌现,涉及开发、生产、维护等方面,如薛启隆等[21]完成了以中药真空带式干燥工艺为例的工艺自主决策模型的构建与验证,实现了工艺参数组合自主优化策略发现和最优过程控制路径规划。提高产品质量一致性,降低生产成本,提升企业效益。余雅婷等[22]利用人工智能中的专家系统,输入人类专家的专业知识和经验,用计算机模拟人类专家的思维过程解决药品生产领域问题,于佳琦等[23]以QbD 为基础,将智能工具纳入生产系统中,提出由连续制造、信息集成、智能模拟和智慧应用组成的中药智能制造关键技术体系。萧伟[24]基于目前的生产控制设备和工艺基础,开发来了可用于中药连续制造的过程知识系统,可根据生产数据的持续累计,通过AI 算法计算最佳调控策略以实现产品质量的持续优化。GANESH S 等[25]介绍了一种基于状态的口服固体药物产品维护系统,该系统可主动监测可能导致系统故障或性能出现偏差的情况并阐述了实现该系统所需的系统架构,这对于管理药品生命周期中的过程风险至关重要。国内的浙江海正药业股份有限公司也正积极推进智能制造信息化系统建设,包括MES 系统、SCADA 系统、BI 建设等。MES 系统能自动生成符合《药品生产质量管理规范(2010 年修订)》(good manufacturing practice,GMP)和FDA要求的电子批记录,将制药生产各环节的人员、设备、物料、环境、规程进行有机结合,实现整个生产过程的规范化、电子化、可视化,确保生产数据的可靠性和性。SCADA 系统提供数据监控一体化平台,实现全厂生产设备/系统运行监控。BI 建设使任务操作、设备工况可视化管理,实时反映生产任务完成情况,实时监控设备参数,异常报警。
3.3
虚拟仿真技术
通过VR 虚拟现实、3D 仿真技术等虚拟仿真技术模拟现实环境,将一些不可视的结构和原理可视化,进行信息化与工业化的融合,并通过建立三维仿真模型进行虚拟现实的模拟[26],通过在预设好的软件中更改条件可直观了解工序对产品的影响,该技术具有降低成本、高效安全、易于拓展的特点,对连续制造中可能涉及的工艺、设备改造、人员培训等方面可起到重要作用,其包括仿真目标定义、基础数据收集、仿真建模、仿真分析、仿真优化5 个主要步骤,德国GEA 公司使用VR 展示连续固体制剂生产的运作方式,使每个员工可在设备安装之前接受培训,从典型的9 个月入职时间缩短到仅3 个月,节省了66%的时间[27]。于洋通过采用Aspen Plus 软件对甘草多糖水溶液的浓缩工段进行仿真模拟,使用机械蒸汽压缩技术对传统浓缩工艺进行改造[28]。通过对现阶段工艺仿真模拟、改造工艺和成本节约率的模拟仿真,得到改造后的最佳操作工艺。DAMMACCO L 等[29]将物理世界与虚拟世界高水平连接,提出使用基于虚拟现实技术作为解决复杂制造系统设计问题的设计方法。JELSCHM 等[30]将模型预测控制(model predictive control,MPC)从石油化工行业推广至药物连续制造,MPC 是一类控制算法并依赖于过程模型,能在每个单位的已知时间点预测未来输出物料的质量,在仿真研究中,可在考虑干扰和不确定因素的情况下自动采取纠正措施,使产品质量向期望值方向移动。
Part
4
未来连续制造技术应用于中药生产,从装备开发的角度主要有2 个路径:一是串联现有最先进的单元制造设备,重点解决和突破单元设备之间的物料定量输送问题;二是开发全新的整体连续制造设备,这需要有全新的设备开发思路,有些要突破传统的工艺单元制造设备的理念,从单元设备开始就实现物料的连续化生产。
4.1
单元装备的集成创新
将现有生产设备进行串联改造,可实现部分连续的生产模式,在该模式下,部分单元操作为批生产模式,其他2 个或2 个以上单元操作直接相连为连续模式。考虑到连续制造的投入较大,目前应用该模式较为广泛。
在中药的前处理环节,中药传统提取下开盖的出料方式与双效浓缩方式存在药材利用率低、出料密封圈易老化、现场环境差、生产环境温度高、湿度大等问题。华润江中制药集团使用自动喂料机,采取“吊篮式循环提取”技术,见图2A,实现整条提取线无人化,所有输送设备可冲洗或擦洗,所有输送线均带有接水、接渣的料槽,使得工作环境得到极大改善,药液经管道输送至MVR 浓缩设备,降低能耗、减少污染物的排放,实现低温浓缩。在制粒工序,将制粒、干燥、整粒、混合等功能整合密闭,采用密闭输送及齐墙的方式,使用PAT 等手段掌握生产过程进而主动控制产品关键质量特征,更加符合EHS 管理体系,设备之间可独立操作也可实现批次的连续生产,现有设备如宜春万申制药机械有限公司的高密闭连续制粒线,见图2B,OEB4&OEB5 抗肿瘤制粒线。在中药丸剂的连续化干燥工序,江西赫柏康华制药设备有限公司的中药丸剂连续干燥系统将湿物料自智能离心振动干燥机顶部进料口自动进入,在重力与振动激振力作用下物料做规律性离心运动,同时与自下而上的热空气进行逆流的充分接触,湿热空气经除尘后从排风口排出,而干燥完成的物料自干燥塔底部出料口自动排出,多层逆流干燥降低能耗,连续化的自动进、出料在增高产量的同时避免人员接触物料造成污染。
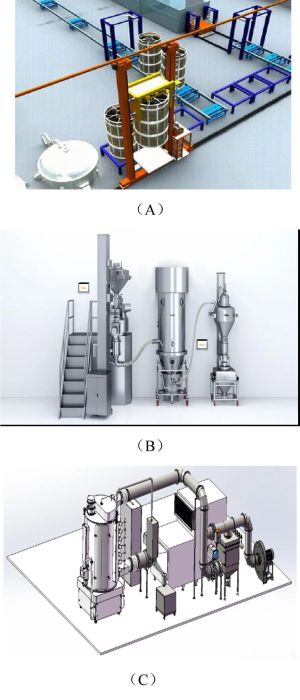
图2 吊篮式循环提取示意图(A)、高密闭连续制粒线(B)、中药丸剂连续干燥系统(C)外观示意图
4.2
新型连续制造装备
设计开发新型连续制药装备,可实现部分连续甚至是全过程连续的生产模式。继GEA Pharma Systems 公司在全球率先推出制药连续制造设备后,设备制造商纷纷跟进,L.B. Bohle 公司推出全连续流化床干燥并建立技术中心,将研发重点从批量生产转移到了连续制造,Glatt、Fette 等其他设备供应商也在连续制造领域推出了相应的产品[31],在平台与系统方面,GLATT 推出了Modcos 连续直接压片系统、L.B. Bohle 推出了QbCon®连续生产系统、SYNTEGON 推出了连续化生产平台Xelum,GEA 推出了ConsiGma® 4.0 连续制造平台,一些固体制剂环节的新型连续制造装备见表2。
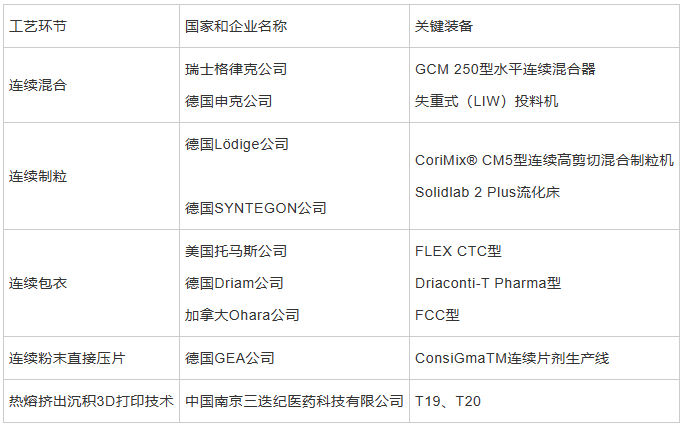
表2固体制剂环节的新型连续制造装备
在中药领域,除了连续逆流提取、连续浓缩、连续醇沉等单元的物料连续化生产,也可考虑单一设备多功能化。以固体制剂中常见的片剂为例,其连续化生产流程见图3。
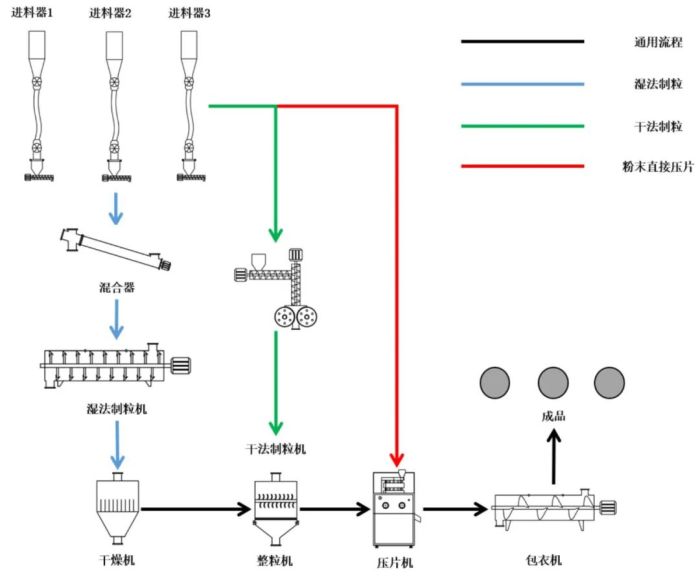
图3 连续化生产片剂制造流程
4.3
关键核心部件
传感器为连续制造中关键核心部件,其适用于组合式连续制造和独立开发连续制造2 种模式,高精度传感器目前多依赖于国外进口,应用较多的PAT 供应商有Bruker、Vaivi、Thermo、Kaiser、Cobalt 等公司,连续制造常用传感器见表3。传感器的数据被用作过程控制策略的一部分,可用于改变参数确保CQAS 保持在可接受的范围内,传感器的放置位置、探针深度和清洁采样面积、取样量和采样频率等都需要经过充分的验证,同时在传感器发生故障时的预防与纠正措施、传感器的校准和维护等策略也需充分考虑,传感器的采样频率是实现实时放行检测的关键,它需要足够快以检测瞬时变化,并能通过收集足够的测量数据进行趋势分析来检测过程漂移,从而根据可靠的统计数据对批次的质量进行分析。
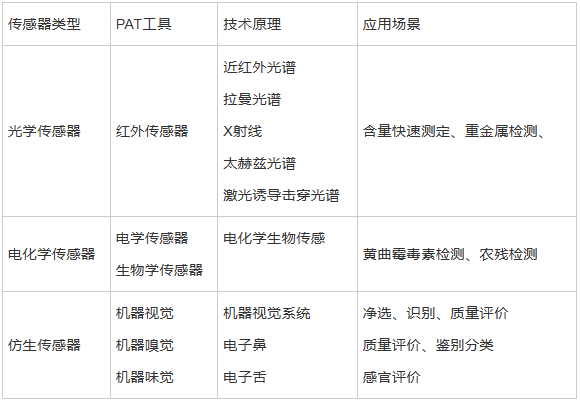
表3连续制造常用传感器
饲料器作为生产过程中的整个物料起始,是产品性能变异的第一来源,其性能在CM 中非常关键,需满足向每个单元输送物料,维持产品的处方量并稳态运行,达到随着时间的推移能够持续提供准确数量的物料,确保过程的稳定性,目前常用设备有失重模式饲料器(loss-in-weight feeders,LIW),其进料速率由螺杆的转速控制,LIW 控制器根据对失重速率的监控来调整进料器速度以获得所需的设定值。
在中药制剂过程中,前处理工序是生产过程的第一道工序,中药材的拣选、清洗、炮制等相关操作均在前处理工序完成。前处理过程的处理结果的好坏,直接影响后工序的提取效果。吴志生团队对于红花染色和掺假问题,结合计算机视觉和近红外,实现了红花的快速无损分析,分析方法快速可靠,为市场红花质量分类标准的制定提供重要参考[32]。通过基于机器视觉的中药药材自动筛选装置,在智能识别系统的基础上,可搭建红参自动化分选平台,改变了传统生产方式,等级分选能力极大提高,增加特等品和一等品的检出量[33]。
Part
5
5.1
政策与监管方面
在监管方面,我国在注册审评、核查检验方面实施连续制造存在经验不足、专业领域人员缺乏等问题,与国际其他监管机构仍有一定的差距,相关监管配套文件如涉及连续制造现场检查、上市后变更等指导文件仍待发布,如何将现行GMP 与连续制造衔接值得思考。在效益方面,中药企业存在连续制造初期投入大、老设备改造难度大、涉及工艺变更周期长、数据服务商可靠性不足等问题,结合近年来我国中药集采的推进,企业对投入后的利润产出存在一定担忧,应提倡业界合作,鼓励药厂在研发或建设阶段申请监管提前介入,广泛听取意见组织开展实地调研交流,深化对先进技术的理解与掌握。
5.2
关键技术与装备
中药产品种类丰富,不同产地、不同季节的中药表现出的特征图谱可能不一致,各类剂型工艺差异较大,加大了中药作为连续化控制的难度,在硬件层面,我国目前的中药制剂设备整体缺乏创新,普遍相互模仿重复。符合中药固体制剂生产特点的设备仍然不足,一些企业将化药设备稍加改进便简单照搬,导致了工艺与设备的适宜性问题;设备迭代缓慢;能实现在线数据采集、导入、处理的自动控制设备较少。在软件层面,国家政策的支持与市场规范管理为中药智能化、自动化升级提供了保障,但在中药固体制剂领域应用人工智能技术、自动化技术、产业数字化的范例仍不多,共性技术开发不足,技术关注点主要集中在下游生产阶段,对于上游的药材种植管理关注不够。国内大部分企业对中药工艺质量规律理解还不充分,对于智能化信息化的理解和数据的利用有待深入,各个生产模块总设备接口不同,未建立设备通信的标准接口协议,企业手握大量生产数据但各个环节之间的数据缺乏流动与分析,当前连续制造的启动阶段物料损耗仍较大,中药浸膏类在线检测器放置位置的选择和探头易污染的问题仍需研究解决。
5.3
新工科制药工程类人才匮乏
中药口服制剂连续制造技术的技术人员培养是一个重要课题,CM 是一种新型的生产工艺,本土制药企业对连续制造工艺具有一定的关注度,但认识不够深入,动力不足,在专业人才、技术储备和仪器设备开发等方面存在实际困难,较为可行的方案是在原有装备的基础上进行一定的技术改造。企业人员面对传统与智能并行的制造双通道模式工作量将增加,从管理层到一线员工都需要加强培训,CM 需要药学、工程、数学、计算机等多领域学科知识专家支持配合,但现有技术人员多为纯药学研究或纯软件开发,缺少复合交叉型人才,高校也未设置相关药品智能制造专业和课程。下一步可考虑高校开设相关课程或与企业进行联合培养,加强技术人员的在职培训,使单一的药学人才转化为复合型人才,加速中药智能制造产业化。
Part
6
《医药工业发展规划指南》提出引导企业推动“制造执行系统”“过程分析技术(PAT)”在生产过程中的应用,整合集成各环节数据信息实现对生产过程自动化控制,有效保证药品质量稳定。2019 年新版《药品管理法》规定,国家鼓励运用现代科学技术和传统中药研究方法开展中药科学技术和药物研究,面对突发疫情,连续制造技术可以有效缩短供应链,保证药物的可及性和有效性。
对于现有批次制造的企业,目前仍然存在设备利用、专业人才缺口以及前期投资较大等挑战。未来制造现场所需人员将大幅减少, 但对技术人员要求更高。先进装备不能解决目前制药行业的所有问题,操作人员需要在项目前期跟进,加强对制药工艺过程和产品质量设计的理解,以便灵活应对生产中可能的出现的状况。我国连续制造发展尚在起步阶段,需要更多不同行业的专家参与进来,无论是企业还是监管机构,在CM 这一新技术的实践上,都需要化学工程、处方开发、建模仿真、流程控制,以及传统药学等领域的多学科复合型人才共同参与,以加快我国中药连续制造技术和装备的发展,推进我国中药产业高质量高效益发展。
参考文献
[1] 杨明,伍振峰,王芳,等.中药制药实现绿色,智能制造的策略与建议[J].中国医药工业杂志,2016,47(9):1205.
撰稿人 | 王子千、王学成、钟志坚、刘振峰、王雅琪、易兵、杨明、朱卫丰、伍振峰
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多