质量风险管理在药品共线生产中应用的研究进展
Part
1
根据《药品生产质量管理规范》(2010 年修订),其第四十六条第1 款中指出,应当综合考虑药品的特性、工艺和预定用途等因素,确定厂房、生产设施和设备多产品共用的可行性,并有评估报告。此外,文件第十三条规定,质量风险管理必须采用前瞻或回顾的方式对产品的生命周期流程进行把控,从审核到沟通,再到最后的控制环节,都应当建立一个流程;文件第十四条规定,质量风险评估需要评估者具备专业的科学知识和较强的风险控制能力,以此来确保产品质量合格;文件第十五条规定,实施质量风险管理时使用的一切措施和方法应当形成文件,文件的级别应与风险等级相对应。
理论上来说,各类品种共线生产,并不是对GMP的违背;只不过,这种生产模式虽可减少企业投资、优化企业管理,却也会带来巨大的质量风险。《药品生产质量管理规范》(2010 年修订)自2011 年执行以来,我国药品生产企业也不断探索质量风险管理的应用模式,并用于风险较高的共线生产的风险评估中。
Part
2
为指导质量风险识别,人用药注册技术要求国际协会于2005 年发布了ICH-Q9(质量风险指导原则);根据国际协会的定义来看,质量风险管理,指的是采用前瞻或回顾的方式对产品的生命周期流程进行把控,从质量风险的评估到控制,再到通报和回顾的具有系统化性质的整个流程[1]。《药品生产质量管理规范》(2010 年修订)中对于质量风险管理的定义是,在整个产品生命周期采用前瞻或回顾的方式,对质量风险进行评估、控制、沟通和审核的系统过程[2]。
根据约定俗成的观念,可以把质量风险管理的流程分为几步:第一步,识别风险;第二步,分析风险;第三步,评价风险;第四步,接受风险。这几个步骤绘成图可以表述如下图(图1)。
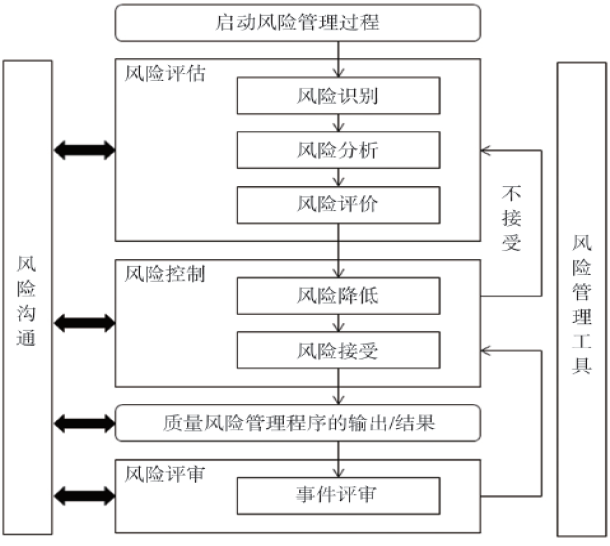
图1 质量风险管理流程
在国内,各个制造企业对质量风险管理都有独特认知,都以自己的方式对质量风险进行管控,只不过,可以真正整个质量风险管理及其管理体系的制造企业并不多[3]。能将其运用自如的企业更是凤毛麟角。
Part
3
质量风险管理方法包括一些正式的风险管理工具;比如,HACCP 法,这一方法的英文名称是HazardAnalysis Critical Control Point,中文翻译为危害分析和关键控制点法;FMEA 法,这一方法的英文名称是“Failure Mode,Effect and Analysis,”中文译为失效模式和影响分析法;而RRF 法的英文名称是“Risk Ranking and Filtering”,中文译为风险排列和过滤法。
3.1
HACCP 法介绍
HACCP 法指的是一种利用合理手段对药品生产的过程进行控制,以识别其来自生物、物理、化学等领域的危害的评估药品质量风险的系统方法。对可能存在危害的工序进行分析,识别CCP(关键控制点)之后,以CCP 为依托,建立与之相关的关键限制,对所有的偏离过程进行监控,一旦发生偏离,立即采取措施进行纠正,值得注意的是,纠正措施要形成文件;此外,还须监视最终结果。HACCP 法在国际上也是通用的,凭借其科学性、灵活性、预防性、前瞻性等特征,这一方法对监控CCP 的关键点及设置与CCP 相关的关键限值有着巨大作用,它可以让人更为直观地了解风险;据此看来,这一管理工具确实可以实现对风险进行定性分析的同时也能进行定量分析。
3.2
FMEA 法介绍
FMEA 法主要是用来分析故障因果;其评估风险的对象是“失效”,基于流程图或者因果关系图,便可以对设计或生产中的故障或潜在故障进行分析,找出故障可能带来的危害,利用与之对应的处理措施解决危害,以避免风险发生。
FMEA 与HACCP 一样,也极具前瞻性,将其应用于生产过程中,可以分析出生产失效相对应的“风险分数”,基于此,风险等级便可确定,根据等级,对风险进行排序,以便进行定量分析。
3.3
RRF 法介绍
RRF 法可以用来排列风险因素并将之一一比较,利用定性定量分析法,对各类风险因素进行反复评价,得出因素权重。使用RRF 法,可以分解每一个风险问题,将其中的风险因素全部列出,根据其属性进行合并,赋予其风险分值,以此作为风险等级划分的依据,基于风险分级,人们便可以进行政策性决策,也可以管理风险。风险排列不是利用RRF列表,就是利用“低/ 中/ 高或1-3”的矩阵图或者,主要是方便全面进行定性定量分析。
Part
4
4.1
HACCP 法的应用
ICHQ 9 中推荐人们使用HACCP 法,据说这一方法的应用能够确保产品的安全性及质量可靠性;相较于其它方法,这是一种具备主动预防性的方法;HACCP 法结构化较为明显,使用HACCP 法,不仅可以对风险进行有效识别并评估,还可以对其进行预防和控制;在产品设计开发及投入生产并使用时,使用HACCP 法也可以评估产品带来的危害。
基于HACVP 法,研究者刘智勇等人[4] 使用风险管理工具分析了抗肿瘤类及激素类化学药品与普通药品共线生产的风险,并对风险因素进行等级划分,研究后最终得出的结论是,药物若要采用阶段性生产模式进行共线生产,必须对所有风险因素进行综合考察,经数据实证之后,制定措施来控制产品共线生产带来的污染风险,将风险控制在可控范围内,便可以进行生产。
HACCP 法目前用于共线生产的评估在国内还并不多见,但是有些研究者已经将其应用于药品生产过程中的质量风险分析中了。
于泳等[5] 通过在氯雷他定片剂质量控制中引入HACCP 风险管理工具,对其配料、制粒、总混、压片、内外包装等生产环节进行了危害分析,找出了关键控制点,建立了关键限值。作者认为HACCP 法可以用来分析氯雷他定片剂生产带来的质量风险,也可以用来分析湿颗粒法生产工艺带来的风险,这一方法的简便易行性,对于药品生产企业更好地执行新版GMP,有效提高产品质量安全水平有很大的帮助。
经过实证分析与理论研究相结合之后,研究者陈芳[6] 发现,中药注射剂的质量风险管理也可以使用HACCP 法,HACCP 是一个高效的质量风险管理工具,在食品领域,HACCP 带来的管理效益和经济效益是有目共睹的;将HACCP 体系应用于中药材生产及中药注射剂临床领域,对整个生产周期内的已知风险都具有可控性。
4.2
FMEA 法的应用
2012 年孙秋莹等[7] 对天津天士力之骄药业有限公司注射用益气复脉(冻干)、注射用丹参多酚酸、注射用盐酸地尔硫卓的中药西药混合共线情况做了评估研究,并将质量风险管理的方法应用其中,使用了FMEA 的方法,识别出了风险点,并对风险点进行了一系列风险降低措施,由此带来的好处是,偏差报告量有明显减少,公司防控共线生产风险的水平明显提高。
这个方法也为药品共线生产风险评估提供了一个完整的思路。
基于FMEA 与共线生产风险管理的关系问题,研究者安广峰等[8](2015)对其风险管理工具的应用进行了深入研究,希望能为药品共线生产风险管理尽一份绵薄之力;在其看来,FMEA 作为一款风险管理工具,确实简单易用,只需要产品数据或工艺数据,便可以实现评估目标,只不过,利用这一管理工具获得的风险属性赋值主观性较强。
即使这样,应用FMEA 风险管理工具,也可以在风险发生之前便确保风险可控性,避免带来损失;与其它风险分析工具相较而言,FMEA 可以实现对质量风险的最终防控。
2016 年张玲非等[9] 对中药产品共线生产的风险管理进行了探讨,主要介绍了中药共线生产风险评估的基本流程和重点评估内容。研究认为,应先识别中药共线生产可能带来的各种污染,再逐一分析生产中的潜在风险;之后,利用FMEA 工具进行风险评价,评估所有存在关联且已被确认的危害因素的危害性。
苏杰等[10] 通过质量风险管理工具失效模式与影响分析(FMEA) 应用在南京某制药有限公司固体制剂共线生产过程,这个公司灵芝孢子粉固体胶囊剂和消癌平固体胶囊制剂共用了部分设备;使用FMEA 法对共线生产风险点进行了识别,并建立了风险控制措施。研究认为FMEA 法有效地减小了固体制剂共线生产过程中的诸多风险。但是也存在一定的局限性,评估人员对生产流程的评估都具有主观性,方法也不适用于所有生产环节的风险评估。
以上可以看出,FMEA 作为分析产品共线的风险,虽存在一定局限性,但是仍不失为一个好的工具。目前业界主要用于评估中药,西药等共线生产的情况,对生物制品的共线生产研究较少。
2014 年张健[11] 以质量风险评估工具作为评估质量风险和制定风险防控方案的基础,以此来评估疫苗生产原液中的质量风险,基于此,建立了评估疫苗生产过程的质量风险的方案,得出了控制其质量风险的办法。
张威[12] 使用FMEA 法对疫苗企业下游工艺共线生产进行了风险分析,确定了可在不同流程进行共线生产的疫苗共4 种;随着共线生产风险防控水平的提升,企业生产成本得以降低,共线生产的质量风险管理流程进一步完善。
4.3
RRF 法的应用
RRF 法用于药品共线生产风险管理的研究较少。
2013 年田英娜[13] 对口服固体制剂生产过程采用RRF 法进行风险评估。利用RRF 法对风险进行了定性分析和定量分析,对口服固体制剂的生产风险内容及其控制措施进行简单介绍,制定风险定期回顾机制;最后,完善风险评估表,形成与之对应的评估报告。相关研究表明,利用RRF 法进行定性分析,可以将口服固体制剂的生产风险等级确定,根据等级制定相对应的防范措施,可以把风险控制在可控范围内。
与HACCP 法和FMEA 法比较,RRF 法在风险评估定量分析方面优势不大。
Part
5
经过对质量风险管理几种工具的研究现状比较可以看出,目前对药品共线生产风险评估中较常使用的风险评估工具主要是FMEA 法和HACCP 法。
HACCP 法侧重于对危害分析和关键控制点的识别,可用于药品生产全过程的质量风险识别和关键控制点建立。从较宏观入手进行风险评估时,使用此方法较好,也有利于建立一整套质量风险关键控制点。
也有少数企业或研究者将HACCP 法用于药品共线风险评估,但是笔者认为其评估由于从单一危害展开,不免会遗漏一些共线生产时的具体风险,因此不推荐使用。
使用FMEA 法进行共线生产风险评估具有较大优势,具体如下:
第一是从模块切入,对几大失效模块分别探究其失效模式,因此细节不会遗漏,而共线生产情况非常复杂,需要对很多细节进行关注;第二由于风险评估小组成员是来自各相关部门的专业人员,在风险识别时会更科学全面;第三是FMEA 可以选择定量评估,定量评估会对严重性,可能性,可检测性分别赋值,乘积算得RPN 值,这样对风险等级的判定和风险可接受的判定更为直观明确;第四是风险控制措施是针对所有的失效模式的风险点提出的,措施更加科学合理,可执行。这些措施对复杂的共线生产的质量管理是至关重要的。
Part
6
针对不同的风险评估情况选择更加科学的风险评估工具才能使药品质量风险得到更好的识别和控制。评估药品共线生产的风险,制定与之对应的控制措施,是保证共线生产产品质量的重要手段。
本文对近几年业内共线生产风险评估的研究进行了初步探讨,并认为不论是中药,化学药品,还是生物制品,其共线生产必须进行风险评估。使用FMEA 工具进行共线生产风险评估是较好的选择,评估时对于风险识别会更加全面,制定的控制措施的会更具针对性和科学性。
参考文献
[1] ICH.ICHQ9:Quality risk management[EB/OL].(2009-10-03)[2016-02-20].http:// www.ich.org/cache/compo/276-254-1.html.
撰稿人 | 周玉柏、牛志彬
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多