ICI治疗中的超进展及其潜在机制
然而,越来越多的回顾性研究发现,一些接受ICIs治疗的患者会出现异常反应,包括肿瘤细胞的加速增殖和疾病的快速进展,预后不佳。这种意外的不良事件被称为超进展性疾病(HPD),其发生表明ICIs对一部分癌症患者不利。HPD很常见,在几种癌症类型中的发病率在4%到29%之间。然而,HPD的发病机制仍知之甚少,且尚未确定HPD的临床预测因素。HPD的出现对目前用于评估ICIs疗效的方法提出了新的挑战。
2016年,在抗PD-1/PD-L1抑制剂的一期试验中首次报告HPD的发病率为9%(12/131)。在这项研究中,HPD与基线检查时的肿瘤负荷或肿瘤类型无关,在65岁以上的患者中发生率更高。在另一项对34例HNSCC患者进行的回顾性分析报告中,HPD的最高发病率达到29%。此外,在对比ICIs与标准化疗的临床试验CheckMate 057、CheckMate 227和CheckMate 141中,均发现HPD的证据。虽然HPD的临床诊断标准在不同的研究中有所不同,但它们都在短时间内比较了免疫治疗前后的肿瘤生长情况。
由于HPD临床研究大多是回顾性的,HPD是否是ICIs治疗后反应的独立模式仍然存在争议。主要争议在于HPD是肿瘤的自然过程还是ICI治疗后发生的加速生长过程。在大多数试验中,在ICIs开始用药之前,没有关于肿瘤生长率(TGR)的参考数据,而两条生存曲线的交叉被认为是因为化疗比ICIs更有效,而不是因为HPD本身。
此外,有研究报告了850名接受多西紫杉醇或atezolizumab治疗的NSCLC患者队列中HPD的相似比例,从而认为HPD可能是由预后不良引起的,而不是由于免疫治疗。目前,尽管已经积累了有关HPD的数据,但其定义还没有一个普遍的标准。未来的研究应评估最佳的HPD标准,以确定无法从ICI治疗中获益的患者以及最有可能从中获益的患者。在ICI治疗前收集影像学治疗和肿瘤生长动力学数据,并将HPD与固有的侵袭性疾病或假性进展区分开来是很重要的。
在早期检测和区分进展、假性进展和HPD是至关重要的。目前,HPD的评估和诊断主要基于与预处理肿瘤动力学相关的参数和免疫治疗开始后的早期变化,包括TGR、肿瘤生长动力学(TGK)和治疗失败时间(TTF)。
HPD首次出现是根据RECIST1.1,定义为TGR在免疫治疗后增加≥2倍,而Ferrara等建立了不同标准,为TGR增加50%。TGR是给定时间间隔内肿瘤大小变化的比率,是临床实践中总生存率的预测因子。TGR的评估以RECIST为基础,然而RECIST与治疗前后TGR变化之间缺乏相关性,因此,RECIST 1.1并不是评估免疫治疗效果的最准确方法。
TGK的评估与TGR类似,也是测量了靶病变最大直径总和的变化。然而,这种HPD评价方法仅限于肿瘤的目标区域,而不考虑非目标区域病变的出现和变化。在实际临床实践中,无法获得免疫治疗前的TGR数据,也无法通过对肿瘤大小变化的基本影像学分析来区分该比率,因此,基于TGR和TGK的方法不能用于评估肿瘤生长中的新病变。重要的是,这些方法仅使用放射学标准,这可能会遗漏其它的响应模式。因此,有研究结合了临床和放射学标准,将小于2个月的TTF也可用作评估HPD的替代指标。
其它研究还有通过量化ICI治疗前后循环中的衰老CD4+T细胞(Tsens)的数量。免疫治疗前Tsens数量的增加表明有响应,而第一个治疗周期后Tsens数量的减少表明反应良好,相反,Tsens的增殖表明进展。总的来说,多种方法的组合可能会提供了最有价值的评估。尽管目前HPD诊断相对不准确,但仍为进一步研究提供了可用的信息。
肿瘤假进展的概念首次在接受非免疫治疗药物替莫唑胺治疗的患者中观察到,然而,这种现象并没有伴随真正的肿瘤进展。假进展并不是真正的肿瘤进展,而是放射影像学定义生长,病理特征为肿瘤周围免疫细胞浸润、水肿和坏死。鉴于在临床试验开始时,由于假进展,有益的治疗往往会中断,因此有必要区分假进展和HPD。
除了肿瘤免疫细胞入侵引起的炎症反应外,免疫反应延迟也可能出现假进展,尤其是假进展后肿瘤消退的患者。关于ICIs治疗实体瘤时假性进展的发生率,已有几项研究,在黑色素瘤中,3.7–15.8%接受ICIs治疗的患者出现异常免疫反应或假进展。此外,据报道,NSCLC、尿路上皮癌、HNSCC和间皮瘤患者的假进展发生率分别为0.6–5.8%、1.5–7.1%、1.8%和6.9%。虽然假进展主要发生在接受单一检查点抑制剂的患者中,但在接受双重免疫治疗的患者中也观察到了假进展。
对循环肿瘤DNA(ctDNA)水平的分析可作为区分疾病进展、HPD和假进展的有效工具。与HPD不同,假进展表现为ctDNA基因组不稳定性的降低。在一项对125名接受ICI治疗的黑色素瘤患者的研究中,ctDNA图谱以高度的敏感性(90%)和特异性(100%)区分了假进展和HPD。
总体而言,假进展预后良好,应尽快确定,以避免因早期中断治疗而延误疾病。同时,了解真实肿瘤进展的可能性也很重要。
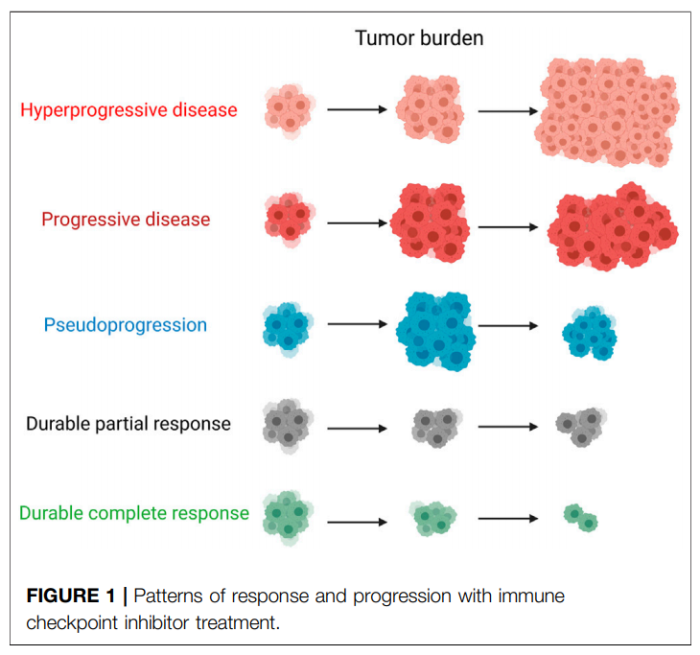
识别HPD的潜在预测因素至关重要。这可以避免ICIs引起的不良反应,对延长患者的生存期和生活质量具有重要的临床意义。
研究发现HPD与基线肿瘤负荷、既往治疗、肿瘤组织学、免疫治疗类型或转移部位数量之间没有关联。迄今为止,五个临床变量(年龄、女性、较高的血清乳酸脱氢酶(LDH)浓度、转移负荷和放疗区细胞局部复发)已被确定为可能与HPD相关,此外,还包括特定的基因组突变,如MDM2/MDM4扩增和EGFR突变。
年龄似乎与HPD的发生有关,患有HPD的患者明显比未发生HPD的患者年龄大,65岁以上的患者中有19%出现HPD,而64岁以下的患者中仅有5%出现HPD。这些结果表明,老年患者比年轻人从ICIs中获益较少,T细胞数量、多样性、表型和功能的变化,T细胞免疫力随着年龄的增长而下降。目前,HPD与衰老之间的具体关系尚不完全清楚。
此外,研究发现HPD与放疗有关。在已有的抗PD-1/PD-L1研究中,50%的局部复发患者发生HPD,而只有6.25%的无局部复发患者发生HPD。几乎所有HPD病例都发生在照射区域复发的患者中,但这种现象的潜在机制尚不清楚。
基因组突变可能是与免疫治疗和HPD相关的潜在基因组标记。一些突变(如TERT、PTEN、NF1和NOTCH1)具有良好的临床结果(TTF≥ 2个月);相反,EGFR、MDM2/4和DNMT3A的突变与更差的结果相关(TTF<2个月)。
一些研究者关注外周血中的CD8+T细胞,以寻找潜在的预测因子。研究发现在HPD患者中效应CD8+T细胞的数量减少,而耗竭的肿瘤反应性CD8+T细胞(TIGIT+PD-1+)数量增加。结果表明,CD8+T细胞的耗竭是ICIs治疗加速肿瘤生长的潜在机制之一,T细胞耗竭的严重程度可以预测HPD。此外,HPD患者的CD28数量也显著上调,这表明CD4+T细胞免疫可能是HPD的一个强有力的预测因子。
目前,HPD的分子机制尚不清楚。一些研究从不同角度探讨了HPD的多种假设或机制。这些机制可以独立发挥作用,也可以相互补充。阐明HPD的分子机制具有重要意义,HPD可由多种因素引起,包括肿瘤细胞的特征、患者免疫系统的状态以及患者当前或既往的治疗史。
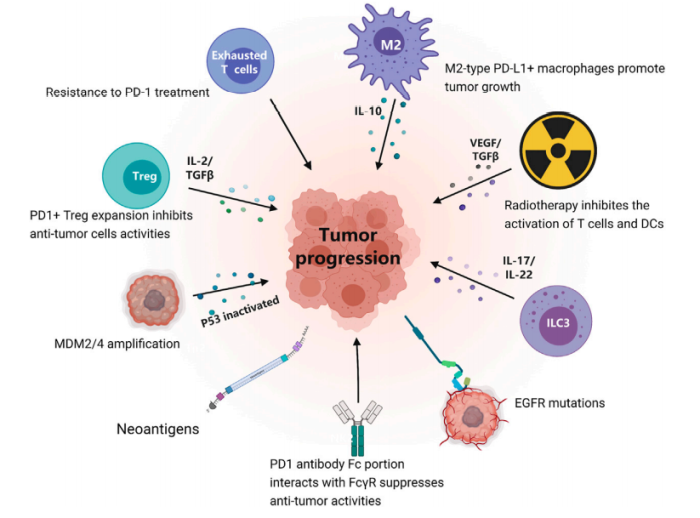
PD-1+Tregs的上调
在感染或癌症的情况下,对抗抑制或免疫补偿是一种自我稳定机制。免疫抑制因子,如Tregs,可以维持抗感染或抗肿瘤免疫,并减少ICIs的不良反应。一项研究分析了ICI治疗前后胃癌肿瘤组织,发现HPD患者组织中Treg数量增加,表明ICI治疗可能激活这些Treg。在一项体外胃癌研究中,观察到当Treg上的PD-1被敲除或阻断后,Tregs可以增殖并促进对抗肿瘤免疫细胞的免疫抑制。以上研究表明,PD-1可能介导HPD的发生,从而抑制抗肿瘤免疫。
T细胞耗竭
T细胞耗竭被定义为T细胞功能障碍,识别和消除抗原的能力减弱,抑制性受体包括PD-1、TIM3、TIGIT和LAG3的上调。这些抑制性受体的过度表达可能是PD-1治疗耐药的关键机制。随着这些抑制性受体的过度表达,CD8+T细胞在细胞因子的产生、增殖和迁移方面表现出严重的功能障碍。
Tsens增加
在一项对NSCLC患者的抗PD-1/PD-L1药物治疗的研究中,检测了基线衰老T细胞的数量, Tsens相对较高的患者发生HPD。相反,在Tsens较低的患者中肿瘤明显消退。结果表明,免疫治疗前患者的Tsens数量可以预测HPD的风险。Tsens基线数量可能代表一个预先存在的具有潜在抗肿瘤能力的效应T细胞的总体情况。
MDM2/4扩增和EGFR突变
涉及多种肿瘤类型的研究表明,致癌基因的激活,如MDM2/4扩增与HPD的发生有关。MDM2/4促进p53的蛋白酶体泛素依赖性降解,而p53活性的丧失是肿瘤发生的重要驱动因素。ICIs可以增加肿瘤部位IFN-γ的产生,IFN-γ可增加MDM2/4的表达,由此推测MDM2/4-IFN-γ/p53轴可能介导HPD的发生。
EGFR的激活通常伴随PD-1/PD-L1或CTLA-4的上调,以促进肿瘤免疫逃逸。EGFR突变患者抗PD-1治疗的客观应答率相对较低,约为3.6%。这可能与EGFR的激活有关,EGFR可以促进PD-L1的稳定性并防止其降解。然而,EGFR突变与HPD之间的联系机制尚不清楚。
Fc受体的作用
免疫微环境与HPD密切相关。严重联合免疫缺陷(SCID)动物模型研究发现,Nivolumab与Nivolumab的Fab片段相比,Nivolumab促进肿瘤生长,而在Nivolumab的Fab片段未观察到实质性肿瘤生长或HPD。进一步的研究发现,M2巨噬细胞聚集仅发生在nivolumab治疗后的病变中,而不是nivolumab的 Fab片段。
在另一项恶性黑色素瘤研究中,敲除小鼠体内的Fcγ受体(FcγR)可增强抗PD-1抗体的抗肿瘤作用,直接显示FcγR与ICIs之间的相关性。有人提出,FcγR IIb对人类抗PD-1免疫治疗效果有不利影响,可导致HPD。研究发现FcγR I通过调节炎性细胞因子诱导免疫耐受,并在M2巨噬细胞的产生中发挥作用,促进肿瘤生长。
免疫抑制细胞因子的失衡
肿瘤来源的胞外体已被证明可诱导PD1+巨噬细胞产生IL-10并抑制CD8+T细胞的功能。对104例患有HPD的NSCLC患者的肿瘤组织进行分析,发现大量M2型PD-L1+巨噬细胞分泌IL-10,通过消耗PD-1抗体介导HPD的发生。
IFN-γ可通过提高癌细胞中PD-L1的表达来增强肿瘤的免疫抵抗力。T细胞释放IFN-γ可提高癌细胞的选择压力,导致IFN-γ途径获得性缺陷,并通过对IFN-γ失去敏感性而获得对ICIs的耐药性。此外,CD8+T细胞中IFN-γ信号的丢失也观察到了对免疫治疗的抵抗,这些结果证明了IFN-γ在HPD中的潜在作用。
3型固有淋巴细胞增多
ILC3在HPD肿瘤中特异性增加。ILC3s可对细胞因子刺激作出反应,而无需特异性抗原。据报道,ILC3可产生IL-17和IL-22,从而促进癌症进展。研究表明,肿瘤微环境中ILC3的存在与乳腺癌淋巴结转移的高风险相关。这种异常的炎症环境可能与ICIs的不良疗效有关,但其与HPD的关系尚不清楚。
新抗原的作用
新抗原导致细胞更高的异质性,这有助于免疫细胞靶向并消除肿瘤细胞。对ICIs和HPD的获得性耐药性也可以用新抗原预测。新抗原功能失调可能促进肿瘤的转移和复发,筛选这些新抗原有可能预测治疗耐药性和HPD。
其他机制
其它因素如LDH可能与HPD相关,高LDH水平代表肿瘤缺氧和细胞外环境酸化,高LDH水平和酸性环境可能影响抗体的功能和抗原的构象,从而影响ICIs的特异性和亲和力。还有一些研究发现,肠道微生物群影响ICIs在黑色素瘤患者中的作用。众所周知,微生物组是炎症和免疫反应的关键调节因子,可能在癌症治疗中发挥重要作用。

由于HPD患者预后不佳,因此迫切需要制定策略来减少或消除其对患者的伤害。在临床实践中,有必要更多地关注患者病情的变化,并评估ICIs治疗的疗效。首先,需要使用ICIs治疗的患者需要充分了解HPD的风险,因为HPD的发病率很高,一些患者可能会因为不良后果而拒绝治疗。此外,目前免疫治疗的肿瘤评估方法不包括TGK,而TGK是早期识别HPD的关键。它可以使相当一部分符合HPD定义的患者继续接受治疗。
现有的癌症疾病监测和评估系统迫切需要改变。在治疗中,早期发现HPD和及时更换ICIs可能是目前避免患者风险的唯一补救措施。然而,假进展也会影响HPD的识别,因此,在免疫治疗开始后第一次成像时肿瘤的明显进展并不一定意味着必须终止治疗,因为假进展患者可能会从该治疗中获益。治疗前对MDM2/4扩增、EGFR突变和CNI评分的评估有助于选择可能发展为HPD的患者。然而,目前这些生物标志物的预测价值尚未得到验证。
NK细胞治疗在在体内会减弱PD-L1阳性肿瘤细胞,联合使用NK细胞和ICIs可能是HPD患者的另一种选择。此外,在Checkmate227试验中,使用nivolumab联合化疗的患者比使用nivolumab联合ipilimumab的患者进展风险更低。化疗可能有助于防止患者产生ICI耐药性和HPD,这种可能性值得进一步研究。
目前关于HPD仍有许多争议,但已知它发生在多种肿瘤类型和几乎所有恶性肿瘤中,并且与不良预后有关。越来越多的回顾性研究表明HPD是由ICIs引起的,HPD是ICI治疗中的严重不良反应,这限制了ICI的临床应用。ICI诱导的HPD是复杂的,因此,有必要探索HPD的病因和发病机制,并开发预测和检测方法,以防止免疫治疗的中止。
总之,HPD是一种新现象,其潜在机制有待阐明。此外,HPD的临床相关性和预测因素有待进一步研究。HPD为新型肿瘤生物疗法的发展提供了挑战和机遇,也将促进提高ICIs有效性和安全性的研究。深入研究这一问题对于保护癌症患者免受ICI疗法潜在的有害副作用十分重要。
参考文献:
1.Hyperprogressive Disease in Cancers Treated With Immune Checkpoint Inhibitors. Front Pharmacol. 2021; 12: 678409.
内容来源:小药说药
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多