化学仿制药有机杂质分析和控制

摘要

化学药物中的有机杂质又称有关物质。
该类杂质通常与活性成分具有类似的化学结构,其来源和去向的分析,以及准确和有效的控制,是化学仿制药药学研究的关键项目之一。
本文以硼替佐米、地西他滨和吉西他滨为例,结合原料药的合成方法、制剂的处方工艺和降解研究,分析原料药及其制剂中可能存在的有机杂质,包括起始原料、中间体、工艺副产物、降解产物等,并基于“质量源于设计”的理念,提出相应的杂质控制策略,实现“全程控制”,有效确保药物的安全有效和质量可控。

关键词

有机杂质; 过程控制; 质量源于设计; 硼替佐米; 地西他滨; 吉西他滨
|
正文 |
化学药物的杂质是指存在于化学药物中的无治疗作用或影响药物稳定性、疗效,甚至对人体健康有害的物质。
任何影响药物纯度的物质均可称为杂质。
杂质的分析和控制是保障用药安全有效的基础。
因此,杂质研究在仿制药药学研究中占有重要地位,其是否得到全面准确的分析和控制,直接关系到药品的质量可控与安全性。
化学药物中的杂质根据其理化性质一般可分为有机杂质、无机杂质和残留溶剂[1]。
其中,有机杂质又称有关物质。
这类杂质通常与活性成分具有类似的化学结构,可能具有一定的生理活性,其来源和去向的分析,以及准确和有效的控制,是化学仿制药质量研究的关键。
本文结合质量源于设计( quality by design,QbD)以及目前仿制药杂质研究与控制的一些基本理念[2 - 4],以硼替佐米( bortezomib) 、地西他滨( decitabine)和吉西他滨( gemcitabine) 为例,结合化合物结构特点、原料药合成路线、制剂处方工艺、降解途径和相关文献资料,对其有机杂质进行分析,并探讨相应的杂质控制策略,以期为仿制药的杂质研究工作提供参考思路。
需要指出的是,本文不对遗传毒性杂质等高毒性物质进行讨论,可参照相关指导原则研究。
1
工艺杂质的分析和控制
原料药的工艺杂质可能来源于起始原料、起始原料引入的杂质及其后续反应物、中间体、副反应产物及其后续反应物、反应中使用的有机试剂等。现以硼替佐米为例,结合其制备工艺,探讨原料药工艺杂质的分析及其控制策略。
硼替佐米,化学名称为[( 1R) -3-甲基-1-[[( 2S) -1-氧-3-苯基-2-[( 吡嗪羧基) 氨基]丙基]氨基]丁基]硼酸,由千禧( Millennium) 制药( 后被日本武田制药公司收购) 和强生共同开发,是全球上市的第一个合成的蛋白酶体抑制剂,为靶向治疗的新型抗癌药。
硼替佐米原料药在固体状态下以三聚体形式( 无水三聚环硼氧烷酸酐结构) 存在,在水溶液中解离为单体,并与三聚体平衡存在[5]( 见图1)
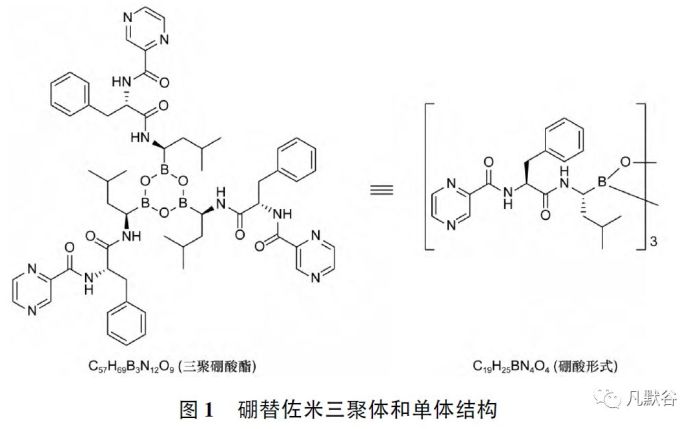
其制剂注射用硼替佐米于2003 年在美国上市,2004 年在欧洲上市,2005 年获准进口中国,商品名“Velcade /万珂”,用于治疗多发性骨髓瘤和套细胞淋巴瘤。
2015 年10 月硼替佐米化合物专利到期,注射用硼替佐米随即成为国内化学药物仿制药申报的热点品种之一。
国内外均有报道硼替佐米的合成和制备工艺[6 - 7],通过总结分析,实际制备采用的合成路线比较一致,即在原研化合物专利路线的基础上[8],以L-硼亮氨酸蒎烷二醇酯为起始原料,首先与氨基保护的L-苯丙氨酸缩合,再脱保护后与2-甲酸吡嗪缩合,形成硼替佐米蒎烷二醇酯,然后在异丁基硼酸条件下脱蒎烷保护基获得硼替佐米粗品,精制,即得硼替佐米原料药。
或以L-硼亮氨酸蒎烷二醇酯为起始原料,直接与N-吡嗪羰基-L-苯丙氨酸缩合形成硼替佐米蒎烷二醇酯,再脱保护获得硼替佐米粗品,精制,得到硼替佐米,见图2。
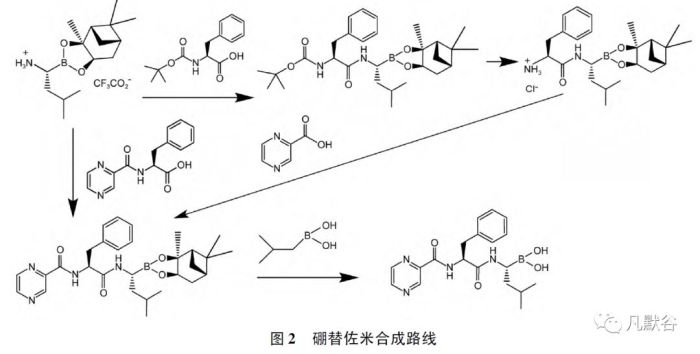
1.1 起始原料及其引入杂质
结合工艺路线,硼替佐米主要起始原料包括L-硼亮氨酸蒎烷二醇酯、N-吡嗪羰基-L-苯丙氨酸或氨基保护的苯丙氨酸和2-甲酸吡嗪。
L-硼亮氨酸蒎烷二醇酯一般由异丁基硼酸和蒎烷二醇反应生成异丁基硼酸蒎烷二醇酯后,经卤代、氨基取代获得,通常使用其三氟乙酸盐。
结合制备工艺,其主要有机杂质包括: 起始物料蒎烷二醇和异丁基硼酸,中间体异丙基硼酸蒎烷二醇酯、卤代物,异构体杂质D-硼亮氨酸蒎烷二醇酯,以及可能降解产生的异戊胺等。
该起始原料的手性中心将直接带入成品,其异构体杂质可能继续反应生成成品对映异构体R,S-硼替佐米和非对映异构体S,S-硼替佐米,因此异构体杂质应作为关键质控项。
N-吡嗪羰基-L-苯丙氨酸通常由L-苯丙氨酸成酯( 如,甲酯、三甲基硅酯) 后与2-甲酸吡嗪反应获得。
结合制备工艺,分析其主要有机杂质包括: 起始物料L-苯丙氨酸和2-甲酸吡嗪,中间体L-苯丙氨酸酯,副产物苯丙氨酸二聚体,以及异构体杂质N-吡嗪羰基-D-苯丙氨酸等。
该物料的手性中心也直接带入成品,异构体杂质应作为关键杂质控制。
工艺中常用的氨基保护的苯丙氨酸为N-叔丁氧羰基-L-苯丙氨酸,由L-苯丙氨酸与Boc 酸酐酰化反应获得,其异构体也应作为关键杂质控制。
2-甲酸吡嗪工艺较为成熟,可由2-氰基吡嗪氧化或吡嗪二羧酸脱羧制得,其可能存在的杂质包括起始物料和吡嗪羧酸酯。
硼替佐米结构较为复杂,起始原料本身也是成品重要的工艺杂质。同时,蒎烷结构在制药行业使用相对较少,且成品手性中心均由起始物料引入。
因此,基于源头控制的理念,原料药生产企业如采用外购起始原料,应严格进行供应商筛选和审计,充分理解供应商的制备工艺,并结合自身工艺特点,分析起始原料的关键质量属性,特别是起始原料及其杂质在后续工艺过程中的转化和去除情况,针对性地建立起始物料的内控标准。
1. 2 工艺中间体及副产物
硼替佐米的关键中间体为硼替佐米蒎烷二醇酯。
从结构和反应机理分析,N-叔丁氧羰基-L-苯丙氨酸在反应中可能发生苯丙氨酸消旋,因此,中间体研究过程中仍应进行异构体杂质的研究和控制。
硼替佐米工艺路线中可能产生的副产物有异丁基硼酸蒎烷二醇酯、苯丙氨酸二聚体等[9],结构式见图3。
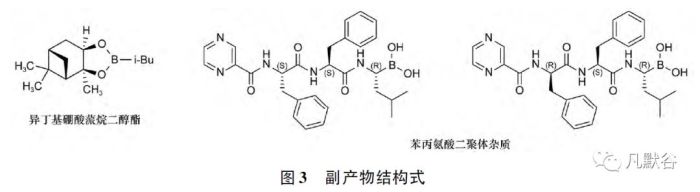
对于中间体和副产物等杂质,应充分体现过程控制的理念,选择合理的工艺路线,在明确杂质结构的基础上,对投料比、关键缩合试剂、反应液浓度、温度、时间、溶剂等工艺参数进行筛选研究,确定合理的关键工艺步骤及参数范围,并在商业化生产转化过程中,在一定生产规模下进行工艺验证,确保大生产工艺的可行性和重现性。
1. 3 有机试剂及其转化物
硼替佐米的合成及其起始原料的制备过程中均使用较多种类的有机试剂,如,L-硼亮氨酸蒎烷二醇酯合成过程中可能使用二异丙基氨基锂( LDA) 、六甲基二硅基氨基锂( Li-HMDS) ; N-吡嗪羰基-L-苯丙氨酸合成过程中可能使用N,O-双三甲基硅基乙酰胺; 硼替佐米中间体及粗品合成过程中可能使用异丁基硼酸、1-羟基苯并三唑( HOBt) 、碳化二亚胺( DCC,DIC,EDCI) 、N,N-二异丙基乙基胺( DIEA,DIPEA) 、O-苯并三氮唑-N,N,N\',N\'-四甲基脲四氟硼酸酯( TBTU) 、O-( 7-氮杂苯并三氮唑) -N,N,N\',N\'-四甲基脲四氟硼酸盐( TATU)等。
应对这些有机试剂及其转化产物的来源和去向进行分析研究,积累充分的数据,制定合理的控制策略。
2
降解杂质的分析和控制
降解杂质与化合物结构特征密切相关。
原料药应在分析降解杂质产生机理的基础上优化工艺参数,并针对敏感因素选择适宜的包装,结合稳定性研究结果拟定合理的贮藏条件。
制剂应重点控制降解杂质,对于已在原料药中控制的工艺杂质在制剂中可不用再控制[10]。
现以地西他滨为例,探讨制剂有机杂质的分析思路及其控制策略。
地西他滨,化学名称为4-氨基-1-( 2-脱氧-β-D-赤式-呋喃核糖) -1,3,5-三嗪-2 ( 1H) -酮,由美国MGI Pharma 公司开发上市,为胞嘧啶核苷类似物,干扰DNA 合成引起细胞凋亡发挥抗肿瘤作用,其制剂注射用地西他滨于2006 年在美国上市,2008年在中国上市,2012 年获准在欧洲上市,商品名“Dacogen /达珂”,用于治疗骨髓增生异常综合征。
目前国内已有7 家企业生产的仿制药批准上市。
地西他滨稳定性较差,降解杂质较多,尤其对水敏感,结合文献资料分析其潜在降解杂质见图4
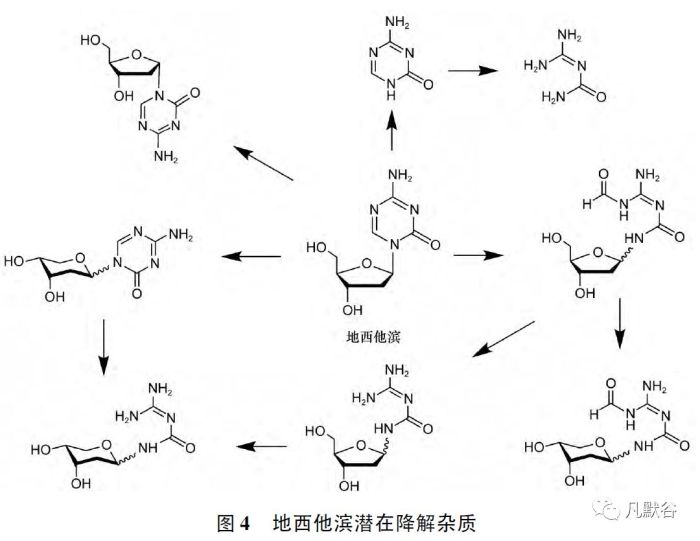
制剂研究过程中,应以敏感杂质为考察对象,对溶液配制时原辅料加入顺序、溶解时间和温度进行优化,对除菌过滤时间和温度等工艺过程控制参数进行研究,确定合理的冻干工艺参数。
同时,还应考虑生产过程中是否需要避光操作和充氮保护,以尽量减少生产过程中降解杂质的产生,并在大生产规模下确定工艺的可行性和重现性。通过细致的研究工作,充分理解制剂处方工艺特点,从源头上对原料药和关键辅料提出质量要求,明确关键工艺参数及其控制范围,拟定合理的中间体质控标准,并结合质量研究和稳定性研究结果选择合理的包装,确定贮藏条件。
作为仿制药,还应与多批次的原研品进行全面的杂质谱对比研究,原则上仿制品的杂质种类和含量均应不超过原研品,特别是仿制品出现超过鉴定限度的新杂质时,应充分分析其产生原因,采取相应措施,降低杂质含量,以确保仿制药质量不低于原研品。
3
上市后药物杂质控制的管理
上述2 个实例主要阐述药品研发过程中对于工艺杂质和降解杂质的考虑,对于已上市药品,随着科学的发展和认识的加深,或临床运用中出现了可能由杂质引发的问题,提示我们应更新对该药品的杂质控制,即药品杂质的全生命周期管理。
目前ICHQ12 已提出了药品生命周期管理中的技术和法规考虑[13]。
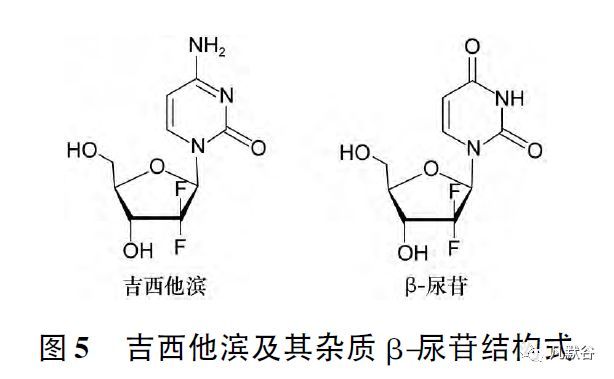
现以吉西他滨为例,简要探讨上市后药品杂质控制的变更。盐酸吉西他滨,即2\'-脱氧-2\',2\'-二氟胞苷( β-异构体) 盐酸盐,由礼来公司开发,为抗代谢类抗肿瘤药,其制剂注射用盐酸吉西他滨于1995 年首次在英国等欧洲国家上市,1996 年在美国上市,1999 年批准进口我国,商品名“Gemzar /健择”,可单药或联合用药治疗多种癌症,现已进入国家医保。
近年来研究发现,盐酸吉西他滨体内无活性的主要代谢物β-尿苷( β-uridine) ,为其主要降解杂质,酸、碱、热等多种条件下均可能降解产生,尤其是在水溶液中[14 - 15]。
英国药典2013 年版盐酸吉西他滨标准中仅控制已知杂质胞嘧啶,在英国药典2016 年版中则增加了已知杂质β-尿苷的控制。
结构式见图5。
4
总结与讨论
杂质的研究贯穿于药物研发的始终,在药物的整个生命周期需要不断更新。
有机杂质是化学药物杂质的主要来源之一,有机杂质的控制也是目前仿制药研发中的重点和难点。
随着质量控制理念的变化,“质量源于设计”的理念已被广泛的认可和采纳,杂质的控制已不能单纯依赖于质量标准中的有关物质检查。
本文以硼替佐米、地西他滨和盐酸吉西他滨为例,探讨了有机杂质分析的控制的基本思路,但并不能涵盖其所有的有机杂质。
不同的企业和研究者应充分了解自身产品特点,建立完善的杂质控制体系,制定合理的杂质控制策略,实现“全程控制”,以充分保障药物的安全、有效和质量可控。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多