汇总丨全球已获批上市CAR-T疗法

表1:FDA批准上市的CAR-T疗法
1. Kymriah
图1:诺华公司-Kymriah
2.Yescarta
2017年10月,FDA批准了吉利德公司靶向CD19的CAR-T 疗法。这家大型制药公司在FDA批准Kite 的CAR-T细胞疗法Yescarta前几周收购了CAR-T开发商Kite Pharma。
适应症:
(1)B细胞非霍奇金淋巴瘤(NHL),包括弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)、高级B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤,用于至少接受两种全身治疗以上复发或难治性成人患者。
(2)弥漫性大B细胞淋巴瘤:接受一线化疗没有效果或者一线化疗后1年内复发的成人患者。
临床数据:
在数据截止时,110例患者(86例滤泡性淋巴瘤患者,24例淋巴结边缘区淋巴瘤(MZL)患者)符合疗效分析条件。FL患者至少随访2年,MZL患者的最低要求为随访4周。在符合资格的FL患者中,中位随访时间为30.9个月(范围:24.7-44.3),客观缓解率(ORR)为94%、完全缓解率(CR)为79%,有57%的患者表现持续缓解。估计的中位缓解持续时间(DOR)为38.6个月、中位无进展生存期(PFS)为39.6个月,发生下一次治疗的中位时间为39.6个月,中位总生存期(OS)尚未达到,估计的24个月OS率(生存率)为81%。
在符合资格的淋巴结边缘区淋巴瘤患者中,中位随访时间为23.8个月(范围:7.4-39.4),ORR为83%、CR为63%。在数据截止时,50%的患者处于持续缓解状态。中位DOR和发生下一次治疗的中位时间尚未达到,中位PFS为17.3个月,中位OS尚未达到,估计的24个月OS率为70%。
3. Tecartus
图3:吉利德-Tecartus
4. Breyanzi
5. Abecma
图5:百时美施贵宝/蓝鸟- Abecma
6.Carvykti
图6:传奇生物-西达基奥仑赛
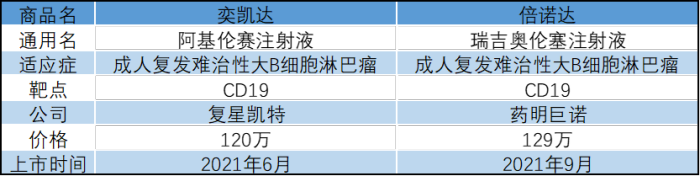
表2:中国上市的两款CAR-T
1.阿基伦赛注射液
图7:复星凯特-阿基伦赛注射液
2.瑞吉奥伦塞注射液

图8:药明巨诺-瑞吉奥伦塞注射液
总结
数据来源:
1.诺华官网
2.百时美施贵宝官网
3.凯特生物官网https://www.kitepharma.com/news/press-releases/2022/9/kites-car-t-cell-therapy-tecartus-granted-european-marketing-authorization-for-the-treatment-of-relapsed-or-refractory-acute-lymphoblastic-leukemia
4.Bristol Myers Squibb Receives European Commission Approval for CAR T Cell Therapy Breyanzi (lisocabtagene maraleucel) for Certain Forms of Relapsed or Refractory Large B-cell Lymphoma
5.https://www.onclive.com/view/cilta-cel-induces-strong-response-in-chinese-patients-with-relapsed-refractory-multiple-myeloma
6.复星医药官网
7.瑞基奥仑赛注射液临床应用指导原则(2021年版),白血病·淋巴瘤, 2022,31(1) : 1-10. DOI: 10.3760/cma.j.cn115356-20211115-00262
封面图:https://www.crownbio.cn/2018-2-20/
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多