表1:国内获批创新生物药列表(截止2022.12.21)
表2:国内获批创新化药情况(截止2022.12.21)
1、全球首个不限瘤种的广谱靶向药-拉罗替尼,填补国内肿瘤精准治疗空白
2022.4月CDE基于II期临床替代终点附条件批准拉罗替尼(TRK抑制剂,拜尔从Loxo Oncology引进)用于NTRK融合基因阳性实体瘤,之前拉罗替尼已在欧美日获批上市,是全球首款基于生物标志物而非癌症位置获批的药物。截止到目前已发现NTRK融合存在于超过25类癌症中,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等。
说明书显示拉罗替尼II期临床试验覆盖17种瘤种(N=55),总体ORR达到75%,II期研究仍在进行中。在中国拜耳和至本医疗达成合作开发基于NGS技术的NTRK融合基因检测的伴随诊断-体外诊断试剂产品。而拉罗替尼也将于今年正式进入国谈,相信未来进入医保后会有更多患者获益。
另一款为罗氏开发的TRK/ROS1/ALK抑制剂恩曲替尼,于2022.7月分别获批NTRK融合实体瘤和ROS1阳性非小细胞肺癌。
2、全球首款,国内第二款,选择性RET抑制剂—塞普替尼
2022.9月CDE批准礼来高选择性RET抑制剂用于RET基因融合阳性的非小细胞肺癌、RET突变甲状腺髓样癌和甲状腺癌。本品最早于2020.5美国获批,为全球首款,国内第二款(国内首款为普拉替尼,2020.9月 FDA批准,2021.3月NMPA批准,国内售价100mg,500元/片,60000元/盒)基于RET基因突变靶向药。
说明书显示在经铂化疗后RET基因融合阳性转移性NSCLC患者ORR为64%,初治患者ORR为85%;经凡德他尼和卡博替尼治疗RET突变甲状腺髓样癌患者ORR为69%,未经治疗患者为73%;经过系统治疗RET融合阳性甲状腺癌ORR为79%,初治患者为100%。国内信达生物获得塞普替尼独家商业化权利。
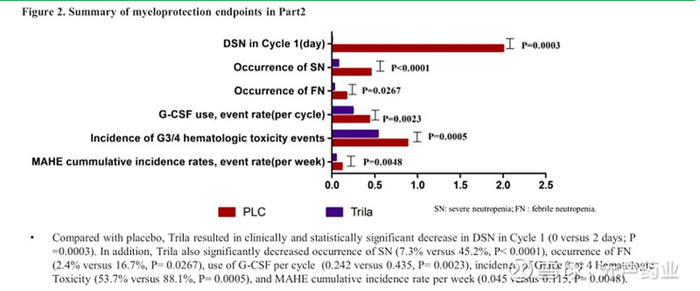
3、为化疗患者保驾护航,全球首个骨髓保护药物—曲拉西利
曲拉西利是G1 Therapeutics 公司研发的短效、可逆的4/6抑制剂,与上市的其他3款CDK4/6抑制剂Palbociclib、Ribociclib和Abemaciclib适应证不同,曲拉西利被批准用于预防广泛期小细胞肺癌成年患者因铂类联合依托泊苷或拓扑替康方案化疗所致的骨髓抑制。
II期结果显示,曲拉西利组患者第一周期的中性粒细胞减少持续时间明显少于安慰剂组(0天vs 4天);严重中性粒细胞减少发生率明显低于安慰剂组(1.9% vs 49.1%)。目前该产品国内权益授权给先声药业。
佩米替尼是由Incyte公司开发的一代可逆的FGFR1/2/3抑制剂,基于II期单臂研究获批用于FGFR2融合或重排的晚期胆管癌二线治疗,成为胆管癌首个精准疗法。
II期临床数据显示ORR:36%, mDoR:9.1M, mOS:21.1M,目前正在开展国际确证性III期临床,国内信达生物引进,日治疗费用约4753元。由于FGFR在多种实体瘤高表达或发生突变,已有多家药企布局,主要是为解决一代可逆FGFR抑制剂耐药问题和靶点相关AE问题。
图注:NCT04256980:FIGHT-202研究(INCB 54828-202, NCT02924376)的桥接试验
5、全球首个第三代ALK抑制剂—洛拉替尼,突破ALK阳性脑转移,后续耐药困境
洛拉替尼是由辉瑞公司的ALK、ROS1双靶点抑制剂,属于第三代ALK抑制剂,2018年FDA批准上市,2022年4月NMPA批准。虽然许多ALK阳性转移性NSCLC患者最初对TKI治疗有反应,然而耐药是不可避免的问题,洛拉替尼可有效对抗各类ALK继发的耐药基因突变,并且有较强的中枢神经系统渗透性,保持脑组织中较高的血药浓度,无脑转移的患者接受其治疗能有效阻遏脑转移发生。
CROWN研究显示与克唑替尼相比, ORR:76% vs 58%,颅内病变患者颅内缓解率82% vs 23%。针对ROS1阳性非小细胞肺癌适应症的开发,国内辉瑞与基石药业达成战略合作。目前国内洛拉替尼国内价格818元/片,月治疗费用24540元。
另一款ALK抑制剂为武田开发的二代产品布格替尼,2017年首次在美国获批上市,用于克唑替尼治疗后疾病进展或克唑替尼不耐受的晚期ALK阳性NSCLC患者,2020年5月,FDA批准其一线治疗ALK阳性转移性NSCLC成人患者。
6、风口浪尖上的PI3K抑制剂—度维利塞、林普利塞
度维利塞是由Secura Bio开发的PI3K抑制剂,主要抑制正常和恶性B细胞上表达的 PI3K-δ和和 PI3K-γ 亚型活性,全球上市的第三款PI3K抑制剂。早在2018年基于II期单臂研究美国获批复发难治的慢性淋巴细胞、小淋巴细胞白血病(r/r CLL/SLL)和滤泡性淋巴瘤(FL)。
2022.9月份FDA召开了2次关于PI3K抑制剂的药物咨询会议,4月份FDA讨论PI3K抑制剂用单臂数据通过加速审批通道上市的问题,会议材料列举了PI3K上市以来的“斑斑劣迹”,4款药物的6项随机对照试验结果,安全性问题有点不忍直视,且直接导致几乎所有药物的OS都受到损害。9月份FDA审议度维利塞与Ofatumumab治疗r/r CLL/SLL的5年对照试验数据,结果显示度维利塞完全没有OS优势,反而是明显出现了更高的毒性。因此,ODAC以8:4票数反对度维利塞的这个适应症,也基本意味着建议该药撤市。目前本品国内权益授权于石药集团,CDE基于II期中国患者单臂桥接研究附条件批准FL,ORR为87%(N=23,远高于全球研究38%),后续完全批准需验证性临床III期试验数据,目前度维利塞国内售价为355元/片(25mg)。
另一款国内获批的PI3K抑制剂为上海璎黎药业的PI3Kδ林普利塞,恒瑞拥有中国地区的独家商业化权益,这笔交易对于当时的恒瑞医药来说,无疑是“大手笔”:入股资金为2000万美元,并且后续还需要承担不菲的研发费用和里程碑费用,中国II期临床试验最新数据中显示:ORR为79.8%,DCR为96.6%,12个月总生存(OS)率为91.4%。
7、全球首款anti-TROP2 ADC药物—戈沙妥珠单抗
Immunomedics(吉利德收购)研发的全球首款TROP2 ADC最早于2020.4美国分别获批三阴性乳腺癌和尿路上皮癌。基于此前良好的临床试验结果,本品被纳入CSCO 乳腺癌 2022指南,Ⅲ期ASCENT研究显示,接受过≥2线标准化疗的转移性三阴性乳腺癌,戈沙妥珠单抗组对比医生选择的化疗方案,PFS分别是 5.6个月 vs 1.7个月,OS分别为 12.1个月 vs 6.7个月,ORR分别为35%和5%,整体安全性良好。2019年Immunomedics与云顶新耀签订许可协议,交易金额8.35亿美元。2022.6本品在中国获批三阴性乳腺癌,2022.8月云顶新耀退回Trop2-ADC开发权益,获得4.55亿美元对价。
图注:Sacituzumab Govitecan临床效果
8、全球首款CRLA4/PD-1双抗,填补了国产双特异性抗体药物研发的市场空白—卡度尼利单抗
康方生物自主研发的CTLA4/PD-1双抗于2022.6月NMPA批准用于治疗复发或转移性宫颈癌。卡度尼利基于康方生物专有的Tetrabody平台技术研发而成的人源四聚体双抗,能够同时靶向两个经过验证的免疫检查点分子。II期临床显示卡度尼利单抗单药治疗经含铂化疗失败的复发或转移性宫颈癌,无论患者PD-L1状态,卡度尼利单药2/3线治疗的ORR达到33.0%,CR达到12%;治疗PD-L1+患者(CPS≥1)的ORR高达43.8%。目前产品国内首家13220元/支(125mg/瓶),成人推荐剂量为6mg/kg,2周一次直至疾病进展,意味着一次输注需花费约4万元。
而最近康方生物另一款PD-1/VEGF双抗依沃西单抗(III期临床)美国、加拿大、欧洲和日本权益授权给Summit Therapeutics公司,后者将支付5亿美元预付款,以及最高50亿美元的总交易金额,打破国产创新药海外授权纪录;康方生物保留依沃西单抗除以上地区之外的开发和商业化权利,包括中国。
新冠疫情持续三年,医药行业也面临资本寒冬,随着疫情防控的逐步放开,相信在2023年会激发更多企业的创新活力,我们期待有更多创新药获批上市,随着医药改革、医学研究和无数患者与医疗工作者的共同推动,肿瘤领域乃至各个疾病领域,都会迎来新的曙光!
来源:BiG生物创新社





























评论
加载更多