01
肿瘤疫苗概述
肿瘤疫苗的原理大致如此:肿瘤疫苗靶向肿瘤相关抗原(TAA)或肿瘤特异性抗原(TSA),通过活化CD8+T细胞达到初步激活主动免疫杀伤癌细胞的作用。而后裂解的癌细胞又会释放不同种类的肿瘤抗原经APCs(例如:DCs)提呈给T细胞,进而引发更为广泛的抗肿瘤应答。
肿瘤疫苗的类型:肽段疫苗,树突细胞(DC)疫苗,核酸疫苗(mRNA或者DNA疫苗),病毒疫苗以及原位肿瘤疫苗。这几种疫苗作为当下研究的热点也各有利弊。
然而,一系列肿瘤疫苗的试验结果并不理想,这意味着目前肿瘤疫苗的研发还有很大的局限性。
目前抗肿瘤疫苗的研发面临着以下几个难点:
①疫苗分子的选择。选择什么样的靶标既有较强的免疫原性又在肿瘤细胞上特异性表达以及选择什么样的抗原表位可以更好地与MHC分子结合。
②递送系统的选择。为疫苗选择什么样的载体才能增强组织穿透能力。
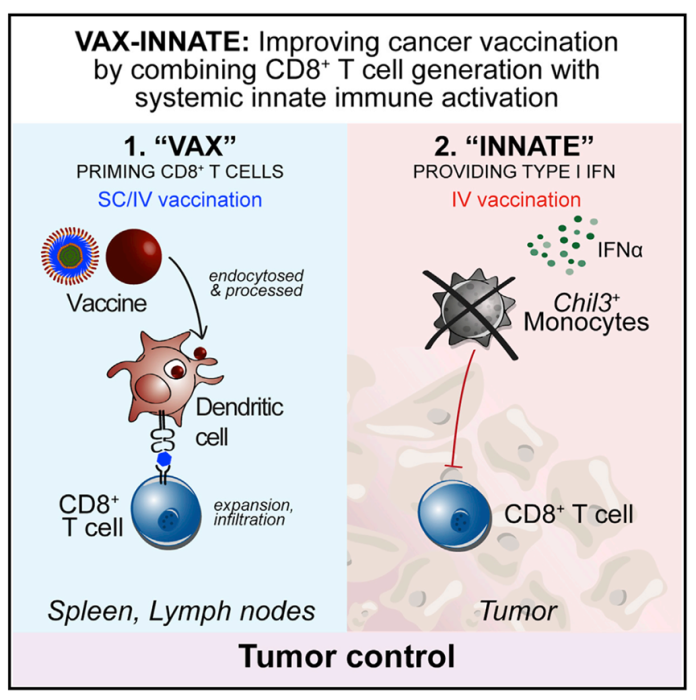
③肿瘤微环境(TME)的改善。近日美国过敏性和传染病研究所疫苗研发中心的Robert A. Seder团队便把目光集中在探讨最佳肿瘤疫苗方案,并研究了它们所设计的注射型纳米颗粒疫苗(SNP-IV)如何通过固有和适应性免疫机制重塑TME介导肿瘤消退,并将相关内容发表于Cell之上。
研究结果表明,与SNP-SC(皮下)相比,只有SNP-IV导致了荷瘤小鼠的肿瘤消退。进一步探究其机理发现,该现象依赖于全身性Ⅰ型干扰素介导的TME重塑,例如具有Chil3+单核基因标志(其富集与恶性肿瘤较差预后相关)的髓样细胞在SNP-IV治疗后明显减少。
由此可见,复杂的TME对肿瘤疫苗发挥效果起到了重要的作用,如何逆转肿瘤出于自我保护而对微环境的“驯化”,让TME为肿瘤疫苗所用也成为了肿瘤疫苗的开发重点。
今天我们所要谈论的就是肿瘤疫苗可以通过何种方法改善TME。
02
肿瘤疫苗重塑TME
a) 扩大DC的免疫原性提高抗原提呈
-
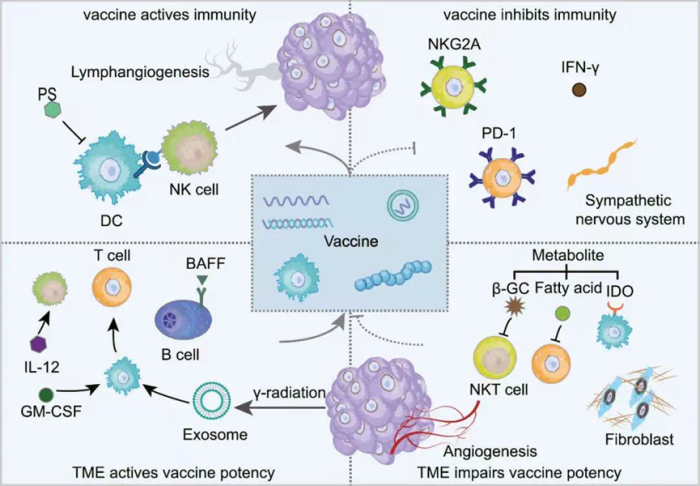
DC细胞作为固有免疫中的关键APCs,通常会在肿瘤疫苗中充当高效载体。DC疫苗可以通过与Toll样受体(TLR)激动剂或者免疫原性细胞死亡(ICD)诱导剂的偶联激发DC细胞成熟和疫苗免疫原性,以达到提高获得性免疫应答的目的。
b) 靶向肿瘤血管增强疫苗杀伤作用
-
肿瘤相关的血管生长是肿瘤发生发展的关键。许多研究表明抗血管疫苗可以在不引起显著毒性的情况下有效杀伤肿瘤。影响肿瘤血管形成的因素有很多,其中血管内皮生长因子(VEGF)是肿瘤血管生成因素中研究较为广泛的一个领域。例如:靶向Flk-1(小鼠VEGF2的同源类似物)的LLO-Flk1疫苗可以在不造成显著副作用的前提下介导肿瘤血管损伤,并且即使在妊娠期和伤口愈合期都可以安全使用,这表明靶向肿瘤血管相关因子在治疗中的重要作用。
同为血管生成因子的基础纤维生长因子(bFGF或FGF-2)会在黑色素瘤细胞上特异表达,这也使其成为了黑色素瘤治疗的一个既安全又高效的靶点。研究表明,以人重组FGF-2蛋白为外源性抗原的肿瘤疫苗可以有效抑制黑色素瘤和肺癌的转移,又一次证明了这一观点。
而除了靶向血管生成相关因子之外,针对肿瘤血管生成研发疫苗的又一条思路是靶向血管本身。SAN-RAVAC是通过蛋白质组学技术得出的已验证肿瘤的表面自然靶抗原集,以SAN-RAVAC为抗原的肿瘤疫苗可以破坏多种肿瘤内皮细胞。研究表明,在对正常细胞产生不良影响之前,它可以破坏17%的靶标肿瘤血管,并且避免了个体化疫苗疗法中收集病人生物材料,加工可用抗原的冗长步骤。
c) 肿瘤疫苗驱动淋巴管生成提高疫苗诱导的免疫原性
-
VEGF-C驱动的淋巴管生成提高疫苗诱导的免疫原性,根据这一原理,研发人员开发了一种淋巴管生成疫苗,这种疫苗由经过致死辐射的过表达VEGF-C的黑色素瘤细胞以及VEGFC疫苗构成。
d) 肿瘤疫苗靶向CAFs改善免疫抑制微环境
-
肿瘤相关成纤维细胞(CAFs)是免疫抑制TME的重要组成部分。成纤维细胞活化蛋白(FAP)作为一种在CAFs上过表达,而在正常组织上低表达或不表达的蛋白。因此它也成为了一种疫苗研发理想抗原。
表达FAPα的DNA和DC疫苗可以初步减弱TME中胶原Ⅰ和其他基质因子的表达;FAP DNA疫苗可以促进乳腺癌TME中Th2表型向Th1表型的转变。而以重组腺病毒为载体的FAP疫苗却没有收到理想中效果,其原因可能是IL-10的高表达,这意味着在癌症治疗的过程中,考虑靶向CAFs相关蛋白的同时,也应考虑到多种细胞因子与之联合。
e) 细胞因子辅助疫苗改善TME
-
复杂多样的细胞因子是TME的重要组成部分,IDO1,GM-CSF,IFN-γ,白介素以及BAFF等细胞因子的辅助更是可以帮助疫苗发挥效用。由经过基因修饰后可分泌GM-CSF的肿瘤细胞构成的GVAX疫苗已在超过600个病例中试验,早期临床试验数据表明,GVAX疫苗在多种肿瘤中都表现出了较高的抗肿瘤活性;IL-15修饰的DNA疫苗表现出了相较于重组IL-15更低的毒性以及给更高的治疗效果。
f) 肿瘤疫苗调节新陈代谢模式形成“热肿瘤”
-
缺氧,糖酵解,细胞外酸中毒以及乳酸和腺苷的累积是肿瘤代谢的主要特征,也是“冷肿瘤”形成的要素,而肿瘤疫苗就可以逆转这样一种状况。肿瘤疫苗载体TA-Met@MS可以促进代谢模式从糖酵解到脂肪酸氧化的转变从而提高T细胞的存活率和促进记忆T细胞的分化。
磷脂酰丝氨酸(PS)是一种表达在肿瘤细胞膜内侧的阴离子磷脂,它可以通过抑制DC细胞的成熟以及刺激TGF-β和IL-10分泌发挥持续性免疫抑制作用。阻断PS成为肿瘤疫苗提高效用的又一策略。研究表明,肿瘤疫苗可以联用膜连蛋白5A或者2Ag4以达到阻断PS,达到提高疗效的目的。
g) 抗免疫检查点治疗联合肿瘤疫苗发挥协同抗肿瘤作用
-
研究表明,分泌GM-CSF的膀胱癌疫苗GVAX可以上调PD1+的衰竭型T细胞,GVAX和抗PD-1药物的联用可以提高肿瘤小鼠的生存率。相比于单一治疗,靶向胃泌素的PAS疫苗与抗PD-1治疗的联用可以明显减少肿瘤生长和提高T细胞的免疫应答。在一个评估ISA101(HPV疫苗)和纳武利尤单抗(PD-1抑制剂)联用治疗难治性HPV-16阳性固体肿瘤效果的单臂临床Ⅱ期试验中,34个病例的ORR相对于单用PD-1抑制剂显著提高(33% vs 16%~22%)。因此,检查点抑制剂(ICB)与肿瘤疫苗的联用有望逆转一些低免疫原性恶性肿瘤的不良治疗效果。
h) 靶向治疗联合肿瘤疫苗降低肿瘤抗性
-
研究表明,OVA肽段疫苗与抗CD4单抗(显著性减少Treg细胞)联用可以延长荷瘤小鼠的生存期;CTGF/E7 DNA疫苗联用mTOR抑制剂(延长DC细胞寿命)可以提高TME中成熟DCs的百分比。
i) 传统化疗与放疗刺激免疫支持性应答协同肿瘤疫苗发挥作用
-
越来越多的研究证明化疗和可以通过增加肿瘤抗原暴露转变免疫抑制TME,而放疗也可以利用ICD诱导的远端效应刺激免疫支持应答。例如:吉西他滨与HER2 DNA疫苗联用可以提高肿瘤细胞对于CTL介导的杀伤作用的敏感性;Epitopoietic开发的Gliovac疫苗(用于复发性胶质母细胞瘤)和口服环磷酰胺与GM-CSF联合用药可以进一步激活免疫系统。
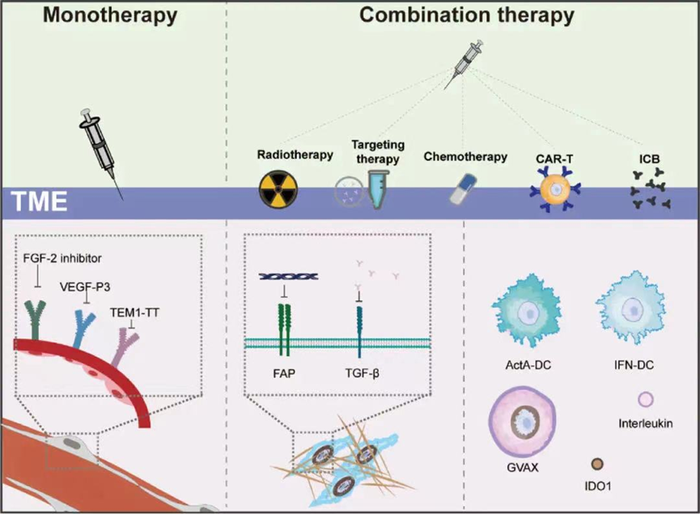
总而言之,靶向TME的癌症疫苗是动员细胞外组分杀伤肿瘤细胞的有效途径,调控抑制性TME也成为逆转癌症疫苗固有耐药性和获得耐药性的共同突破口,也成为了探索肿瘤疫苗联合治疗的一个方向。
尽管肿瘤疫苗现阶段的发展与应用被其他类型的肿瘤免疫治疗暂时夺去了光彩,但肿瘤疫苗仍然拥有无法取代的闪光点。在CAR-T细胞可以针对肿瘤表面特异性抗原发挥高效作用的同时,我们不能忘记肿瘤疫苗靶向广阔细胞内抗原的巨大潜力;在免疫检查点抑制剂利用微环境中原有的T细胞治疗“热肿瘤“的同时,我们不能忘记肿瘤疫苗可以在“冷肿瘤”中激活新生的肿瘤反应性T细胞发挥杀伤作用。
据不完全数据统计,全球范围内有16个治疗性肿瘤疫苗获批上市,500多种疫苗在研。科学家们似乎没有被之前的种种“滑铁卢”打败。纵观癌症治疗发展史,肿瘤疫苗似乎也在走“先辈们走过的路”。从多种单克隆抗体在临床上惨遭失败到利妥昔单抗1997年的大获成功经历了20年之久;从抗PD-1抗体在临床效用上节节败退到纳武利尤单抗的数据第一次昭告天下也经历了数年之久;CAR-T治疗在血液肿瘤上的成功也经历了数年的纠正和打磨。肿瘤疫苗也正是在经历这样的阵痛而努力迸发出强大的生命力。
1. Lin MJ, Svensson-Arvelund J, Lubitz GS. Cancer vaccines: the next immunotherapy frontier. Nat Cancer. 2022 Aug;3(8):911-926.
2. Grenier JM, Yeung ST, Khanna KM. Combination Immunotherapy: Taking Cancer Vaccines to the Next Level. Front Immunol. 2018 Mar 22;9:610.
3.Baharom F, Ramirez-Valdez RA, Seder RA. Systemic vaccination induces CD8+ T cells and remodels the tumor microenvironment. Cell. 2022 Oct 20:S0092-8674(22)01321-6.
4. https://doi.org/10.1016/j.fmre.2022.03.009















评论
加载更多