不可成药靶点,在免疫疗法里寻找出路
p53联合免疫疗法的基础:调节TME
癌症中TP53突变的主要后果是肿瘤抑制功能丧失,需要蛋白质的治疗性再激活,而大多数癌症相关的小分子药物实际上通过抑制过度的蛋白质活性起作用。因此,p53长期以来一直被认为是不可成药的。
但,除了错义突变影响氨基酸、对细胞自主活性的调控外,wtp53和mutp53还可以调节TME。癌细胞中p53功能的丧失会对肿瘤免疫微环境(TIME)产生细胞非自主影响,恢复这些癌细胞中的p53功能可能会使它们对免疫检查点抑制等方案敏感。
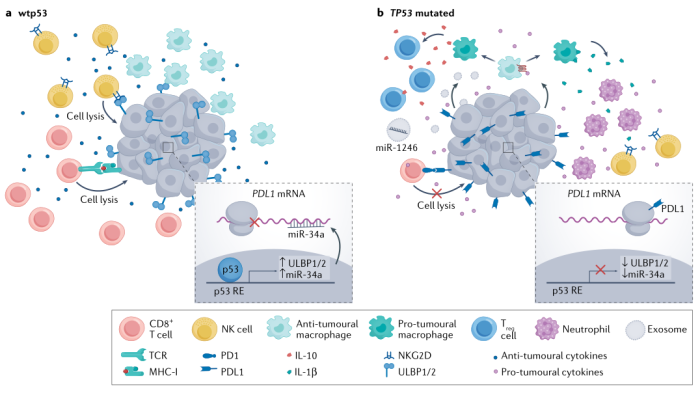
Nat Rev Drug Discov (2022).
功能性wtp53倾向于增强TME的肿瘤限制,缺失wtp53则造成TME倾向于促癌。
wtp53可上调NK细胞配体ULBP1、ULBP2和PDL1 mRNA阻断剂miR-34a的表达。
wtp53可以促进TNF等抗肿瘤细胞因子的分泌;
p53功能的丧失可以驱动WNT配体的分泌,WNT配体与巨噬细胞上的同源受体结合,使巨噬细胞分泌IL-1β,吸引中性粒细胞等癌前细胞。
mutp53蛋白促进外泌体的分泌,传递miR-1246等miRNA,将抗肿瘤的M1巨噬细胞转化为促肿瘤的M2巨噬细胞。
p53相关免疫疗法
目前,大多数基于p53的免疫疗法临床试验使用免疫检查点抑制和p53激活剂(基因疗法或小分子)的组合。
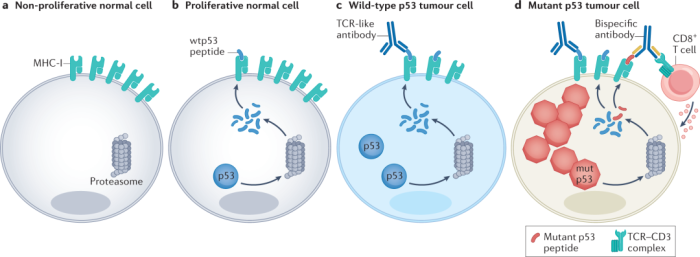
其能够尝试免疫疗法的基础在于:正常细胞仅表达非常低量的p53,而携带TP53错义突变的肿瘤细胞过度表达p53。实际观察中,T细胞对p53的反应不受自然自我耐受的限制。
然而,在处于快速增殖期的健康祖细胞中,TP53 mRNA的表达相对显著,具有一定的脱靶风险。
TAA肿瘤疫苗:
合成长肽(SLP)疫苗:
包含来自wtp53序列的十个重叠肽,用于引起转移性结直肠癌中以CD4+ T细胞为主的T细胞免疫反应。虽然当时有效性尚可,长期随访结果显示存在p53特异性增殖反应和IFN-γ增加,但相较二次化疗的治疗效果无统计学差异。
牛痘病毒安卡拉(MVA)疫苗联合化疗:
相比未扩增CD8+ T细胞的难治性胃肠道癌和卵巢癌患者,MVAp53疫苗免疫应答的患者无进展生存期增加。目前正在进行2项联合帕博利珠单抗的临床试验(2期:NCT03113487,1期:NCT02432963)。
mRNA DC疫苗:
自体TP53 mRNA转染的DC疫苗引入乳腺癌患者后,超过72%(13/18)在肿瘤中具有高p53表达的患者能够产生p53特异性IFNγ T细胞反应,IL-2的分泌显著增加。
抗体:
TCR样抗体:是一种潜在的靶向细胞内蛋白质的策略,可以识别MHC类表位在细胞表面的显示。通过筛选合适的衍生表位,可以选择性靶向癌细胞而不靶向正常外周血单核细胞。
临床前实验表明p53 TCRm抗体可在乳腺癌异种移植的小鼠模型中诱导肿瘤消退。
另一款基于wtp53的TCRm抗体P1C1TM还能够诱导一些p53丰度较高的细胞中的选择性抗体依赖性细胞毒性,促进药物传递到p53突变的癌细胞中,有一些ADC的意味。
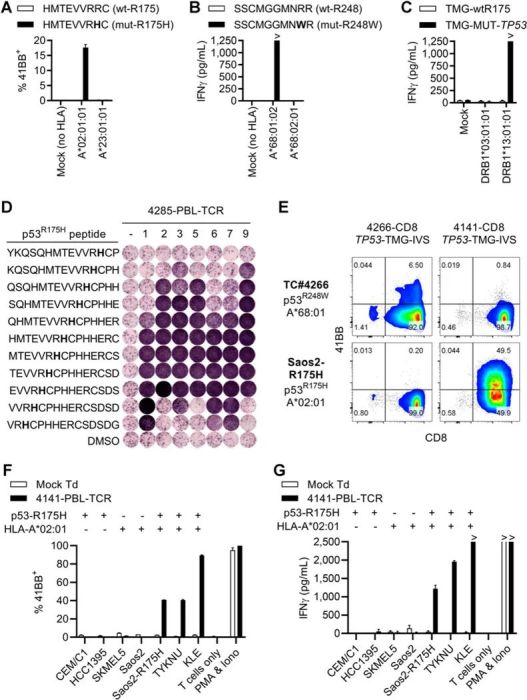
Clin Cancer Res. 2020 Mar 15;26(6):1267-1276.
突变新抗原:
人类癌症中TP53错义突变的广泛多样性提供了大量潜在的新抗原。近期研究显示,突变p53可能产生由MHC分子呈递的新抗原,并激活突变p53特异性免疫反应。产生TIL应答的患者外周血中也检测到特异性的反应性T细胞,可用于联合CAR-T等疗法。
双抗:
2021年的一项研究描述了靶向肿瘤抗原的MANAbody双抗可以识别来自p53(R175H)热点突变体和TCR-CD3复合体的新抗原。该双抗具有显著的选择性细胞毒性,目前处于临床前阶段。
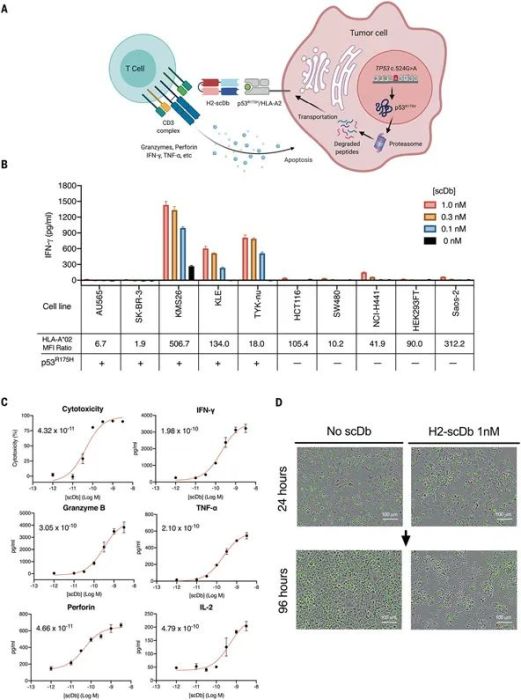
双抗H2-scDb在p53阳性肿瘤细胞下激活T细胞
Science. 2021 Mar 5;371(6533):eabc8697.
小结
针对这个不可成药靶点,目前双抗和TCR样抗体似乎又为其带来了新的研究活力。它的免疫基础和T细胞、NK细胞的杀伤毒性是紧密关联的,也涉及MHC Ⅰ类在TME中的作用。虽然p53作为靶点本身不一定就是那个答案,但是它的尝试思路可以作为其他潜力靶点的参考。
参考资料
1.Hassin, O., Oren, M. Drugging p53 in cancer: one protein, many targets. Nat Rev Drug Discov (2022). https://doi.org/10.1038/s41573-022-00571-8
2.Chiappori AA, Williams CC, Gray JE, Tanvetyanon T, Haura EB, Creelan BC, Thapa R, Chen DT, Simon GR, Bepler G, Gabrilovich DI, Antonia SJ. Randomized-controlled phase II trial of salvage chemotherapy after immunization with a TP53-transfected dendritic cell-based vaccine (Ad.p53-DC) in patients with recurrent small cell lung cancer. Cancer Immunol Immunother. 2019 Mar;68(3):517-527. doi: 10.1007/s00262-018-2287-9. Epub 2018 Dec 27. PMID: 30591959; PMCID: PMC6426813.
3.Hsiue EH, Wright KM, Douglass J, Hwang MS, Mog BJ, Pearlman AH, Paul S, DiNapoli SR, Konig MF, Wang Q, Schaefer A, Miller MS, Skora AD, Azurmendi PA, Murphy MB, Liu Q, Watson E, Li Y, Pardoll DM, Bettegowda C, Papadopoulos N, Kinzler KW, Vogelstein B, Gabelli SB, Zhou S. Targeting a neoantigen derived from a common TP53 mutation. Science. 2021 Mar 5;371(6533):eabc8697. doi: 10.1126/science.abc8697. Epub 2021 Mar 1. PMID: 33649166; PMCID: PMC8208645.
4.Malekzadeh P, Yossef R, Cafri G, Paria BC, Lowery FJ, Jafferji M, Good ML, Sachs A, Copeland AR, Kim SP, Kivitz S, Parkhurst MR, Robbins PF, Ray S, Xi L, Raffeld M, Yu Z, Restifo NP, Somerville RPT, Rosenberg SA, Deniger DC. Antigen Experienced T Cells from Peripheral Blood Recognize p53 Neoantigens. Clin Cancer Res. 2020 Mar 15;26(6):1267-1276. doi: 10.1158/1078-0432.CCR-19-1874. Epub 2020 Jan 29. PMID: 31996390; PMCID: PMC7424598.
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多