如何为 CGT 项目选择合适的 CDMO
Part
1
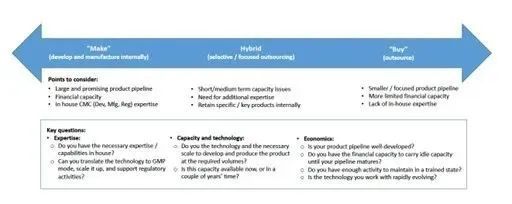
何时(或是否)与 CDMO 合作以满足全部或部分生物工艺开发需求,或者是否将这些活动保留在内部,已成为许多文章、评论和讨论的主题。在评估是否在内部开发和/或制造生物治疗药物,或者将这些活动外包给外部合作伙伴时,这些评论涉及广泛的范围、专业知识、能力、质量体系和风险等主题。
-
专业知识。确定内部是否存在必要的专业知识/能力。这至少可以包括科学和技术专业知识,但也可以扩展到相关专业知识,例如将生产和分析技术转化为当前良好生产规范 (cGMP) 模式、放大规模或支持监管活动的能力(例如,文件提交) -
产能和技术。 分析和生产技术是否具有开发和/或生产所需数量的产品所需的规模和标准? 这种产能是现在可用,还是正在建设中并且在几年后才会上线? 经济性。产品线是否充分开发,以利用内部产能(基于当前或未来预期的产能需求)?公司的财务能力如何?在管线成熟、以填补这一产能之前,是否足以承载闲置的生产能力?是否有足够的活动来维持劳动力的参与和训练有素的状态?使用的工艺和分析技术是否快速发展并需要经常更新设备、方法、培训等?组织还必须确定是否有预算来维持最先进的生产技术。
Part
2
Part
3
人们经常担心 CGT 制造的高成本以及对 CMC 项目的控制水平,许多项目目前会外包给 CDMO,虽然开发商也在逐步建立自己的内部能力。关于可用产能的缺乏也有强烈的情绪,这更具体地与生产线可用性和周转时间有关。例如,从订单到批次完成所要求的 6 到 9 个月的周转时间,而不是建议的 12 到 18 个月的周转时间,可能与整体计划时间表不一致。
在 CGT 领域与 CDMO 合作的成本有时看起来很高,但实际上可能与在内部进行此类工作的比较成本差别不大。一般而言,即使对于使用充分平台化的工艺并以高效方式运营的大型制药公司而言,制造生物药原料药批次(例如 mAb)的成本通常为每批次数百万欧元,其中,对于相关药物产品批次,可能还需要 50-70%的额外费用。这些成本的主要驱动因素是设施利用率(资产成本和折旧、公用设施等)、人员和原材料。工艺的经济效率可以引用为每Z 克 DS的 X$(或 X$/DP 小瓶),产量越高,工艺被认为效率越高,并且 X$/Zg 或小瓶可以作为类似药物类别的基准(例如,用于 mAb)。这种方法通常更严格地应用于生物药的商业供应,而在临床供应阶段,成本通常以每批次为基础,有时无法保证固定产量,因为该工艺可能正在开发中并且其性能在不断演变。作为药物开发商,当合同服务提供商第一次向他们提出这些成本时,这些成本可能看起来很高 - 尤其是在不承诺最终产量的情况下。但在许多情况下,这些成本与开发商在内部完成所有工作时所需要的成本相似或更低。
在考虑对控制的看法时,产品开发商常常感到沮丧的是,合同服务提供商出现的问题会给他们的项目带来问题。确实,此类挫折会对整个产品开发时间表甚至公司的财务状况产生严重影响。这可能会导致人们相信 CGT CMC 活动在内部进行更好,因为这可以实现更直接的控制,并因此获得更可靠的结果。
Part
3
让我们分解一下,从大型组织的角度以及小型生物技术公司的角度审视与 CDMO 的合作。对于一家拥有深厚财力且产品线前景良好的大公司,如果公司有财力建造、购买或改造必要的设施(生产和检测)并进行招聘、培训和发展不同的支持团队,那么在内部做这件事可能更有意义。根据具有一定规模和财务能力的公司如何看待未来几年的管线发展,也许“做出决定”就是最好的决定。但是有了所有这些(工厂设施、训练有素的人员等),大公司必须按时为他们的产品管线做好准备,并考虑他们竞争对手的产品(以及他们预期的上市时间)。如果时间与产品里程碑不一致,那么与合同服务提供商建立中期合作伙伴关系可能是一个谨慎的选择(“混合”模式)。这可以让公司继续在内部开发与他们选择的平台(生产和分析)一致的产品,同时通过 CDMO 提供临床材料。CDMO 在这方面通常非常灵活,可以适应不同的平台。
另一方面,许多年轻和/或规模较小的生物技术公司可能没有相关的技能或经验来指导他们自己的 CMC 活动。在某些情况下,团队专注于直接的产品方面(临床评估、融资等),没有能力或经验来开发和推动 CMC 项目。可以聘请经验丰富的 CMC 专业人员,使公司能够开发 CMC 计划,但他们可能没有所有相关领域的经验。因此,与 CDMO 合作可能是这里的审慎选择。这些公司的一个关键考虑因素可能是生产和分析的“可移植性”,因为公司或其产品资产可能会在未来被另一家已经拥有内部 CMC 能力或正在与不同的首选供应商合作的公司收购,对此,将项目转移到另一家供应商不应成为潜在交易(生物技术公司与收购公司之间)的障碍。
如今,许多产品开发商都希望与 CDMO 建立合作伙伴关系,而不仅仅是交易关系。这两种方法之间存在巨大差异:服务收费与基于信任、理解和共享观点的合作伙伴关系,旨在长期运行(无论是针对一种产品还是基于类似技术的多种产品)。对于使用大型或复杂产品(例如基因疗法)的公司而言,这两种模式的结果并不总是相同,因为一些严重的问题可能导致需要更改生产地点,这是一项代价高昂的工作,可能会产生重大影响,延迟整体产品开发计划。因此,许多产品开发商会以一个长期的维度,评估潜在的 CDMO,即使工作的初始阶段可能只需要早期工艺开发或生成用于临床前评估的材料。但即使对于早期阶段的活动,评估过程也可以包括评估计划将如何在未来三到五年的不同开发阶段演变。
-
您如何进行工艺表征和工艺验证? -
您能支持我们撰写监管文档吗? -
您在这方面有什么经验?
最后,与 CDMO 合作的一个值得强调的关键优势是,他们通常在多个不同项目中获得了丰富的经验。在许多情况下,他们在以前的项目中看到并学到了对您的项目有益的东西(同时保持客户机密性和尊重知识产权)。这是其它公司可能尚未在内部获得的经验类型,但它可能是项目成功的关键。在评估与经验和能力有关的控制和成本方面的问题时,这通常有很多好处。
总之,选择是内部开发和生产生物制药产品,还是外包这些活动,是一项复杂且高风险的决定,这可能对产品开发计划的成功产生深远影响。在这种评估中应考虑许多因素;但在许多情况下,这归结为围绕专业知识、产能/技术和经济性的关键考虑因素。CGT 产品引发了额外的困境。不同的情况,例如内部能力和产能,可能会引导公司在短期或长期内做出不同的选择。如果决定外包,考虑到产品的复杂性以及 CGT 行业的技术和监管演变,以质量为中心、基于合作伙伴关系的方法对于未来的成功至关重要。
原文:B. Mullan, “Choosing the Right CDMO for CGT Programs," Pharmaceutical Technology 46 (10) 60–64 2022.
END
来源 | 网络
责任编辑 | 胡静
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多