ADC药物抗体比(DAR)的表征分析方法
疏水作用层析(HIC)
HIC-HPLC是一种成熟的技术,用于根据ADC的固有疏水性来分离ADC。目前,HIC被认为是研究半胱氨酸偶联的ADC药物分布、裸抗含量和平均DAR的标准方法,并且只需要很少的样品量。以DAR小于7-8的传统基于半胱氨酸的ADC通常产生主要的五个种类(DAR=0、DAR=2、DAR=4、DAR=6和DAR=8)和少量的奇数DAR物种。HIC柱可以根据每种DAR种类不同有效载荷数量的疏水性位移来分离混合物中的这些物种,生成的色谱图可以用于计算DAR(图1)。由于HIC可以在天然条件下分离DAR种类,因此它不仅用于DAR的分析测定,而且还用于纯化。结合位点特异性的偶联和通过HIC纯化可以制备位点特异性和均一的DAR ADC。
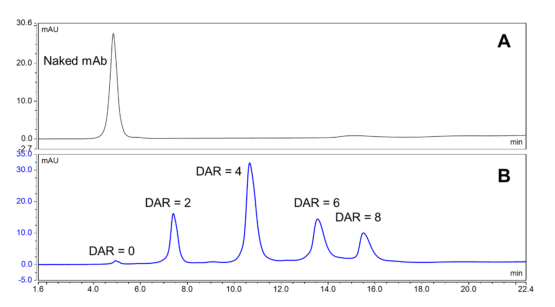
图1. 基于半胱氨酸偶联ADC的HIC分析
然而,HIC分离也有一些缺点。这项技术不能提供与MS分析的兼容性,因为HIC要求在流动相中有高初始浓度的低挥发性盐。HIC分离的另一个缺点是ADC种类的回收率较低。
反相液相色谱(RPLC)
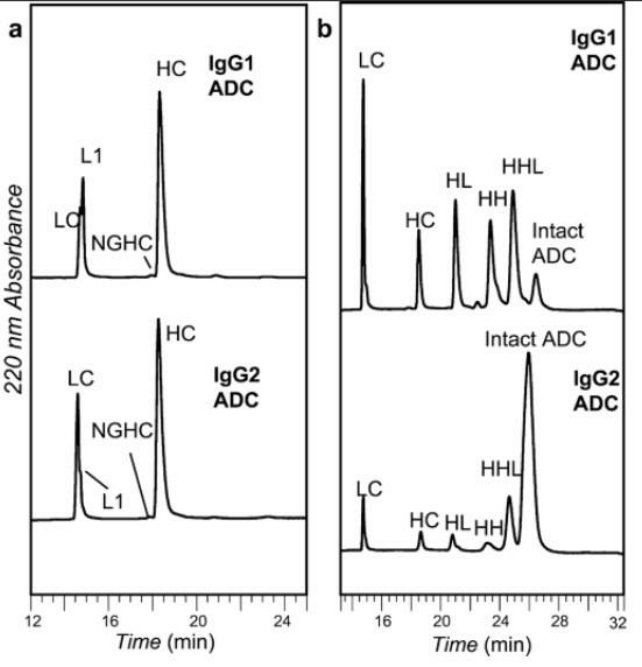
RPLC最常被用于评估平均DAR。HIC和RPLC的主要区别是蛋白质在RPLC条件下变性。因此,半胱氨酸偶联的ADC不能被完整地洗脱,因为mAb的L和H链之间的链间二硫键被破坏。RPLC主要用于分离与H和L相关的还原ADC的DAR种类,也可用于天然ADC分离L、H、HH、HL和HHL片段(图2)。这些峰在RPLC条件下可以很好地分开,以允许计算平均DAR。在RPLC中,与固定相的相互作用主要是通过蛋白质的非极性氨基酸和固定的N-烷基配体之间的疏水作用来实现的。溶质按其分子疏水性递增的顺序洗脱。
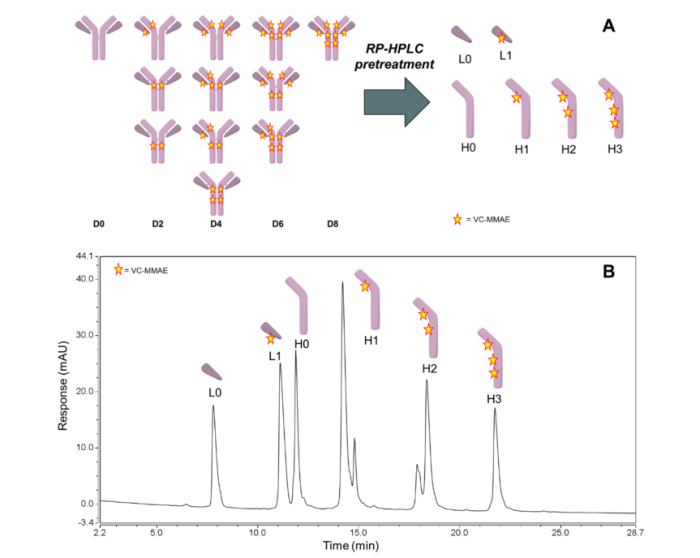
图2. 基于半胱氨酸ADC的RPLC分析
RPLC方法的一个缺点是测量(柱温)所需的升高温度和使用胍和DTT联合使用的变性预处理都可能会降低ADC的种类。这种潜在的降解可能会导致通过RPLC计算的DAR低于HIC或其他分析的DAR。最近些年也报道了在没有任何样品预处理的情况下对完整的ADC进行RPLC分析。
液质联用(LC-MS)
另一种确定DAR的重要方法是LC-MS。高效液相色谱与MS系统的结合是完整和亚单位ADC分析的常用方法(图3)。该技术不仅可以提供有效载荷分布,还可以提供每个DAR种类的分子量。
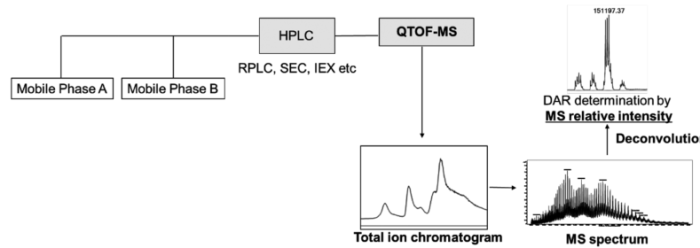
图3. LC-MS测定DAR值
利用LC-MS进行ADC分析需要进行预处理,最近的一些研究集中在优化LC-MS的预处理上。例如,N-糖苷酶F的脱糖作用通常用于消除峰出现的复杂性。使用还原剂DTT可以得到ADC的重链和轻链,还原后通常进行烷基化以防止二硫键的重新形成。
因此,LC-MS作为一种理想的DAR测量方法具有很大的潜力。然而,这种方法可能不适用于特别亲水性的有效载荷。
紫外-可见(UV/Vis)光谱
UV/Vis光谱是一种简单方便的方法来确定ADC中与抗体偶联的药物的平均数量。这种方法要求药物和抗体的UV/Vis光谱具有不同的Amax值。由单抗在Amax处的ADC吸光度和消光系数以及药物在Amax处的消光系数可以确定药物的平均DAR(图4)。目前,该技术已被广泛应用于多种ADC药物的检测,如DM1、Calicheamicin类似物和vc-MMAE。
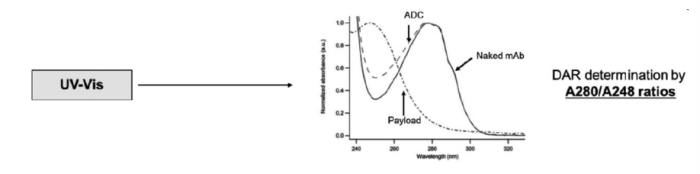
Ellman法是一种硫醇滴定方法,通过用UV/Vis在412 nm处测量吸光度来计算抑制率。Ellman试剂与游离的巯基反应,生成最大吸收波长在412 nm的2-硝基-5-巯基苯甲酸。该方法可以应用于基于半胱氨酸的ADC,因为共轭后可以测量残留的硫醇基团,因此可以间接计算DAR。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多