全球首款BCMA/CD3双抗:强生TECVAYLI获FDA批准上市
Tecvayli通过加速审批程序获得批准。该适应症的持续批准,将取决于验证性试验中临床疗效的验证和描述。
值得一提的是,Tecvayli是第一个被批准用于治疗多发性骨髓瘤(MM)的双特异性抗体疗法(BCMAxCD3)。Tecvayli是一种即用型(off-the-shelf)产品,通过皮下注射给药。在美国和欧盟,Tecvayli分别被授予了突破性疗法认定(BTD)和优先药物资格(PRIME)。
Tecvayli是一款首创的(first-in-class)BCMAxCD3双特异性T细胞结合抗体,能够靶向结合T细胞表面表达的CD3受体以及多发性骨髓瘤(MM)细胞和一些健康B系细胞表面表达的B细胞成熟抗原(BCMA)。CD3参与激活T细胞,BCMA在MM细胞上表达水平显著升高。Tecvayli将CD3阳性T细胞重新定向到表达BCMA的MM细胞,以诱导针对靶细胞的细胞毒作用。
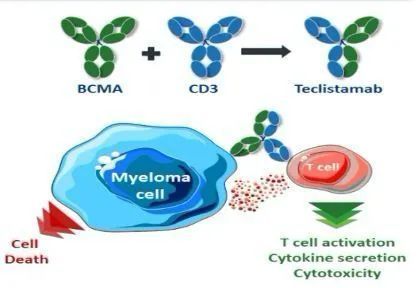
在体外,teclistamab能够激活T细胞,引发各种促炎性细胞因子(proinflammatory cytokine)的释放,导致多发性骨髓瘤(MM)细胞裂解。临床前研究表明,teclistamab可杀死来自先前接受过多种方案治疗(过度预治疗)R/R MM患者的骨髓瘤细胞系和骨髓源性骨髓瘤细胞。
Tecvayli代表着杨森获得监管批准的第4款多发性骨髓瘤疗法,将进一步丰富其行业领先的肿瘤学产品组合。Tecvayli的批准上市,将为治疗选择有限的R/R MM患者群体提供一种重要的新治疗选择。
Tecvayli的生产和开发遵循了杨森生物科技公司与Genmab签订的使用DuoBody®技术平台的许可协议。目前,Tecvayli正在多项单药治疗和联合治疗临床研究中进行评估。

MajesTEC-1研究结果(图片来源于:Tecvayli美国处方信息)
此次批准基于关键1/2期MajesTEC-1研究(NCT03145181[1期],NCT04557098[2期])的结果。这是一项开放标签多中心临床试验,在先前已接受过多种方案治疗(heavily-pretreated,过度预治疗)的复发或难治性多发性骨髓瘤(R/R MM)患者中开展,评估了teclistamab的疗效和安全性。
疗效人群包括110例患者(中位年龄:66岁[33-82]),先前治疗中位数为5线(范围:2-14),78%接受过至少4线治疗,81%接受过干细胞移植。所有患者先前均接受过3类药物(蛋白酶体抑制剂、免疫调节剂、抗CD38单抗)治疗,76%为三类药物难治(蛋白酶体抑制剂、免疫调节剂、抗CD38单抗)。疗效指标为总缓解率(ORR),由独立审查委员会(IRC)根据国际骨髓瘤工作组(IMWG)2016年标准进行评估确定。
结果显示,Tecvayli治疗的总缓解率(ORR)为61.8%(95%CI:52.1%,70.9%);特别是,28.2%的患者达到完全缓解(CR)或更好缓解(CR或严格的完全缓解[sCR])。在病情缓解的患者中,从治疗到首次确认缓解的中位时间为1.2个月(范围为0.2-5.5个月)。中位随访时间为7.4个月,中位缓解持续时间(DOR)尚未达到,估计的6个月时DOR率为90.6%(95%CI:80.4%,95.7%),估计的9个月DOR率为66.5%(95%CI:38.8%,83.9%)。
在MajesTEC-1研究的安全人群(n=165)中,最常见的不良反应(>20%)是发热、细胞因子释放综合征(CRS)、肌肉骨骼疼痛、注射部位反应、疲劳、上呼吸道感染、恶心、头痛、肺炎和腹泻。最常见的3至4级实验室异常(>20%)是淋巴细胞减少、中性粒细胞减少、白细胞减少、血红蛋白减少和血小板减少。
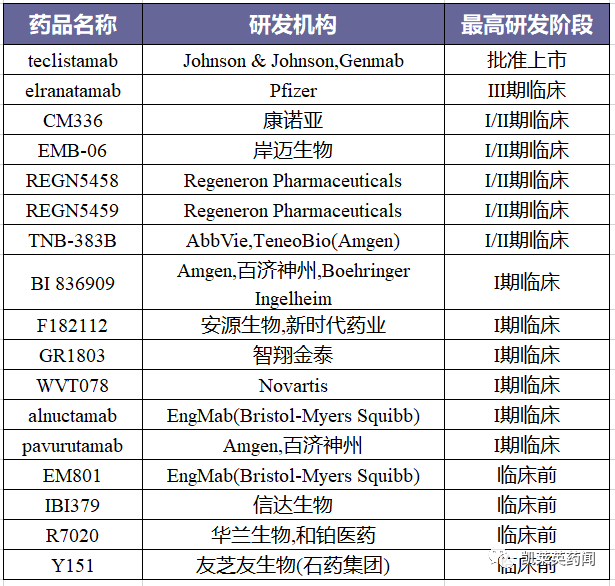
据不完全统计,目前在研的BCMA/CD3 双抗约17种,具体的药物统计如下:
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多