阿斯利康Lumoxiti,20年来首款获批用于毛细胞白血病的ADC

欧洲上市五个月后,撤市?
阿斯利康的Lumoxiti(Moxetumomab pasudotox,帕西妥莫单抗)于2018年9月13日获得FDA批准上市,用于治疗复发性或难治性毛细胞白血病(HCL,hairy cell leukemia)成人患者。这些患者至少接受过两种全身性治疗,其中包括嘌呤核苷类似物(PNA,purine nucleoside analog)疗法。
Lumoxiti是过去20多年来,首个美国获批治疗HCL的药物;2021年2月,又获EMA批准。但五个月后,同年7月EMA发布公告,撤销了它在欧盟的上市许可。该公告显示:阿斯利康出于商业原因,向EMA提出撤市申请,停止该产品的欧洲销售。
检索公开资料,推测此次撤市应该单纯是公司做出的商业考量,并非安全性问题。
(Lumoxiti,来源:阿斯利康)
Lumoxiti是一种无菌、无防腐剂、白色至灰白色冻干饼状或粉末状,规格为1 mg/瓶,用于静脉输液。
每个单剂量小瓶含有1 mg moxetumomab pasudotox、甘氨酸(80 mg)、聚山梨醇酯80(0.2 mg)、磷酸一钠一水合物(3.4 mg)、蔗糖(40 mg)和氢氧化钠,pH调至7.4。
(IV溶液稳定剂,来源:阿斯利康)
另外,每个单包装还配有一瓶1ml的IV溶液稳定剂,用于输液袋配置,不能用于重组Lumoxiti,也不能用于冲洗输液管路。
用法用量:推荐剂量为0.04mg/kg体重,静脉输注给药时间大于30分钟,在28天为一个周期的第1、3、5天给药,直至治疗六个周期或病情进展或出现不可接受的毒性。Lumoxiti不推荐用于存在严重肾功能损害,肌酐清除率大于29mL的患者。

首个获批治疗HCL的ADC
毛细胞白血病(HCL,hairy cell leukaemia)是一种惰性成熟B 细胞肿瘤,系一种少见的淋巴组织恶性肿瘤,其特征表现为贫血、出血、疲劳、脾肿大。
组织学表现为外周血及骨髓出现大量边缘不整齐,呈伪足状或纤毛样突出的白细胞,由于白细胞的胞浆有突起,并且纤细如毛,故名为“毛细胞”。
HCL是一种罕见的慢性白血病,占所有白血病的2%,男性和年龄较大的人群患病风险更高。在治疗初期,疾病进展缓解,经过初次治疗后,大多数患者的症状得到缓解,在很长一段时间内不会复发,但有30%-40%的患者五至十年内复发。
通常认为,HCL只能缓解,不会彻底消失,一旦恶化或复发,需要重新治疗,而且复发后疾病的缓解程度,取决于患者对所选治疗方案的反应敏感度,以及疾病的进展阶段。
目前,常用临床治疗方案有手术(如脾切除)、化疗(一线化疗药物有嘌呤类似物,如克拉屈滨和喷司他丁等),以及生物治疗等手段。
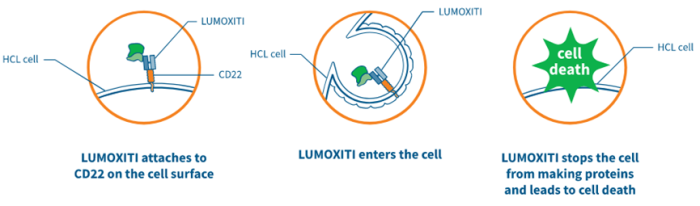
(Lumoxiti作用机制,来源:阿斯利康)
Lumoxiti是一种靶向CD22的抗体药物偶联物,也是全球首个获批用于治疗HCL的ADC。
系由一种重组鼠源IgG1抗体moxetumomab,通过可切割连接子与pasudotox融合而成。整个制备过程,采用了重组DNA技术,在大肠杆菌细胞中产生,在含有抗生素卡那霉素的营养培养基中进行发酵。
连接子采用了可切割的缬氨酸-瓜氨酸二肽连接子(Val-Cit),并与马来酰亚胺己烯酰(mc)、对氨基苄基甲酸酯(PABC)结合。
细胞毒性药物pasudotox,是一种抑制蛋白质合成的铜绿假单胞菌(绿脓杆菌)外毒素a的38kDa基因片段,简称PE38。
作用机制系pasudotox被内化后,催化延伸因子-2(EF-2)中二甲酰胺残基的ADP核糖基化,蛋白质合成抑制,导致细胞凋亡,杀死肿瘤细胞。
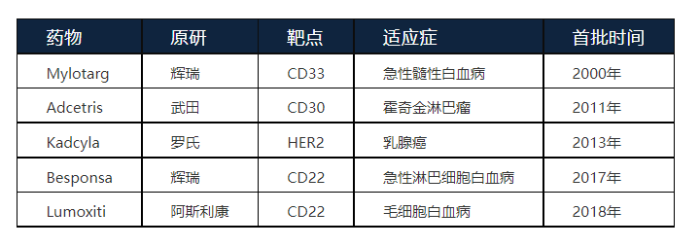
上期文章我们了解到,CD22这个靶点在大多数B细胞恶性肿瘤细胞表面高表达,是B细胞恶性肿瘤治疗的热门靶点之一。因此,Lumoxiti和Besponsa一样,都选择了靶向CD22。

Lumoxiti临床疗效和安全性
Lumoxiti获批基于一项单臂、多中心临床III期研究(Study 1053),该研究在全球十四个国家三十四个治疗中心开展,纳入80例复发性或难治性HCL成人患者。入组患者既往至少接受过两种系统性治疗,包括一种嘌呤核苷类似药,研究评估了Lumoxiti治疗的疗效和安全性。
研究显示,Lumoxiti单药治疗的总缓解率(ORR)为75%,完全缓解率(CR)为41%,部分缓解率(PR)为34%。持久的完全缓解率为30%,中位随访16.7个月后,中位完全缓解持续时间尚未达到。
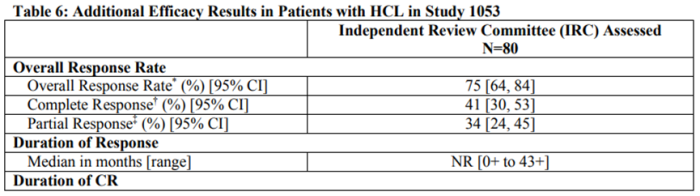
(Study 1053临床研究结果,来源:说明书)
安全性
Lumoxiti的黑框警告提示:有导致毛细血管渗漏综合征的风险,这是一种体液与蛋白质从细小血管泄漏到周围组织的症状。同时,还有溶血性尿毒综合征风险,这是一种导致红细胞异常破坏的症状。

研发之初,为何多数ADC的适应症都选择了非实体瘤呢?
首个可能的原因是,临床上的潜在需求大。
众所周知,非实体瘤大多数是血液系统恶性肿瘤(hematologic malignancy,HM),这是一类恶性程度高、治疗复杂、预后较差的造血系统疾病,包括白血病、淋巴瘤及多发性骨髓瘤等。与实体瘤相比,这一类血液系统恶性肿瘤多采用放疗、化疗,或联合骨髓移植等方式,可选的治疗方法十分有限。
以Lumoxiti适应症HCL为例,过去几十年间,患者的首选治疗策略是干扰素,后来的标准方案为嘌呤类似物。有研究报道,使用嘌呤类似物克拉屈滨治疗HCL一个疗程后,能使70-90%的患者获得完全和持久缓解。
嘌呤类似物治疗HCL预后佳,完全缓解(CR) 率高,但长期随访中发现,有30-40%的患者复发。对于这些难治复发的患者,或无法接受化疗的患者,当时没有其他更多药物可供选择,二十几年里也没有新的治疗药物上市。

近几年,随着免疫治疗、靶向治疗的发展,这类患者才逐渐有了更多选择。例如,最新2021版NCCN的《毛细胞白血病临床实践指南》将“Lumoxiti(Moxetumomab pasudotox)、Vemurafenib(威罗菲尼)”等纳入推荐治疗方案,用于疾病进展的复发难治HCL患者。
然而,仅有“临床需求”这个理由还不充分,另一个更重要的原因可能是:早期的ADC产品,用于非实体瘤治疗的临床获益,比实体瘤更显著。
也就是说,研发之初的几款ADC在非实体瘤中,表现出更高的临床价值,这类患者使用ADC治疗后,症状缓解、疾病改善。
这点,从血液肿瘤领域最成功的ADC可以看出来,全球第二款上市ADC、武田的Adcetris(维布妥昔单抗),在治疗复发或难治性霍奇金淋巴瘤上,显示出了卓越的疗效和良好可控的安全性。
在Adcetris之前,难治性霍奇金淋巴瘤的标准一线治疗是联合化疗:ABVD(阿霉素+博来霉素+长春碱+达卡巴嗪)。一项关键的临床III期试验ECHELON-1显示,Adcetris联合AVD(阿霉素+长春碱+达卡巴嗪)的4年无进展生存率为81.7%,高于ABVD的75.1%,新的治疗组合可使患者的疾病进展或死亡风险降低31%。
Adcetris成为近40年来FDA批准的第一个难治性霍奇金淋巴瘤的一线用药,后续获批的适应症也主要集中在经典霍奇金淋巴瘤和间变性大细胞淋巴瘤等非实体瘤的治疗上。
为什么这些ADC,在非实体瘤上的治疗效果更好呢?
有人提出是因为白血病、淋巴瘤等非实体瘤的抗原特异性,认为与实体瘤相比,这类血液瘤抗原更易与ADC的抗体特异性结合。但笔者更认可另一种观点:ADC的技术成熟度。
这也可能是第三个原因,由于技术不成熟,早期的几款抗体药物偶联物不稳定,在血液循环时细胞毒性药物就裂解、释放,因而治疗血液瘤时表现更好,更适合非实体瘤治疗。
当然,以上并不是全部原因,且更深层的因素也为未可知,不过“管中窥豹,可见一斑”:任何新技术的应用,一款新药的开发都不是一蹴而就,需要不断尝试改进,才能至臻完善。如今技术持续突破,ADC也摆脱了应用局限。
总结
今天分享就到这里了。
这一期我们了解了阿斯利康的Lumoxiti,它是FDA二十年来首个批准用于治疗HCL的新药,也看到随着抗体药物偶联技术的成熟,未来ADC的治疗领域会越来越广阔。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多