稳定 DNA-PEI 复合物可提高悬浮慢病毒载体和 AAV 工艺的可放大性
研究人员首先介绍了影响聚乙烯亚胺转染试剂性能的工艺参数,然后实施了一种稳定策略,以在规模放大时保持转染复合物的活性。生成平均流体动力学直径在 500 和 700 nm 之间的转染复合物最能预测瞬时转染生产力,但该过程对转染复合物浓度和保持时间非常敏感。添加人血清白蛋白作为稳定剂可长时间保持最佳转染复合物大小,并改善生产规模下慢病毒载体和腺相关病毒载体悬浮工艺的过程控制。本文为原文内容简介,详细内容,请参考原文。
病毒载体,包括慢病毒载体 (LVV) 和腺相关病毒载体 (AAV),将继续在细胞和基因治疗中发挥重要作用。开发用于病毒载体生产的、基于 HEK293 悬浮细胞培养工艺的主要挑战是在规模放大时保持瞬时转染生产力。转染单元操作是开发悬浮工艺的关键步骤,对收获滴度和由此产生的工艺产量有很大影响。阳离子聚合物(例如聚乙烯亚胺 (PEI))介导的瞬时转染是将含有病毒载体基因的质粒 DNA 引入宿主细胞、以诱导载体生产的行业标准方法,并且是一种经过验证的悬浮生产工艺的有效技术。
对于悬浮工艺放大,需要维持 PEI 和 DNA 浓度以及复合物保持时间恒定。可以通过随生物反应器尺寸线性放大转染复合物的体积来保持浓度恒定。然而,由于混合不同规模的溶液所需的时间不同,以及大体积传输的速度不同,保持恒定的保持时间对规模化应用极具挑战性。这对大体积操作提出了难题,因为在细胞培养基中配制的 PEI 和 DNA 转染复合物的稳定性通常在几分钟左右,并且这些大体积混合物不能足够快地物理转移到生物反应器中,以保持一致的高滴度性能。这会在放大悬浮病毒载体工艺时,产生工艺可变性以及单位体积生产力损失的高风险,或者需要牺牲收获滴度,以提高工艺稳健性。
近年来,许多研究小组已经找到了对瞬时转染工艺进行更多控制的创新方法,主要集中在优化转染复合物大小以及提高转染复合物长时间的稳定性。这些方法包括开发具有更长保持时间的新转染试剂,通过 pH 和盐浓度变化调节转染复合物表面电荷和颗粒结合,以及用额外的试剂保护颗粒,以形成稳定的三元复合物。
Part
1
PEI-DNA复合物大小控制
PEIpro (Polyplus) 和质粒 DNA (Aldevron) 的工作溶液通过将储液稀释到化学成分确定的无血清 HEK 293 细胞培养基中至所需浓度来制备。使用 Malvern Zetasizer 仪器通过动态光散射 (DLS) 分析 PEI-DNA 复合物。在使用前,让所有材料平衡至室温(约 20°C)。所有样品均在 10 × 10 × 45 mm 方底聚苯乙烯容器 (Sarstedt xxx# 67.754) 中制备。对于动力学研究,前 5-10 分钟进行 15 秒尺寸测量,之后每 3-5 分钟进行 60 秒尺寸测量,直到研究完成。对于添加 HSA (Octapharma) 的条件,在测量间隔之间的最佳时间将 HSA 浓缩溶液直接添加到 PEI-DNA 复合物测量容器中。
HEK293瞬时转染
在摇瓶或一次性生物反应器(1 L Eppendorf DASGIP 或 10 L Eppendorf BioFlo系统)中培养悬浮 HEK293 细胞,以优化细胞密度。通过将储液稀释到细胞培养基中至所需浓度来制备 PEIpro 和质粒 DNA 的工作溶液。
对于 LVV 生产,使用了第三代 LVV 4 质粒系统,其中 4 个质粒编码 VSV-G 囊膜、gag-pol、rev 和目的基因 (GOI)。对于AAV 生产,使用 3 质粒系统,其中3个质粒编码辅助、RepCap 和 GOI。优化的质粒比率用于 LVV 和 AAV 生产。
将 PEI 工作溶液以 1:1 的体积比加入 DNA 工作溶液中,并通过移液器或涡旋混合。在添加到 HEK293 细胞培养物中之前,将该转染复合物混合液静态保持指定的保持时间。对于添加 HSA (Octapharma) 的条件,在最佳时间将 HSA 浓缩溶液直接添加到 PEI-DNA 复合物中,以达到 1 mg/mL HSA 的最终浓度,然后在添加到 HEK293 细胞培养物前,以指定的保持时间静态保持。对于摇瓶研究,通过移液将转染复合物添加到培养物中。对于生物反应器研究,转染复合物通过管路添加到培养物中。
对于 LVV 生产,在转染后优化的培养时间收集样品,离心澄清,并将上清液储存在 -80°C 直至测试。
对于 AAV 生产,在转染后优化的培养时间,样品用裂解缓冲液和核酸酶处理,通过离心或注射器过滤进行澄清,并储存在 -80°C 直至测试。
LVV 滴度检测
用含有 CAR 的 LVV 样品转导Jurkat 细胞,并使用流式细胞术测量 CAR 表达。从%CAR+ Jurkat 细胞推断样品的滴度并量化为转导单位/mL (TU/mL)。
AAV 滴度检测
Part
2
PEI-DNA复合物大小影响 LVV和 AAV 的瞬时转染收获滴度
在用于 LVV 和 AAV 生产的悬浮HEK293 细胞培养工艺的开发过程中,观察到载体滴度对加入 HEK293 细胞培养生产容器之前的 PEI-DNA 转染复合物保持时间敏感。知道这将成为一个挑战,因为随着工艺规模放大到更大的体积,转染复合物的浓度增加,目的是减少需要添加到生产生物反应器中的转染复合物的体积,缩短体积转移时间。然而,随着转染混合物浓度的增加,保持时间敏感性增加,满足较短工艺步骤持续时间所需的精度将损害生产环境中的工艺稳健性(图 1)。
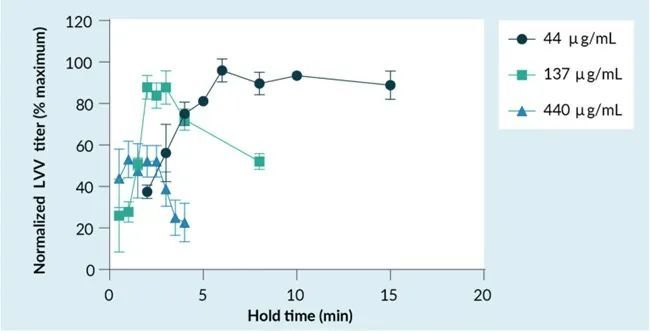
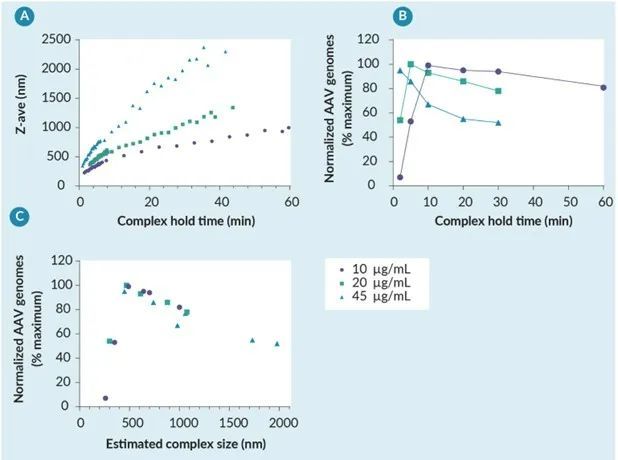
PEI-DNA复合物大小由复合物保持时间和复合物浓度控制
基于 PEI 复合物促进电荷介导的其货物内吞的作用机制,假设对保持时间的敏感性是由于PEI-DNA 复合物的大小和转染复合物被 HEK293细胞有效内吞的能力。为了验证这一假设,通过动态光散射 (DLS) 在多个浓度下随时间测量 PEI-DNA 复合物大小(图 2A)。该研究证实,PEI-DNA 复合物大小和生长动力学与复合物浓度和保持时间呈正相关,其中复合物大小随着时间的推移而增加,并且在较高浓度下以更快的速度增加。当使用不同浓度和保持时间的转染复合物生产 AAV 时,滴度结果与之前 LVV 看到的趋势相似(图 1),其中,不同转染复合物浓度的最佳保持时间不同(图 2B)。绘制 AAV 滴度与估计的复合物大小的关系图(使用图 2A 中所示的复合物保持时间和浓度数据计算),很明显,在所有测试的复合物浓度范围内,PEI-DNA 复合物大小在 500-700 nm 范围内实现了最高滴度(图 2C)。
人血清白蛋白可在延长的时间内将 PEI-DNA 复合物稳定在最佳复合物大小
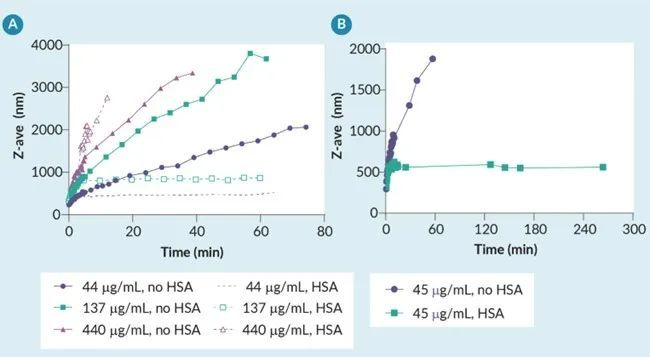
基于之前开发贴壁 LVV 工艺的经验 - 其中经常使用含有胎牛血清 (FBS) 的培养基来“淬灭”磷酸钙转染复合物的生长– 探索了一种类似的解决方案,用于在悬浮细胞的无血清化学成分确定的培养基中稳定 PEI-DNA 转染复合物,以进行 LVV 生产。据推测,引入人血清白蛋白 (HSA) 可能对 PEI-DNA 复合物具有与在磷酸钙转染中使用 FBS 观察到的相似的稳定作用。为了验证这一假设,使用动态光散射测量用于 LVV 生产的 PEI-DNA 复合物,在此期间,基于先前使用转染复合物进行的病毒载体生产实验,在先前定义的最佳保持时间将浓缩的 HSA 添加到没有HSA的转染复合物混合液中。对于最佳保持时间大于 2 分钟的转染复合物,HSA 能够使转染复合物大小稳定 4 小时,这是在 DLS 上测量的最长持续时间(图 3)。对于高度浓缩的转染复合物,HSA 的添加时机可能为时已晚,无法防止转染复合物聚集,因为复合物的大小已经超出最佳范围(> 1000 nm)。
稳定的 PEI-DNA 复合物为 LVV 和AAV瞬时转染生产提供改进的工艺控制以及可放大性
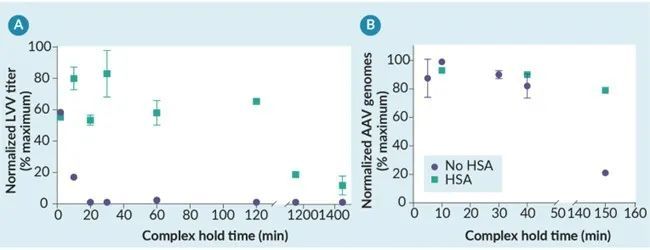
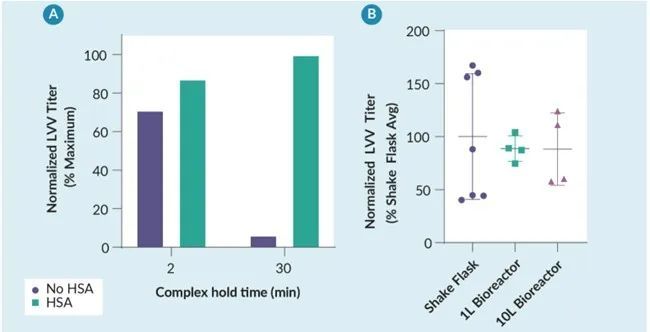
然后将人血清白蛋白稳定的 PEI-DNA 转染复合物用于 LVV 和 AAV 的实验室规模生产。在摇瓶规模下,HSA 稳定的转染复合物可以在室温下保持长达 2.5 小时,而对病毒载体滴度没有任何明显的负面影响(图 4)。在使用不同的最佳细胞培养基、细胞密度和转染复合物浓度的 LVV 和 AAV 工艺中都观察到了这一点,证明了这种工艺控制策略的通用性。
Part
3
维持悬浮 HEK293 细胞培养以产生 LVV 和 AAV 的生产力取决于在工艺放大过程中对转染单元操作的一致控制。PEI-DNA 转染复合物效率的时间敏感性对规模放大提出了挑战,如果不满足“狭窄”的保持时间,可能会导致收获滴度的降低。混合期间的转染复合物浓度和将转染复合物添加到 HEK293 细胞培养物之前的保持时间都是影响转染复合物大小和形成速率的关键工艺参数。尽管在LVV和AAV两个生产工艺中的其它参数(细胞培养基、细胞密度和转染复合物浓度)方面存在差异,但 500–700 nm 的最佳转染复合物尺寸导致 LVV 和 AAV 生产过程中的收获滴度最高。人血清白蛋白成功地将转染复合物稳定在这个理想大小范围内长达4个小时,显著提高了病毒载体生产中转染单元操作的可制造性和一致性。这种三元PEI-DNA-HSA 转染复合物是一种直接、可商购且符合 cGMP 的解决方案,用于在放大针对细胞和基因治疗应用的悬浮 HEK293 细胞培养瞬时转染病毒载体工艺时,提高转染单元操作的一致性。使用重组人白蛋白开发类似的方法将是无动物源性工艺的潜在替代方案。在目前的状态下,这种方法特别适合用于制造细胞治疗产品中LVV 和 AAV。
原文:B.Olden, H.Seo, R.Barnes, et al., Stabilizing DNA–PEI complexes improves scalability of suspension lentiviral viral vector and AAV processes. Cell & Gene Therapy Insights 2022; 8(8), 985–992.
END
撰稿人 | SYZ
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多