上市药品杂质检验中未知色谱峰的识别与调查
那么药品企业如何在药品批准上市之后,尤其是涉及到药品质量的变更发生时保证药品杂质始终处于可控状态?最关键也是最直接的一步就是通过杂质检验的色谱图,识别色谱图中的未知色谱峰并对其进行调查研究。建议操作步骤如下:
Part
1
查看每一个批次产品色谱图,将每一张样品色谱图放大到基线进行检查,确保小的色谱峰能够被发现。进样稀释液或空白溶液其色谱图与样品色谱图进行对比排除溶剂峰。色谱柱空体积后出现的任何非典型色谱图中的色谱峰,都认为是潜在的未知色谱峰。
Part
2
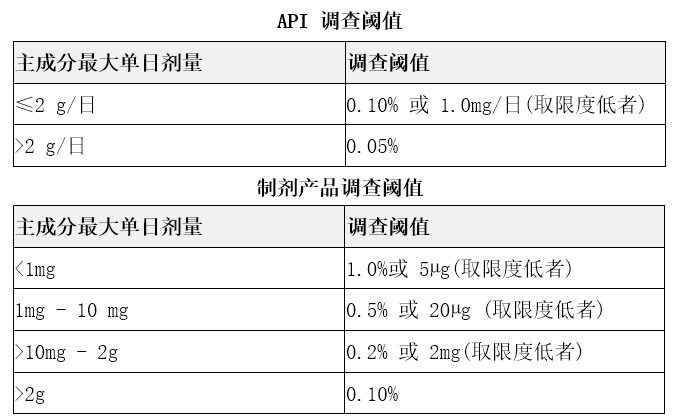
Part
3
人为引入的色谱峰一般产生的原因如下:
空白稀释液
样品溶液
色谱系统引入
样品制备过程
如果实验室调查无法确认未知峰为人造峰,实验室调查总结将未知峰报告为未查明色谱峰。
Part
4
如果是因为变更而产生的未知色谱峰,建议即使含量未超过阈值也应对其进行调查,确定是否为基因毒性杂质。
Part
5
Part
6

END
撰稿人 | Julie
责任编辑 | 许飞
审核人 | 何发
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多