中国生物仿制药单克隆抗体总览分析
单克隆抗体(mAb)于1986年首次上市,已经发展成为疾病的重要治疗药物,尤其是肿瘤和自身免疫性疾病。截至2021年,中国上市的mAb超过40种,其中大部分是进口的。与化疗药物相比,mAb提供了更多的疗效、更多的特异性,但成本更高。高昂的医疗费用成为患者和社会的负担,阻碍了中国mAb市场的发展。由于生物仿制药的竞争不断加剧,mAb的价格降低,准入增加。例如,在中国,2016年曲妥珠单抗(赫赛汀®)的价格为24500,然后在进入医保目录后下降到7600。2020年,赫赛汀®的生物仿制药Zercepac®在中国的上市,帮助患者接受有效、经济的治疗。不同于仿制药,生物类似药由于分子量大、结构复杂、生产工艺未公开,不能与原研药相同。
复宏汉霖仿制的利妥昔单抗注射液自2019年上市以来,在中国研发了142个涉及16个靶点的生物仿制药mAb,其中10个已上市(图1)。中国在该领域有超过60家制药公司。代表公司包括复宏汉霖、海正药业、美罗华、华兰生物、生物技术、正大天晴、信达生物等。
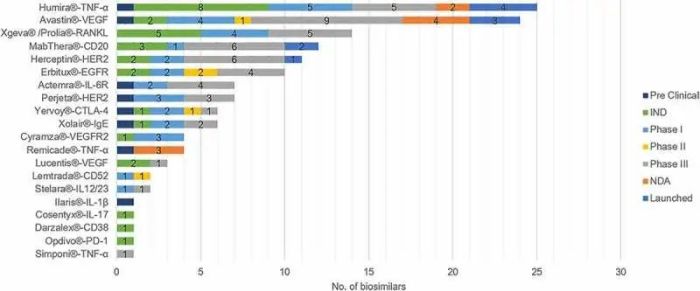
图1. 中国不同生物类似药研发数量
在美国和欧盟,生物仿制药产品的发展同样迅速。非格司亭-sndz(Zarxio®)是美国食品药品监督管理局(FDA)于2015年3月批准的首个生物仿制药产品。截至2022年4月,FDA批准了35个生物仿制药产品,2019年批准了28.6%(10/35)的产品。生长激素(Omnitrope®)是全球首个生物仿制药产品,于2006年4月12日获得欧洲药品管理局(EMA)批准。此后,68个生物仿制药产品获得EMA批准,17个被拒绝退出。至于生物仿制药mAb,FDA和EMA分别批准了18种和32种生物仿制药产品。
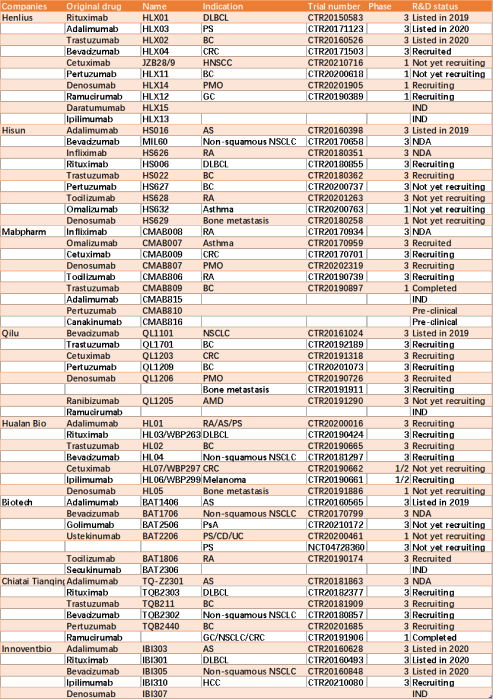
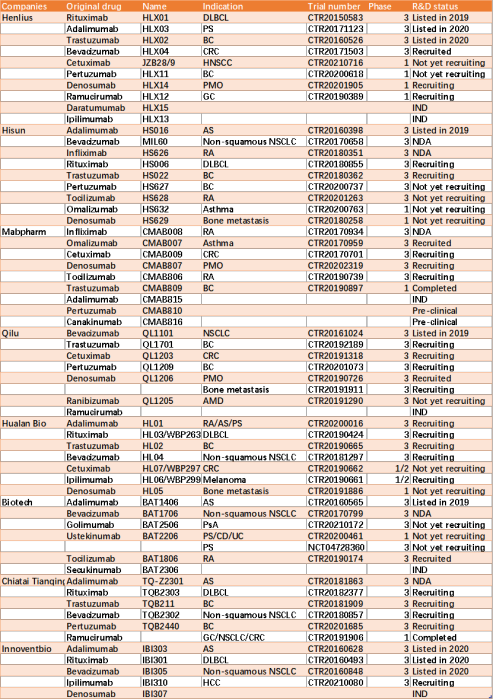
生物类似药开发、审查和批准
2015年,生物类似药的概念首次由国家药品监督管理局(NMPA)在中国定义,并宣布了《生物类似药开发与评价技术指导原则(试行)》。此后,相关制度不断完善,形成了完整的生物类似药审批制度。图2显示了参比制剂和生物仿制药的开发过程。
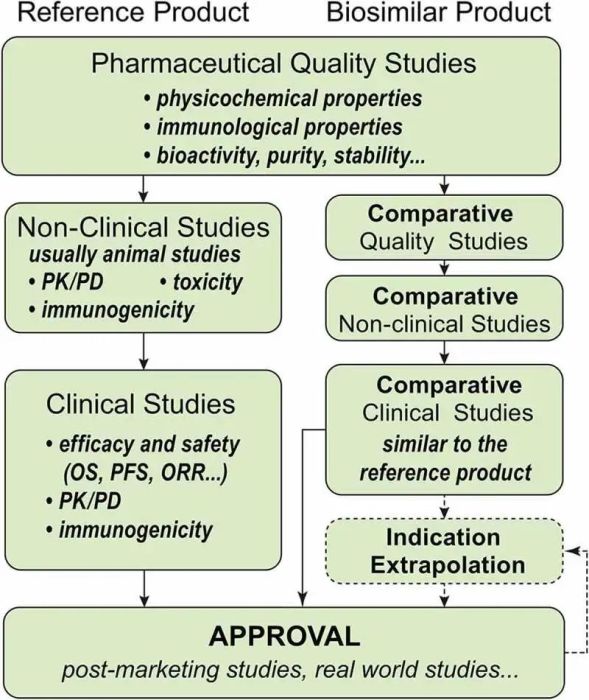
图2. 参比制剂和生物仿制药的开发过程
与FDA相同,生物类似药的相似性意味着它们具有相同的氨基酸序列、结构、纯度、化学同一性、生物活性和其他产品特性。一些微小差异是可接受的,例如宿主细胞、处方和可接受的产品内差异。生物仿制药和参比制剂之间的差异应不具有安全性和有效性意义。
FDA和NMPA在生物仿制药开发中的要求相似。拟定生物仿制药生产商应提供从包括药学研究、非临床研究(动物研究)和临床研究的系统工艺中评价的比较数据。药学研究包括理化性质、生物活性、纯度(杂质)、免疫学性质和稳定性,证明该生物制品与参比制剂高度相似。非临床研究的设计取决于药学研究的结果,通常包括药代动力学、药效学、免疫原性和毒性。临床研究还包括评估在参比产品获批的一种或多种适应症中的免疫原性、药代动力学、药效学和临床研究。
FDA和NMPA均同意,无需在该适应症中对生物类似药进行直接研究,即可批准生物类似药用于该适应症。然而,外推并不是自动的。NMPA认为,适应症外推需要同时满足以下条件:
1)已完成的比较研究使用了敏感的临床试验模型,未检测到临床差异;
2)适应症的临床相关机制和/或相关受体相同;
3)生物仿制药的安全性和免疫原性已得到充分评价,拟申报的外推适应症无特殊或额外的安全性问题。
生物仿制药单克隆抗体的专利审查
当前共84项生物仿制药mAb的专利,其中63项处于保护期或检查期。如图3所示,大部分专利都是关于配方的改进。2015年至2020年授权的专利数量约为2015年之前的两倍。
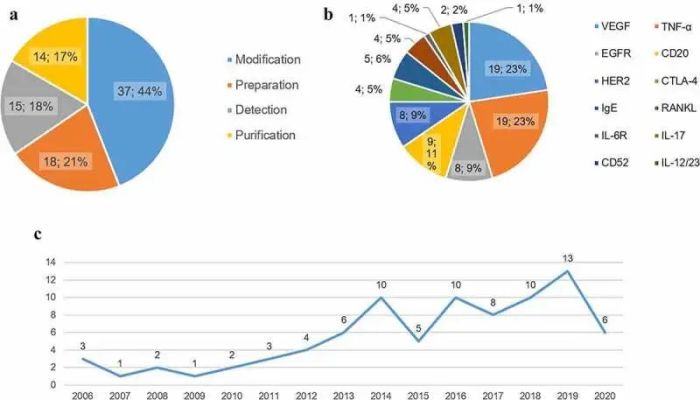
图3.中国生物仿制药专利概述
抗TNF-αmAb生物类似药相关专利19项,其中处方修改专利9项(47.4%),制剂技术专利5项(26.3%),纯化专利4项(21.0%),检测方法专利1项(5.3%)。
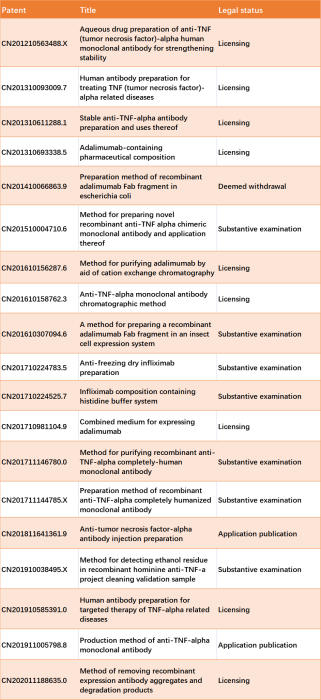
VEGF靶向抗体 VEGF在肿瘤中的过表达与大多数、转移、复发和预后相关。已经上市了几种靶向VEGF-VEGFR信号通路的mAb。贝伐珠单抗是一种VEGF靶向人源化IgG1抗体,在中国获批用于治疗结直肠癌(CRC)、非小细胞肺癌(NSCLC)和胶质母细胞瘤。自2010年上市以来,安维汀®价格下降了61.4%。在中国,贝伐珠单抗的抗体序列专利于2018年到期。齐鲁制药的贝伐珠单抗于2019年获批上市,成为首个国内生产的贝伐珠单抗生物仿制药。信达生物和绿叶制药的生物类似药已获批上市,显著降低了患者的医疗成本。所有生物类似药均显示出相当的疗效、安全性和质量。有19项关于VEGF靶向生物仿制药mAb的专利。9项(47.4%)专利与处方创新相关,而关于制备、纯化和检测的专利分别为4项(21.0%)、3项(15.8%)和3项(15.8%)。
RANKL靶向抗体 RANKL信号转导的功能包括骨重建、免疫调节、细胞生长和分化以及其他器官的发育。肿瘤转移影响患者的预后,是肿瘤学研究的热点。狄诺塞单抗是一种人源IgG2抗体,是首个以RANKL为靶点的mAb,在中国获批用于骨巨细胞瘤、骨折高危的绝经后骨质疏松女性以及多发性骨髓瘤和实体瘤骨转移。几项临床试验(NCT00926380、NCT00089674、NCT00321620、NCT00089791、NCT00523341、https://clinicaltrials.gov)支持denosumab的疗效。denosumab生物类似药的市场处于萌芽期。中国制药公司的9个生物类似药正在进行临床研究,5个生物类似药正在进行新药临床试验(IND)。
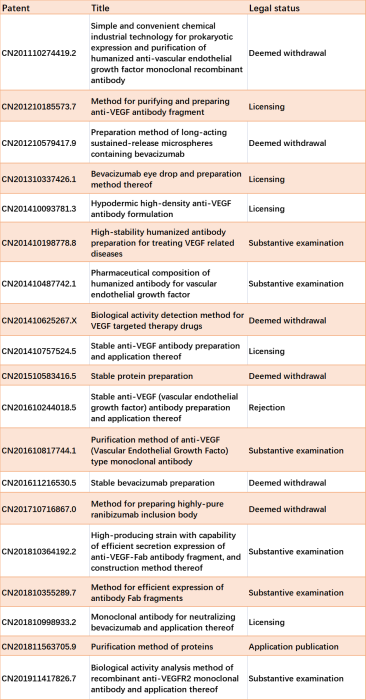
CD20靶向抗体 利妥昔单抗是首个获批临床用于肿瘤学的mAb,是靶向CD20的嵌合IgG1抗体,用于治疗非霍奇金淋巴瘤(NHL)和慢性淋巴细胞白血病(CLL)。化疗联合利妥昔单抗是杀死恶性CD20阳性细胞的典型治疗方法。氟达拉滨、环磷酰胺和利妥昔单抗(FCR)的化学免疫治疗是CLL的一线治疗,在长期随访中显示出巨大的疗效和安全性。利妥昔单抗(Mab Thera®)的专利于2015年到期,刺激了利妥昔单抗生物类似药的市场。在中国,2019年和2020年,复宏汉霖和信达生物分别有2个生物类似药上市,共12个生物类似药。
HER2靶向抗体 来自ErbB家族的HER2(也称为受体酪氨酸蛋白激酶ErbB-2)是原癌基因的产物。ErbB通路是一个复杂的生物学信号网络,调节细胞的凋亡、迁移、生长、粘附和分化。HER2过度表达导致肿瘤的发生和侵袭,并可增加转移风险。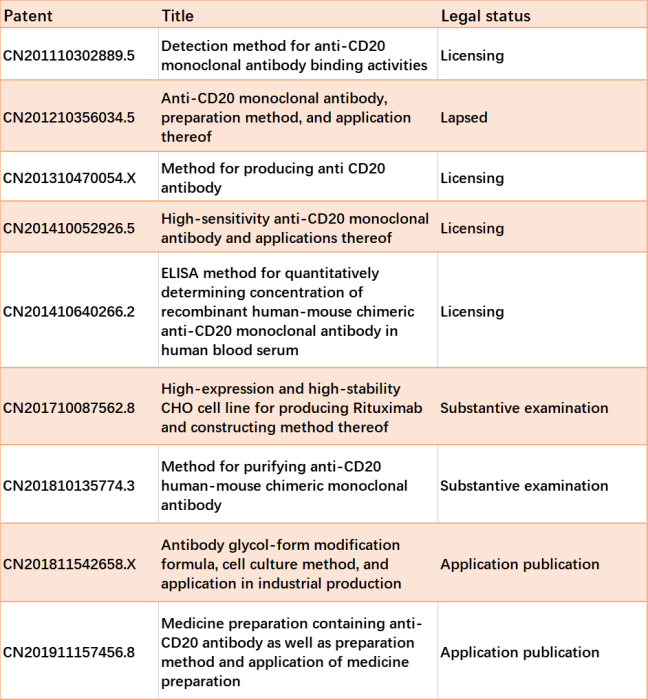
抗HER2治疗是HER2阳性乳腺癌的典型治疗方法,如曲妥珠单抗和帕妥珠单抗(抗HER2人源化IgG1抗体)。根据几项临床试验(NCT00567190、NCT00567190、NCT02131064),曲妥珠单抗、帕妥珠单抗和化疗的药物组合在HER2阳性转移性乳腺癌中显示出疗效,使这些患者获益。Zercepac®的可用性改变了现状。由复宏汉霖公司生产的Zercepac®是曲妥珠单抗的首个生物仿制药,由于临床试验结果良好,已获得赫赛汀®(曲妥珠单抗)在中国获批的所有适应症至2021,曲妥珠单抗和帕妥珠单抗的18种生物仿制药已进入抗HER2生物仿制药的竞争。
EGFR靶向抗体 EGFR通路调节癌细胞增殖、凋亡阻断、侵袭和转移,EGFR的突变或过表达存在于不同的人类癌症中,这意味着EGFR是肿瘤治疗的理想靶点。西妥昔单抗(爱必妥®)是一种抗EGFR嵌合IgG1抗体,用于治疗转移性结肠癌和头颈部鳞状细胞癌(HNSCC)。爱必妥®的专利已于2017年到期,但在中国仅有10种生物类似药,均未完成临床试验。Kelun、Annpobio和Mabpharm正在推进其III期临床试验(CTR20202451、CTR20192102、CTR20170701)。
其他单克隆抗体及其生物仿制药专利 CD38和程序性细胞死亡1(PD-1)是无生物仿制药专利的靶点。CD38是一种膜上糖蛋白,可催化环腺苷二磷酸核糖的合成和降解,在多发性骨髓瘤(MM)细胞中高表达。人源IgG1抗体daratumumab是唯一获批用于MM的抗CD38 mAb,尚未在中国上市。复宏汉霖生物仿制药HLX15的IND已获得NMPA批准。
PD-1是近年来研究较深入的检查点。Nivolumab(Opdivo®)是治疗NSCLC、HNSCC和胃癌(GC)的典型PD-1 mAb,在IND中具有生物仿制药(LY01015)。中国有4个创新PD-1 mAb,信迪利单抗(TYVYT®)、camrelizumab(Airuika®)、替雷利珠单抗(Baizean®)、toripalimab(Tuoyi®),丰富了市场,为患者提供了更多的选择。
奥马珠单抗是一种获批用于治疗哮喘的人源化IgG1抗IgE mAb。B细胞在变应原作用下产生的IgE在哮喘的炎症中起着至关重要的作用。目前发现6个生物类似药和3个具有有效性的专利。这些专利改善了抗IgE mAb的稳定性和质量。
白细胞介素(ILs)是由淋巴细胞、巨噬细胞和单核细胞产生的低分子量细胞因子,参与免疫反应和细胞信号传导[107-109]。多种ILs已被广泛研究并开发为新的治疗靶点,针对这些ILs的大多数mAb已获批用于自身免疫性疾病,如乌司奴单抗(抗IL-12/23)、托珠单抗(抗IL-6)和司库奇尤单抗(抗IL-17)。托珠单抗在中国的生物类似药多于其他两种mAb,临床试验中有6个生物类似药(CTR20190174、CTR20190739、CTR20201263、CTR20190002、CTR20191204、CTR20192563、http://www.cde.org.cn)。
生物仿制药mAb在中国的专利中,共发现263项专利,其中84项专利与生物类似药mAb有关。这些专利中共有63项(75.0%)处于保护期。生物仿制药mAb专利的主要靶点是VEGF、TNF-α、CD20、EGFR和HER2。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多